kromě zpracování bílkovin, ER a Golgiho také starat o některé typy bílkovin dopravy. Váčky (membrane-bound bubliny, v podstatě) špetka pryč od ER, Golgi, a dalších membránových organel, nese s sebou, ať už rozpustné molekuly byly uvnitř tekutiny, která byla uzavřena, stejně jako jakékoliv molekuly vložené v té části membrány. Tyto puchýřky se pak svézt na molekulární motor jako kinesin nebo myosin, a cestovat podél cytoskeletu, až se dock na příslušné místo určení a pojistkou s cílovou membránou nebo organela. Obecně se vezikuly pohybují od ER k cis Golgi, od cis k mediálnímu Golgi, od mediálního k trans Golgi a od trans Golgi k plazmatické membráně nebo jiným kompartmentům. Ačkoli většina pohybu je v tomto směru, existují také vezikuly, které se pohybují zpět z Golgiho do ER, nesoucí proteiny, které měly zůstat v ER (např. PDI) a byly náhodně nabrány do vezikuly.
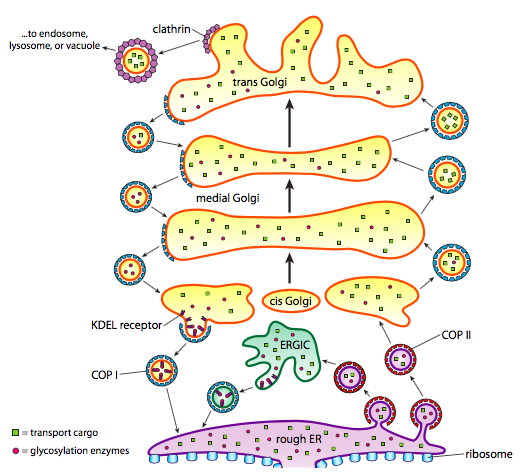
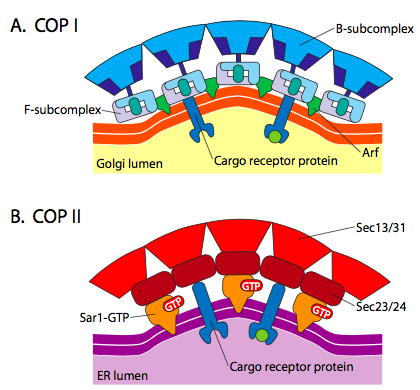
tvorba váčků je závislá na kabát proteiny, které se za vhodných podmínek, self-montáž do kulové klece. Když jsou spojeny s transmembránovými proteiny, mohou také přitáhnout připojenou membránu do sférického tvaru. Hlavní typy proteinů srsti používaných při tvorbě vezikul jsou COPII, COPI a klathrin.
COPII coat proteiny tvoří vezikuly, které se pohybují z ER do Golgiho. Úbytek biodiverzity kabát proteiny se používají mezi části Golgiho aparátu, jakož i k formě váčků z Golgiho zpět do ER. Nakonec se klathrin používá k tvorbě vezikul opouštějících Golgiho pro plazmatickou membránu i pro vezikuly vytvořené z plazmatické membrány pro endocytózu.
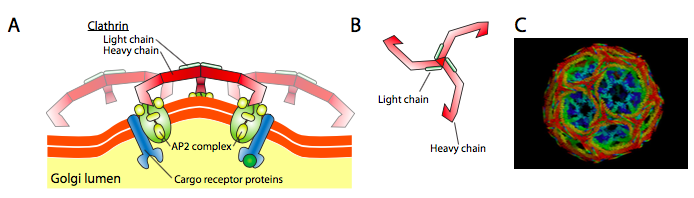
Clathrin (Obrázek \(\PageIndex{17}\)) je nejlépe popsat ze tří, a vezikulární kabáty jsou vyrobeny z uspořádání clathrin triskelions (z řečtiny, což znamená tři-legged). Každý triskelion se skládá ze tří těžkých řetězů spojených dohromady na C-konci, a tři lehké řetězy, jeden spojený s každým těžkým řetězcem. Těžké řetězy různých triskelionů interagují po celé délce svých těžkých řetězových „nohou“ a vytvářejí velmi robustní konstrukci. Světelné řetězce jsou pro tvorbu vezikul zbytečné a předpokládá se, že pomáhají předcházet náhodným interakcím molekul klathrinu v cytoplazmě.
Existuje značná podobnost mezi váček vytvoření mechanismů, pomocí těchto různých kabát proteiny, začíná s náborem ARF1 (ARF je zkratka pro ADP ribosylation factor, který nemá nic společného s jeho funkcí zde) na membránu. To vyžaduje ARNO-usnadněnou výměnu GTP za GDP (ARNO je ARF nukleotidové vazebné místo). Jakmile ARF1 naváže GTP, konformační změna odhalí n-koncovou myristoylovou skupinu, která se vloží do membrány. Oba úbytek biodiverzity a clathrin-coated vesicles použití ARF1 a ARNO, ale COPII používá podobné proteiny zvané Sar1p a Sec12p.
Číslo \(\PageIndex{18}\). POLDA-coated vesicles
ARF1 (nebo Sar1p) je použita na nábor adaptér proteiny, které se vážou na „ocas“ end membrány vázané receptorové proteiny. Obchodní konec těchto receptorů se váže na molekuly car – go, které je třeba zabalit do vezikuly. Adaptační proteiny působí jako vazba mezi membránou (prostřednictvím receptorů) a proteiny srsti. Pro klathrin jsou adapterové proteiny AP1 pro vezikuly odvozené od trans-Golgiho a AP2 pro endocytární vezikuly. Pro úbytek biodiverzity váčků, přibližné homology jsou β-, γ-, δ-, a ζ – Policajti zatímco COPII systém využívá Sec23p a Sec24p.
a Konečně, adaptéry odkaz na aktuální kabát bílkoviny: clathrin, α nebo ε – POLICAJT, Sec13p a Sec31p. Co tyto proteiny mají všechny společné je to, že spontánně (tj. bez jakéhokoli požadavku na energetický výdej) se samy sestavují do sférických struktur podobných kleci. Pod elektronovým mikroskopem, clathrin-křídový puchýřky jsou více ostře definované a hexagonální a pětiúhelníkové tvary ohraničené clathrin podjednotky dát váček „fotbalový míč“. Vezikuly potažené COP coatamerem mají pod EM mnohem rozmazanější vzhled.
Všechny tři typy váčků kabát proteiny mají schopnost se samovolně spojovat do kulovitého postavit, ale pouze úbytek biodiverzity a do roku potažený váček také spontánně „pinch-off“ membrány k uvolnění váčků z jeho původní membrány. Vezikuly potažené klatrinem vyžadují vnější mechanismus k uvolnění vezikuly (obrázek \(\PageIndex{19}\)).
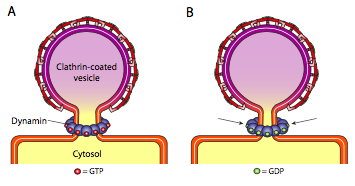
jakmile je vezikul téměř dokončen, stále existuje malá stonka nebo hrdlo membrány, která spojuje vezikul s membránou. Kolem tohoto stonku se dynamické molekuly GTP agregují v kruhové / spirálové konstrukci. Molekuly dynaminu jsou globulární GTPázy, které se stahují při hydrolýze GTP. Když se budou sdružovat kolem váčku stonek, každý dynamin bílkovin smlouvy, s kombinovaným účinkem škrtící páčku natolik, že membrána tlačí dohromady, utěsnění a uvolnění váčku z membrány.
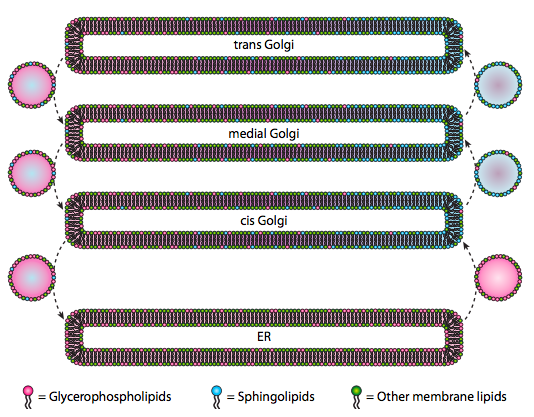
i když lipidy a membrány byly diskutovány v kapitole 4, jsme zanedbali o umístění jejich syntézy v eukaryot. Jak ukazuje obrázek \(\PageIndex{20}\), syntéza určitých typů lipidů je segregovaná a exkluzivní. Glycerofosfolipidy se primárně tvoří v endoplazmatickém retikulu, i když se také vyrábějí v mitochondriích a peroxisomech. Naproti tomu sfingolipidy se nevytvářejí v ER (ačkoli jejich prekurzory ceramidu jsou) u savců, potřebné enzymy se nacházejí v lumenu cis a mediálního Golgiho. Existují důkazy o anterográdní a retrográdní vezikulární dopravě mezi různými kompartmenty Golgi a ER, což by teoreticky naznačovalo redistribuci lipidových typů. Sfingolipidy však mají tendenci se agregovat do lipidových raftů a zdá se, že jsou koncentrovanější ve vezikulech pohybujících se anterográdní cestou.
proteiny srsti se uvolňují krátce po uvolnění vezikulární tkáně. Pro klathrin proces zahrnuje Hsc70, ATPázu. U vezikul potažených COPI nebo COPII se však zdá, že hydrolýza GTP na ARF / Sar1p oslabuje afinitu proteinu srsti k adaptérům a iniciuje nepotahování. Aktivátor GTPázy je ARF GAP (nebo Sec23p) a je nedílnou součástí povlaku COP I (nebo II).
vezikuly nesou dvě kategorie nákladu: rozpustné proteiny a transmembránové proteiny. Z rozpustných proteinů jsou některé zachyceny ve vezikulu tím, že jsou vázány na receptor. Další proteiny náhodou v okolí a nabral jako formy váčku. Občas, protein je přijata, která neměla být, například, PDI může být uzavřené ve váčku tvoří z ER. Má malou funkci v Golgi, a je potřeba v ER, tak co se s tím stane? Naštěstí PDI a mnoho dalších er proteinů mají C-terminální signální sekvenci, KDEL (lysin-kyselina asparagová-kyselina glutamová-leucin), která křičí „patřím do ER.“Tato sekvence je uznána KDEL receptory uvnitř Golgiho a vazba KDEL proteinů na receptory spouští váčků formace, aby je poslat zpět do ER.
sekreční vezikuly mají zvláštní problém s rozpustným nákladem. Pokud váčku bylo spoléhat pouze na obvodových proteinů v průběhu procesu tvorby, bylo by obtížné získat vysoké koncentrace těchto proteinů. Mnoho vylučovaných proteinů potřebuje organismus rychle a ve významných množstvích, takže v trans Golgi existuje mechanismus pro agregaci sekrečních proteinů. Mechanismus používá agregační proteiny, jako je sekretogranin II a chromogranin B, které spojují cílové proteiny ve velkých koncentrovaných granulích. Tyto granins nejlépe pracovat v trans-Golgiho prostředí nízké pH a vysoké Ca2+, takže když váčků uvolní jeho obsah mimo buňku, vyšší pH a nižší Ca2+ rozpadne agregátů k uvolnění jednotlivých proteinů.
během zrání Golgiho dochází ke konzistentní změně pH, takže při přechodu z ER do Golgiho má každý kompartment postupně nižší (kyselejší) lumenální pH.
konečně existuje otázka cílení na vezikuly. Vezikuly jsou mnohem méně užitečné, pokud jsou hodeny na molekulární nákladní vlak a náhodně vysazeny. Proto, tam je dokovací mechanismus, který vyžaduje odpovídající v-SNARE proteiny na váčku je cytoplazmatický povrch a t-SNARE na cytoplazmatické povrchu cílové membrány. Fúze vezikuly s membránou probíhá pouze v případě, že existuje shoda. Jinak, váček nemůže pojistky, a bude to připojit na jinou molekulární motor do hlavy, aby další, doufejme, že správné určení. Tento proces je podporovaný tethering proteiny, které zpočátku navázat kontakt s příchozí váček a kreslit to dost blízko k cíli, aby test pro SNARE protein interakce. Další proteiny na váček a cílové membrány pak komunikovat a pokud Nástrah zápas, může pomoci „naviják“ váčku na cílovou membránu, načež membrány fúzují. Důležitým pravidlem pro pochopení vezikulární fúze a také směr membránových proteinů a lipidů, je, že cytoplazmatické straně membrány je vždy bude čelit cytoplazmě. Proto bude protein, který se nakonec nachází na vnějším povrchu buněčné membrány, vložen do lumenálního povrchu membrány ER.
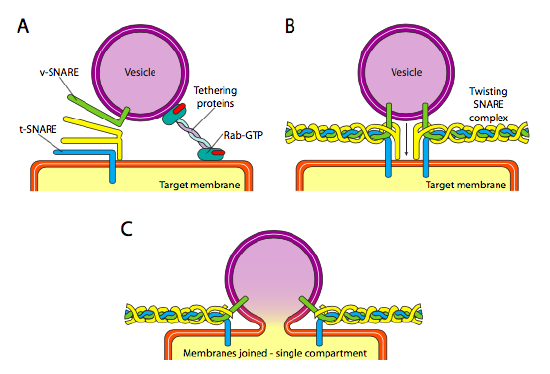
Více konkrétně, jako váček se blíží k cílové membráně, tethering protein Rab-GTP, který je spojen s cílovou membránou přes dvojitou geranylgeranyl lipidů ocas, volně se stýká s váčku a drží je v okolí cílové membrány dát NÁSTRAH šanci pracovat. V-SNAREs a t-SNAREs mají nyní příležitost komunikovat a testovat zápas. Nedávno byly nástrahy přejmenovány na R-nástrahy a Q-nástrahy na základě konzervovaných zbytků argininu a glutaminu. Kromě těchto dvou základních Nástrah, alespoň jeden další SNARE je zapojen, společně tvoří svazek čtyř α-šroubovice (čtyři, ne tři, protože alespoň v to nejlepší studoval například, jeden z Nástrah je ohnutá kolem tak, že dva z jeho alfa-helikální domény se účastnit interakce. Čtyři šroubovice se omotávají kolem sebe a předpokládá se, že když tak činí, táhnou vezikulu a cílovou membránu dohromady.
tetanový toxin, tetanospasmin, který je uvolňován bakteriemi Clostridium tetani, způsobuje křeče působením na nervové buňky a zabraňuje uvolňování neurotransmiterů. Mechanismus spočívá v tom, že štěpí synaptobrevin, SNARE protein, takže synaptické vezikuly se nemohou spojit s buněčnou membránou. Botulotoxin z Clostridium botulinum také působí na nástrahy, aby zabránil fúzi vezikul a uvolňování neurotransmiterů, i když se zaměřuje na různé neurony, a proto má opačný účinek: tetanus je způsoben tím, že zabraňuje uvolňování inhibičních neurotransmiterů, zatímco botulismus je způsoben tím, že zabraňuje uvolňování excitačních neurotransmiterů.