adhezi Buněk
adheze Buněk je proces, při kterém buňky v interakci s konkrétní molekuly na povrchu buňky a připojit k sousední buňky. Tento proces může dojít prostřednictvím přímých nebo nepřímých interakcí mezi buněčnými povrchy, kde buňky připojit k okolní extracelulární matrix, který obsahuje molekuly uvolněné buňky do prostoru mezi buňkami. K adhezi buněk dochází, když molekula buněčné adheze (CAM) interaguje s transmembránovým proteinem umístěným na povrchu buňky. Adheze buněk spojuje buňky různými způsoby a může se podílet na přenosu signálu, aby buňky mohly detekovat a reagovat na změny v okolním prostředí. Mezi další buněčné procesy regulované adhezí buněk patří migrace buněk a vývoj tkání v mnohobuněčných organismech. Změny adheze buněk mohou narušit důležité buněčné procesy a vést k řadě onemocnění, včetně rakoviny a artritidy. Adheze buněk je také nezbytná pro onemocnění způsobená infekčními organismy, jako jsou bakterie nebo viry.
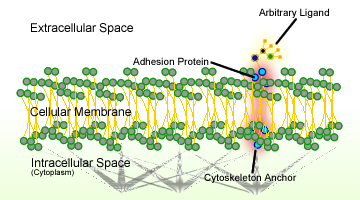 Obrázek 1. Schéma buněčné adheze
Obrázek 1. Schéma buněčné adheze
Klasifikace
Kamery jsou rozděleny do čtyř hlavních rodin: integrins, imunoglobulin (Ig) nadčeleď, cadherinu a selectins. Každá z těchto adhezních molekul má jinou funkci a rozpoznává jiný ligand. Kadheriny a imunoglobuliny jsou homotypové vačky, protože se váží přímo na stejný typ vačky na jiné buňce, zatímco integriny a selektiny jsou heterologní vačky, které se vážou na různé typy vačky. Defekty adheze buněk jsou často připisovány defektům exprese CAMs. V mnohobuněčných organismech vazba mezi vačkami způsobuje, že se buňky navzájem přilnou a vytvoří strukturu zvanou buněčná křižovatka.
Podle jejich funkcí, buněčné spoje mohou být klasifikovány jako:
Kotvení spoje (adherens junctions, desmozomy a hemidesmosomes), které udržují buňky spolu a posiluje kontakt mezi buňkami.
uzavírá křižovatky (těsné křižovatky), které utěsňují mezery mezi buňkami kontaktem buňka-buňka a vytvářejí voděodolnou bariéru pro difúzi.
Kanál tvořící spoje (gap junctions), které spojuje protoplazmy sousedních buněk umožňující transport molekul se vyskytují mezi buňkami.
signal-relaying junctions, což mohou být synapse v systému.
Alternativně, buněčné spoje lze rozdělit do 2 hlavních odrůd v souladu s tím, co interaguje s buněčnou: cell–cell junctions, v hlavní zprostředkovat tím, cadherins, a buňka–matrix křižovatkách, v hlavní zprostředkovat tím, integrins.
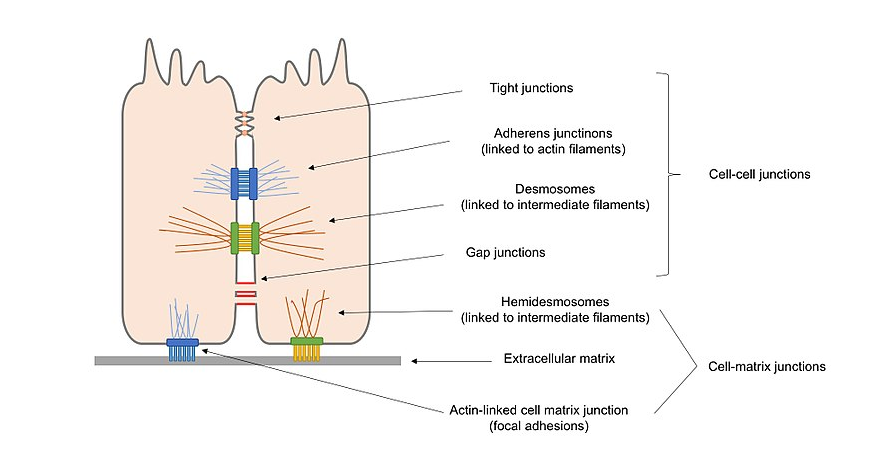 Obrázek 2. Přehledový diagram různých typů buněčných spojů přítomných v epiteliálních buňkách, včetně buněčných spojů a buněčných maticových spojů.
Obrázek 2. Přehledový diagram různých typů buněčných spojů přítomných v epiteliálních buňkách, včetně buněčných spojů a buněčných maticových spojů.
strukturální charakteristiky buněčných adhezních proteinů
buněčné adhezní proteiny jsou obvykle glykoproteiny, které zprostředkovávají rozpoznávání buněčné a buněčné extracelulární matrice na extracelulárním povrchu. Většina buněčných adhezních molekul má podobné konformace ve svých adhezivních doménách. Například: adhezivní domény kadherinu, imunoglobulinu, fibronektinu typu III a EGF jsou převážně struktury β-listů. Společným motivem účastní buněčné adheze je řecký klíč barel struktura obsahující jeden nebo dva anti-paralelních β sendviče.
Ig-like domény jsou hlavní třídou řeckých klíčových domén. Mají sekvenční podobnosti s proměnnou nebo konstantní doménou protilátek obsahujících sedm až devět antiparalelních β řetězců. Anti-paralelní P listy tvoří 3-D β-barel. Domény podobné Ig jsou stabilizovány hydrofobními jádrovými a disulfidovými vazbami. Jsou rozděleny do dvou hlavních sad: ig C-like a Ig V-like domén.
funkčně související strukturní charakteristiky buněčných adhezních proteinů
buněčné adhezní proteiny mají funkční rozmanitost. Interakce buněčných adhezních molekul může být homofilní nebo heterofilní interakce protein-protein nebo interakce protein-uhlohydrát. Strukturální změny molekul adheze buněk často souvisejí s jejich funkčními vlastnostmi.
Homofilní Interakce Protein-Protein.
například kadheriny jsou transmembránové Ca2 + – dependentní homofilní adhezní molekuly. Kadheriny jsou zodpovědné za udržování spojení mezi podobnými buňkami v tkáních. Adheze mezi buňkami je zprostředkována N-terminální doménou kadherinů. Obsahuje pět podobných extracelulárních domén EC1 až EC5. Rentgenové krystalografické studie v N-cadherin ukázal, že ES1 domény tvoří dimer, ve kterém monomery jsou orientovány paralelně s jejich adhezní vazba povrchové směřující ven z plazmatické membrány. Na monomerní jednotky ES1 domén komunikovat s navzájem antiparalelní způsobem, pomocí jejich lepicí závazné povrchů a tvoří β-barel struktury. Domnělý rozhraní interakce bylo navrženo, aby mají jak hydrofobní a polární/nabitá znak, který napodobuje rozhraní interakce imunoglobulinů domén s jedním další v Ig nadčeleď.
Heterofilní Interakce Protein-Protein.
například vazba integrinů na různé receptory buněčného povrchu a ligandy extracelulární matrice je hlavní třídou heterofilní interakce protein-protein v buněčných adhezních systémech. Po vazbě na rozpustný fibrinogen se integrin aIIbß3 převede na vazebný stav s vysokou afinitou. Konformační změny integrinu indukované vazbou ligandu jsou v tomto případě kritické pro jeho adhezivní aktivitu. Vazba T-cell receptor může také modulují vazebnou afinitu pro integrin, leukocytů funkce spojené antigenu – 1 (LFA-1), jeho receptory, jako jsou ICAM-l nebo ICAM-2 (mezibuněčnou buněčnou adhezní molekulou). Vazba ICAM-l může dále indukovat konformační změny LFA-1. Adhezivní vazebné místo proteinu je umístěno v C-terminálu LFA-l na základě rentgenové krystalografické studie.Tripeptid, kyselina arginin-glycin-asparagová (RGD), je společným motivem vazby integrinového ligandu. Například modul fibronektinu vázajícího ligand typu III má řeckou strukturu klíčového hlavně, jehož motiv RGD, umístěný na vrcholu smyčky spojující řetězce F A G β, zprostředkovává adhezi. Rovnání RGD-smyčky do více lineární kolísavé konformaci v rozvíjející se snižuje dostupnost smyčka na povrchu vázány integrins, a proto snižuje afinitu a selektivitu vazby.
Interakce Protein-Sacharid.
selektiny jsou důležité při interakci lymfocytů a neutrofilů s vaskulárním endotelem. Selektiny jsou adhezní molekuly, které se vážou na sacharidy. Dosud neexistují žádné přímé strukturální údaje o vazbě selektinů na sacharidy. Selektiny vážou sacharidy s nízkou afinitou a mají velmi rychlé zapínání a vypínání.