 |
|
Většina reakcí ve vodném prostředí zahrnují ionty. Když však dojde k reakci, obvykle se objeví dva druhy iontů: (1) ionty „diváka“ a (2) ionty „hráče“. Názvy znamenají charakter iontů s ohledem na reakci. Ionty hráčů jsou přímo v reakci, zatímco divácké ionty plní roli diváků a jejich primární funkcí je udržování elektrické neutrality v roztoku. Zvažte srážecí reakci, ke které dochází při smíchání vodných roztoků chloridu sodného a dusičnanu stříbrného. Vytvoří se bílá sraženina AgCl. Chemická rovnice pro tuto reakci je zapsána jako:
tato rovnice obsahuje všechny ionty v roztoku. Někdy je však nutné zahrnout pouze ty ionty, které jsou hráči, a vynechat diváky. Chemická rovnice, která obsahuje pouze ionty hráče, se nazývá čistá iontová rovnice (nie). Získat nie (1) vypsat všechny rozpustné sloučeniny jako ionty a (2) eliminovat ionty společné pro oba reaktanty a produkty. Výsledná chemická rovnice je pak nie. Pro výše uvedené rovnice máme: (pro krok 2 najeďte myší na reakce)
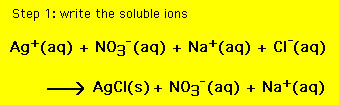
výsledná rovnice je čisté iontové rovnice,
Zatímco výše uvedené reakce je obzvláště jednoduché (tj. všechny stechiometrické koeficienty jsou rovny 1), složitější nie je výsledek z podobných řízení. Pokud je například dusičnan železitý(III) smíchán se sulfidem amonným, výsledkem je žlutá sraženina sulfidu železa (III). Nie pro tuto reakci je: