Úvod
tkáně, buňky a menší struktury uvnitř buněk (organel) jsou většinou vody a jsou proto průhledné. Zobrazovací malé průhledné tašky z vody snímky, které neobsahují mnoho informací, a v mikroskopii, je důležité, abychom měli nějaký kontrast, nebo skvrny, které se bude dát oblastech vzorku barvy a učinit je mnohem jednodušší vidět. Kromě toho, co když chcete zobrazit pouze některé z menších struktur uvnitř buňky, jako je jádro nebo buněčná membrána? Zbarvení celé buňky by znemožnilo lokalizovat oblasti, které Vás zajímají.
Fluorescence řeší oba tyto problémy kontrastu a lokalizace. Fluorescence je místo, kde objekt vyzařuje světlo po absorpci světla. Mnoho různých objektů, které vykazují fluorescenci, jako jsou minerály (slovo fluorescence pocházející z minerálu fluorit), hlubinných ryb (nejvíce skvěle medúzy Aequorea victoria, ze které zelený fluorescenční protein (GFP) byla objevena před), rostliny, chemikálie a mnoho dalších.
fluorescenční molekuly (známé jako fluorofory) se používají k označení vzorků a fluorofory jsou k dispozici, které emitují světlo prakticky v jakékoli barvě. Ve fluorescenčním mikroskopu je vzorek označen fluoroforem a poté se k osvětlení vzorku použije jasné světlo (excitační světlo), které vydává fluorescenci (emisní světlo). Tímto způsobem jsou vzorky vysoce kontrastovány s černým pozadím, protože fluorofor vydává jasně zbarvené světlo. Tím, lokalizaci těchto fluorophores do oblasti zájmu jasný obraz jakékoliv části buňky mohou být přijata, aby fluorescenční mikroskopie výkonný nástroj pro vědy o životě.
Brightfield vs fluorescenční zobrazování
v mikroskopii brightfield je vzorek osvětlen přenášeným bílým světlem. To vytváří rovnoměrné osvětlení vzorku pod mikroskopem pro pozorování vysoce kontrastních, obarvených nebo přirozeně pigmentovaných vzorků. Nicméně, brightfield není dostačující rozlišovat mezi průhledné/průsvitné, neobarvené buňky nebo buněčných struktur studovat procesy zájmu.
fluorescenční mikroskopie se spoléhá na použití fluoroforů, molekul, které emitují světlo specifické viditelné vlnové délky, když jsou vystaveny světlu jiné vlnové délky. Když jsou tyto fluorofory vázány na cílenou strukturu zájmu, mohou být fotony emitované z fluoroforu použity k vizualizaci této struktury zájmu. Výhody fluorescenční mikroskopie je, že cílové struktury jsou osvětleny, zatímco nežádoucí oblasti vzorku mají málo k žádné fluorescence, což umožňuje snadné cílení a zobrazování.
proč molekuly fluoreskují
původem fluorescence jsou elektrony, které se volně pohybují kolem aktivního fluoroforu a uvolňují absorbovanou energii, jak je vidět na obr.2.
před excitací jsou elektrony v nejnižším energetickém stavu, který mají k dispozici – v základním stavu (S0). Když je elektron zasažen fotonem určitého energetického rozsahu, elektron absorbuje energii fotonu a vyskočí do vyššího energetického stavu (S1, S2 nebo S3). Pro návrat do základního stavu (S0) elektron uvolňuje dodatečnou energii jako emise fotonu. Energie tohoto fotonu je menší než excitační energie, takže má delší vlnovou délku. To je důvod, proč emisní světlo má delší vlnovou délku než budicí světlo a může se objevit jako jiná barva.
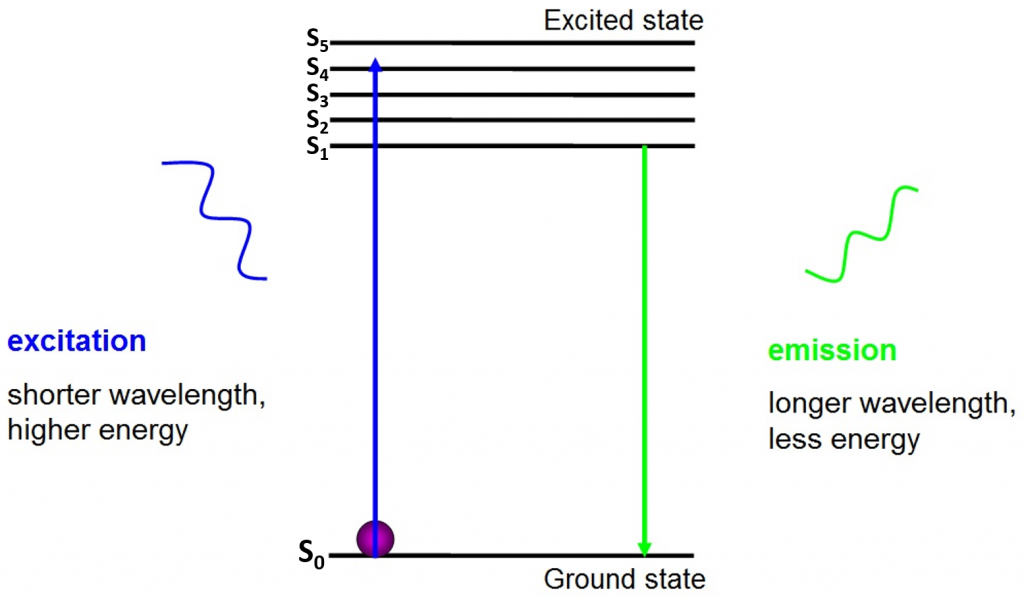
emitovaný foton je obvykle ve viditelném spektru a může být viděn pod mikroskopem, pokud je dostatek excitovaných fluoroforů. Vlnová délka uvolněného fotonu je specifická pro každý fluorofor a tato předvídatelnost umožňuje snadné fluorescenční zobrazování.
Fluorescenční Intenzity Faktorů,
Zatímco fluorophores mohou emitovat fluorescenci předvídatelný vlnová délka, to je také důležité vědět, jaké faktory ovládání fluorescenční intenzita. Bez dostatečně intenzivní emise světla nebude fluorescence detekovatelná mikroskopem.
Kvantový Výtěžek
kvantový výtěžek (ϕ) fluorophore je poměr počtu uvolněných fotonů k počtu absorbovaných fotonů. Kvantový výtěžek je často vyjádřen jako hodnota od 0-1, což 1 je 100% účinnost konverze fotonů. Je také důležité si uvědomit, že každý fluorofor má jedinečné pH, iontovou sílu a teplotu pro optimální fluorescenční účinnost.
Extinkční Koeficient
Každý fluorophore má jinou schopnost absorbovat fotony, i když jsou ve vhodném rozsahu vlnových délek rozrušit. Pokud fluorophore je vystaven photon přiměřeně odpovídající jeho excitační vlnové délce, je pravděpodobnost, že foton bude absorbován je měřitelná vlastnost a je známý jako extinkční koeficient (ε).
kvantový výtěžek fluoroforu a koeficient extinkce jsou často zobrazeny společně, aby popsaly, jak jasný je fluorofor v experimentálním prostředí.
životnost Fluorescence
když fluoroforový elektron absorbuje foton, okamžitě neuvolní foton s delší vlnovou délkou. Je známo, že uvolňování určité energie mezi excitovanými energetickými stavy trvá různě dlouho. Doba, kterou elektron stráví ve vzrušeném stavu před uvolněním fotonu a návratem do základního stavu, je měřením jeho fluorescenční životnosti. Životnost každého fluoroforu je jedinečná a může být měřena experimentálně. Při použití fluorescenční barviva experimentálně, je užitečné, aby jejich život, zejména pro aplikace, které vyžadují vysokou rychlost, jako je vápník zobrazovacích neuronů.
intenzita excitační vlnové délky
většina nastavení fluorescenční mikroskopie zahrnuje zdroj světla, který lze vyladit na výstup požadovaného rozsahu vlnových délek. Mnoho fluorescenčních světelných zdrojů lze také nastavit pro intenzitu buzení, aby se zvýšil počet fotonů pohybujících se světelnou dráhou. Ve fluorescenčně značeném vzorku, který je vystaven své excitační vlnové délce, nebude každý fluorofor aktivován současně. Zvýšení excitační intenzity a zvýšení počtu fotonů dosahuje vzorek, tam je vyšší pravděpodobnost, že více fluorophores bude nadšený.
Fotostabilita
Fotostabilita je schopnost molekuly nebo organismu odolávat poškození. Ve fluorescenční mikroskopii fluorofory nakonec přestanou absorbovat přicházející fotony a přejdou do trvalého tmavého stavu. Jak organismus shromažďuje více fluoroforů v tmavém stavu, vzhled značeného cíle se snižuje a vzorek se říká, že je fotobleaching. Ve fluorescenční mikroskopii se často podnikají kroky ke snížení množství fotobleachingu během experimentování. Některá opatření zahrnují snížení intenzity světla interakci se vzorkem a použití speciálních fluorescenčních barviv, které nemají zůstat aktivní tak dlouho, jako ostatní barviva.
Fluorescenční Mikroskopie
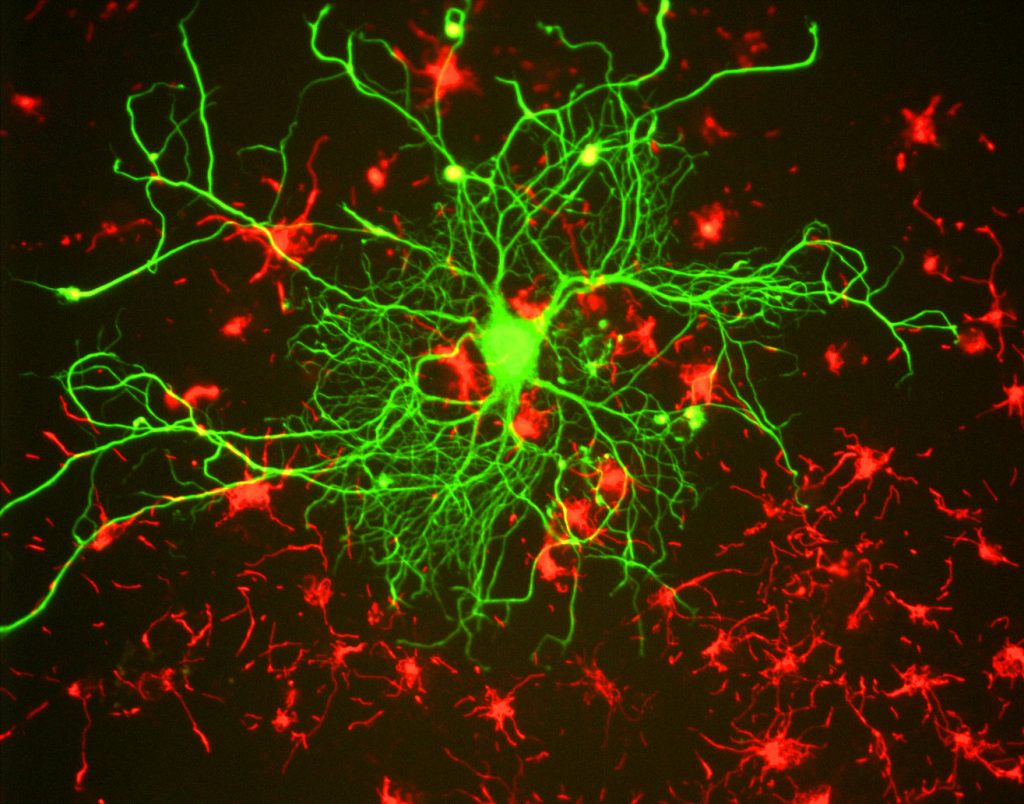
Pro výzkumné pracovníky, hlavním přínosem fluorescence je schopnost používat fluorescenční mikroskopie, kde vzorky jsou označeny/obarví fluorescenční látky, jako jsou barviva, protilátky nebo proteiny, což umožňuje obrazy mají kontrast. Zaměřením na tyto fluorescenční štítky mohou vědci vybrat, co chtějí vidět. To je demonstrováno na obr.3, kde neuron může být jasně vidět mezi astrocyty, protože jsou označeny různými barvami fluorescenčního markeru.
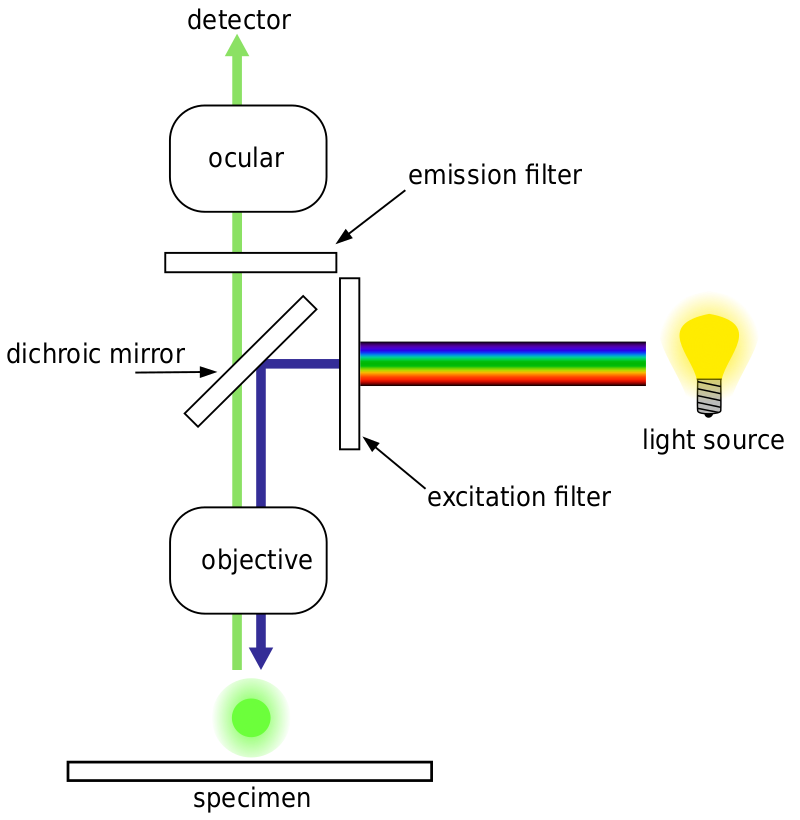
obecně platí, že pro fluorescenční mikroskopii je vzorek označen fluorescenčními markery (typicky specifickými pro určité části vzorku). Vzorek je pak osvětlen specifickou excitační vlnovou délkou pro fluorofor a výsledná emisní fluorescence je přijímána detektorem, obvykle citlivou vědeckou kamerou.
většina fluorescenčních mikroskopů jsou epifluorescenční mikroskopy, kde se excitace a emise provádějí stejnou světelnou cestou. Oba buzení osvětlení a emitované fluorescence projít mikroskopem cíle a jsou obvykle filtrovány, aby se jen tak detekci fluorescence. Toto nastavení je znázorněno na obr.4.
Autofluorescence
Některé struktury, biologických organismů, a obecné mikroskopie vzorky mohou přirozeně vykazují fluorescenci, známý jako autofluorescence. Toto je odlišné od fluorescence z označených vzorků, ale často sdílí podobné vlnové délky, což znamená, že mikroskopie autofluorescence vzorků může zatemnit uměle přidány fluorescenční a narušuje detekce, snížení signálu. Je důležité vědět, zda vaše vzorky vykazují autofluorescenci, protože to ovlivní jakékoli fluorescenční zobrazování, pokud nejsou použity specifické vlnové délky, aby se tomu zabránilo.
běžnými příklady autofluorescentních objektů jsou mitochondrie, lysosomy, kolagen a některé aminokyseliny, jako je tryptofan, tyrosin a fenylalanin. Nejvíce pozoruhodně, autofluorescence je běžná v rostlinách kvůli jejich použití chlorofylu a dalších fluorescenčních molekul, jako jsou ligniny a karoteny. Obr.5 ukazuje různé barvy autofluorescence z neoznačeného vzorku skotské borovice.
Shrnutí
Od zavedení první fluorescenční barvivo, fluorescenční mikroskopie byla aheavily využit nástroj pro vizualizaci buněk a buněčných struktur s higherspecificity než tradiční brightfield mikroskopie. Vědci mohoumanipulovat strukturu, optické vlastnosti, a sonda zájmu influorescenční experimenty získat relevantní data. Tato flexibilita umožňovalafluorescenční mikroskopie, které mají být zahrnuty vmnoho experimentů vědy o životě.
v závislosti na typu vzorku a fluoroforu by měla být vědecká kamera pečlivě vybrána, aby bylo dosaženo nejlepších zobrazovacích výsledků.
- Světelná Mikroskopie. (2009) Přírodní Milníky. MacMillan Publishers Limited, 6-22.
- Lavis, L. D., & Raines, R. T. (2008). Jasné nápady pro chemickou biologii. ACS Chemical Biology, 3 (3): 142-155.
- Liu, y., Lilly, D. (2017) krystalové struktury, pokud se Kyaninové Fluorofory hromadí na konci dvouvláknové RNA. Biofyzikální Časopis, 113, (11): 2236-2343.
- Berezin, M. Y., Achilefu, S. (2010). Měření životnosti Fluorescence a biologické zobrazování. Chemické Recenze, 110 (5): 2641-2684.
- Stockert, J., Blazquez-Castro, a. (2017) fluorescenční mikroskopie v biologických vědách. Sharjah, Spojené arabské emiráty. Bentham Science Publishers.
- Berezin, M. Y, & Achilefu, S. (2010). Měření životnosti Fluorescence a biologické zobrazování. Chemické Recenze, 110 (5): 2641-2684.
- Denk, W., Strickler, J., Webb, W. (1990). Dvoufotonová Laserová Skenovací Fluorescenční Mikroskopie. Věda. 248, (1951): 73-76.
- So, P. (2002). Dvoufotonová fluorescenční světelná mikroskopie. Macmillan Publishing Group.
- Schermelleh, L., Heinztmann, R., and Leonardt, h. (2010). Průvodce fluorescenční mikroskopií se Super rozlišením. Journal of Cell Biology 190 (2): 165-175.
- Betzig, E., Patterson, G. H., Sougrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., Davidson, M. W., LippincottSchwartz, J., Hess, H. F. (2006) Zobrazovací intracelulární fluorescenční proteiny v nanometrové rozlišení. Věda. 313(5793): 1642-5
- Rust, M. J., Bates, M. & Zhuang, X. (2006) sub-difrakční-limitní zobrazování stochastickou optickou rekonstrukční mikroskopií (STORM). Nat Metody. 2, (10):793-5.
- Rego, e., Shao, L., Macklin, J. Winoto, L., Johansson, G., Kamps-Hughes, N., Davidson, M., and Gustasson, m. (2010) PNAS. 109 (3): e135-a143.
- Jungmann, R., Avendaño, M. S., Woehrstein, J. B., Dai, M., Shih, W. M. & Yin, P. (2014) Multiplexní 3D mobilní super-resolution imaging s DNA-MALOVÁNÍ a Výměna-PAINT. Nat Metody. 11(3): 313-318
- Jiang, X., Wang, L. Carroll, S., Chen, J., Wang, M., a Wang, J. (2018) Challenges and Opportunities for Small Molecule Fluorescent Probes in Redox Biology Applications. Antioxidants & Redox Signaling. Mary Ann Liebert, Inc.