přidání sacharidové části k molekule proteinu se označuje jako glykosylace proteinů. Jedná se o běžnou posttranslační modifikaci proteinových molekul podílejících se na tvorbě buněčné membrány. Během tohoto procesu,propojení monosacharidových jednotek do řetězce aminokyselin nastaví jeviště pro sérii enzymatických reakcí, které vedou k tvorbě glykoproteinů (n a o propojené oligosacharidy, které se nacházejí na bílkovinu subjekt). Ve všech 16 známých enzymech se předpokládá, že tuto reakci zprostředkují. Typické glykoprotein má nejméně 41 dluhopisů, které zahrnují 8 aminokyselin a 13 různých monosacharidových jednotek a zahrnuje glycophosphatidylinositol (GPI) a phosphoglycosyl vazeb. Proteinová glykosylace pomáhá při správném skládání proteinů, stabilitě a adhezi buněk k buňkám, které buňky imunitního systému běžně potřebují. Hlavními místy glykosylace bílkovin v těle jsou ER, Golgiho tělo, jádro a buněčná tekutina.
glykosylace proteinů lze rozdělit do dvou hlavních typů:
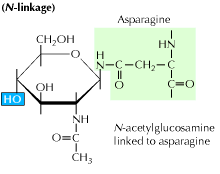 a) n-vázaná glykosylace: začíná přidáním prekurzoru 14-cukru k asparaginové aminokyselině. Obsahuje molekuly glukózy, manózy a n-acetylglukosaminu. Tato entita se pak přenese do lumenu ER. Na oligosaccharyl transferázy, enzymu přikládá oligosacharid řetězce asparagin, který se vyskytuje v tripeptid sekvenci Asn-X-Ser nebo Asn-X-Thr. X může být jakákoli aminokyselina Jiná než prolin. Je připojen oligosacharid proteinové sekvence teď poskládá správně a je nyní přemístěný do Golgiho komplexu, kde mannosové zbytky se odstraní.
a) n-vázaná glykosylace: začíná přidáním prekurzoru 14-cukru k asparaginové aminokyselině. Obsahuje molekuly glukózy, manózy a n-acetylglukosaminu. Tato entita se pak přenese do lumenu ER. Na oligosaccharyl transferázy, enzymu přikládá oligosacharid řetězce asparagin, který se vyskytuje v tripeptid sekvenci Asn-X-Ser nebo Asn-X-Thr. X může být jakákoli aminokyselina Jiná než prolin. Je připojen oligosacharid proteinové sekvence teď poskládá správně a je nyní přemístěný do Golgiho komplexu, kde mannosové zbytky se odstraní.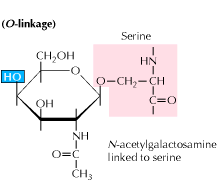
b) O-vazebných glykosylačních: Glykosylace začíná enzym zprostředkoval přidání N-acetyl-galactosamine následuje dalších sacharidů na serin nebo threonin reziduí. Studie ukazují, že glykosylace spojená s O se vyskytuje v pozdějším stádiu zpracování bílkovin.