Úvod
enzymatické působení fosfodiesterázy typu 5 (PDE5) je hlavní mechanismus inaktivace cGMP, následný prostředníka vazodilatační činidlo oxid dusnatý (NO) (Lugnier, 2006).
V průběhu erektilní dysfunkce (ED), poruchou produkce no z endotelu kavernózních cév může být farmakologicky překonat pomocí PDE5 inhibitory (PDE5i), za účelem prodloužení cGMP half-life a pro zvýšení zbytkové vasodilatační funkci (Hawksworth a Burnett, 2015). Několik molekul s inhibiční aktivitou na PDE5 bylo poté promítnuto a uvolněno na trh, vykazující odlišný nástup a trvání účinku. V současné době jsou PDE5i léky první volby používané k léčbě ED (Mehrotra et al ., 2007).
navzdory uznávané účinnosti u téměř 80% nevybraných pacientů s ED (Eardley et al ., 2010; Hatzimouratidis et al., 2010; Porst a kol., 2013) bylo nedávno hlášeno pozoruhodné vypadnutí z léčby PDE5i. Z kvantitativního hlediska byla hlášena průměrná míra přerušení léčby 4% za měsíc, s celkovým opuštěním terapie v 50% případů ročně (Carvalheira et al., 2012; Corona a kol., 2016). Mezi hlavní důvody, které pacienti zdůvodňují opuštění léčby, patří nedostatečná účinnost a vedlejší účinky (Corona et al ., 2016). Tam mohou být rozlišeny dva druhy nežádoucí účinky: ty, které se vztahují výhradně k PDE5 inhibice, jako je bolest hlavy, návaly, dyspepsie, a ty, spojené se zbytkovou inhibiční účinek drog na jiných PDE, jako je vazodilatace, tachykardie (PDE1), poruchy zraku (PDE6) a bolesti zad (PDE11) (Bischoff, 2004; Gupta et al., 2005). Od vzniku nežádoucích účinků se zvyšuje s oběma sérové koncentrace a době expozice léku (Gupta et al., 2005; Taylor a kol., 2009), profil bezpečnosti / účinnosti léčiva může být alternativně zlepšen farmakokinetickým přístupem návrhem nové lékové formulace (Mehrotra et al ., 2007). Tento přístup byl úspěšně aplikován na PDE5i v případě vardenafilu. Tato molekula skutečně trpí relativně nízkou biologickou dostupností (∼15%, Centrum pro hodnocení a výzkum léčiv, 2003). Ve srovnání s potahovaných tablet (FCT), původní formulace pro klasické per os podání, formulace oro-dispergovatelných tablet (ODT) na Vardenafil výrazně zvýšila biologická dostupnost léků tím, že zvýhodňují sublingvální absorpci, trasy uznal být méně ovlivněny first-pass metabolismu (Heinig et al., 2011).
Sildenafil (Sild)byl prvním selektivním inhibitorem PDE5 schváleným pro léčbu ED (Boolell et al., 1996). To je relativně lipofilní molekula a, po perorálním podání, maximální plazmatické koncentrace je dosaženo v časovém rozmezí od 0,5 do 2 h. Sild zobrazuje relativně nízké perorální biologické dostupnosti (38-41%), a to především díky rozsáhlé střeva a first-pass metabolismu (Gupta et al., 2005). Navzdory dlouhé přítomnosti na trhu, vývoj nových formulací léčiva špatně sleduje, až do nedávného vydání na italském trhu nové formulace: oro-dispergovatelný film (ODF). Ve skutečnosti byl ODF schválen jako bioekvivalentní forma FCT (Leoni et al ., 2013). Perorálně dezintegrační formulace však mohou představovat vhodné systémy, které upřednostňují trans-slizniční a zejména sub-lingvální absorpci (Kathpalia a Gupte, 2013).
V této studii jsme hodnotili Sild farmakokinetika spojené sublingvální podání buď ODF nebo ODT, ve srovnání s FCT jako originální per os formulace. Za tímto účelem jsme zkoumali profil uvolňování/permeace různých formulací Sild in vitro systémy speciálně vyvinuté pro vyhodnocení trans-mukózní absorpce léčiv. Dále jsme kvantifikovány v séru profily Sild farmakokinetika po podání per os FCT, a sublingvální ODT a ODF u pacientů s ED.
Materiály a Metody
Chemických látek a lékových forem
Hank rovnováhu soli roztok pH 7.4 (HBSS), HEPES řešení, benzanilide, a Sild citrát byly zakoupeny od Sigma–Aldrich (Milán, Itálie). Aby se předešlo nejasným výsledkům vyplývajícím z použití alternativních bioekvivalentních produktů dostupných na trhu, byly použity následující produkty: Viagra® FCT (Pfizer, Milán, Itálie), Viagra ORO® ODT (Pfizer) a Rabestrom® ODF (IBSA, Lodi, Itálie). Léky byly předepisovány pacientům během ambulantního hodnocení pro jejich soukromé použití. Pro testy in vitro a hodnocení farmakokinetiky in vivo (viz níže) byly léky specificky zakoupeny pracovníky zapojenými do studie v místních lékárnách a poté s nimi bylo zacházeno/skladováno v optimálních podmínkách.
Členění Test
in vitro členění testy byly provedeny podle Evropského Lékopisu (2016) pomocí Tabletu Rozpadu Tester (Sotax DT 2, Doplňkový Obrázek S1A), za použití vody jako imerzní kapaliny při teplotě 37 ± 0,5°C. doba členění kontroly na kompletní rozpad lékové formy. Kompletní rozpad je definována jako stav, v němž žádné zbytky jednotky, které zůstávají na displeji zkušebního přístroje, nebo lpění na spodní povrch kotouče je měkké hmoty s č. citelně pevné jádro. Testy byly provedeny ve trojím vyhotovení a výsledky byly hlášeny jako střední hodnota ± směrodatná odchylka.
test rozpouštění
in vitro testy rozpouštění léčiv byly provedeny podle Evropského lékopisu . Disoluční testy byly provedeny pomocí pádlo přístroje, pádlo, rychlost 50 ot / min, a HBSS, pH 7.4 byl použit jako disoluční médium objem (900 ml, při teplotě 37 ± 0,5°C).
Při vydání testů, 2 ml disoluční médium vzorek, na 0, 2, 4, 6, 10, 20, 30, a 40 min, byl odebrán a přefiltrován přes 0,45 µm estery celulózy filtr a proto ředit. Následně byla kvantifikace Sild provedena vysoce výkonnou kapalinovou chromatografií (HPLC)-UV. Odstraněný objem byl pokaždé nahrazen čerstvým médiem. Testy byly provedeny ve trojím vyhotovení a výsledky byly hlášeny jako střední hodnota ± směrodatná odchylka. Byly normalizovány údaje o obsahu léčiva ve formulaci.
Trans – mukózní permeační Test
Trans-mukózní permeační profil Sild byl hodnocen in vitro pomocí specifického zařízení podle Delvadia et al. (2012) vhodně upraveno. Stručně řečeno, zařízení sestávalo z vertikálního difúzního systému představovaného komorami dárce-přijímače oddělenými jednorázovou membránou acetátu celulózy (pórů 0,45 µm). Dárcovská buňka obsahovala 1,5 ml HBSS, zatímco přijímací komora byla součástí uzavřeného recirkulačního okruhu o objemu 30 ml včetně objemů hadičky a zásobníku. Odběr vzorků byl proveden z přijímače komory nádrže v časových intervalech 0, 5, 10, 20, 30, a 40 min a nahrazena ekvivalentní objem čerstvé HBSS. Vzorky byly analyzovány pomocí HPLC-UV na obsah léčiva (Fejős et al., 2014). Byly normalizovány údaje o nejvyšší permeované koncentraci Sild pozorované pro čistý citrát Sild. Testy byly provedeny ve trojím vyhotovení a výsledky byly hlášeny jako střední hodnota ± směrodatná odchylka.
Farmakokinetické Studie na Dobrovolnické Psychogenní ED u Pacientů
studie byla provedena v Jednotce, Andrologie a Reprodukční Medicíny (fakultní Nemocnice v Padova, Itálie), od Května do září 2017, podle Helsinské Deklarace v rámci schválení Etické komise Padova University Hospital (protokol č. 3982/AO/16 a následných změn). Aby se předešlo zkreslení výsledků, pacienty s psychogenní ED byli zařazeni, protože nižší výskyt organických poruch, spolupracovník EDA (Ludwig a Phillips, 2014).
velikost vzorku byla vypočtena za účelem dosažení velikosti účinku alespoň 0,5 se statistickou silou 0,8 a úrovní významnosti 0,05 pro srovnání tří skupin (viz power calculator-jednosměrná nezávislá ANOVA).
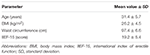
dvacet pacientů (průměrný věk 31,4 ± 5,7 let) bylo postupně zařazeno vydáním podepsaného informovaného souhlasu. Pacienti se zúčastnili ambulantní hodnocení vykazování konzistentní neschopnost dosáhnout a udržet erekci pro uspokojivý sexuální styk během předchozích 6 měsíců nebo více. Následné klinické hodnocení bylo provedeno u všech pacientů s cílem ověřit nepřítomnost nemoci související s ED, jako je diabetes mellitus, hypertenze, neurologické poruchy, a na užívání antidepresiv. Diagnóza psychogenní ED bylo potvrzeno plnění index skóre <26 v podání Mezinárodní Index Erektilní Funkce-15 (IIEF-15) dotazník (Lotti et al., 2016) a zachování spontánní noční erekce, hodnotí Noční Penisu Otok a Tuhost Sledování přes RigiScan Plus Tuhost Systému Hodnocení (Dacomed, Spojené Státy) pro dvě po sobě jdoucí noci, jak bylo dříve popsáno (Munoz et al., 1993; Caretta et al., 2005). Kritéria pro vyloučení byly diagnózu malignity, abnormální hormonální hladiny v plazmě (v uvedeném pořadí, luteinizačního hormonu >8 UI/l, celkového testosteronu <10.4 nmol/l, thyrotropin >4.5 mUI/l, prolaktin, >20 ng/ml) a zvýšené intima-media thickness na supra-aortální kmeny (>0.9 mm) a / nebo kavernózní tepny (>0,3 mm), hodnocené barevným dopplerovským ultrazvukem, jak bylo popsáno výše (Caretta et al., 2005, 2009).
pacienti souhlasili s dodržováním jednorázové trojcestné zkřížené otevřené studie. Schéma dávkování léku je uvedeno na obrázku 1. Dávka přípravku Sild byla zvolena jako 50 mg v souladu s předchozími zprávami o léčbě psychogenního ED (Banner a Anderson, 2007). Pacienti byli požádáni, aby neužívali žádné léky ani alkohol po dobu 1 týdne před a v průběhu studie. Kromě toho byli pacienti během dne dávkování léku požádáni, aby měli alespoň 2 hodiny před testem snídani bez tuku (bez mléka nebo jiného tučného jídla). FCT, považovaný za referenční formulaci, byl klasicky podáván per os spolknutím perorální tablety se sklenicí vody. U ODT a ODF byli pacienti instruováni, aby drželi formulaci pod jazykem po dobu 15 minut bez převzetí vody, následované polykáním. Žilní krevní vzorky byly odebrány ve standardních zkumavek (Vacutainer, BD Biosciences, Milán, Itálie) v 0, 5, 10, 15, 30, 60, 90, 120, a 240 minut po podání léku. Byla provedena kompenzace kontinuální infuzí sterilního fyziologického roztoku. Po podání dávky byly subjekty ubytovány až do dokončení odběru vzorků krve. Další odběr krve byl proveden po 24 hodinách od podání z kontrolních důvodů, aby se zjistila úplná clearance léčiva. Jako vymývací období bylo mezi jednou dávkou a následujícím dávkováním povoleno 7 dní. Po odběru krve byla plazma okamžitě izolována a uchovávána při -80°C až do použití.
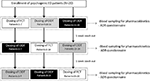
OBRÁZEK 1. Dávkovací schéma a hodnocení pro hodnocení farmakokinetických parametrů u 20 pacientů s psychogenní erektilní dysfunkce (ED), rozděleny do tří skupin (respektive Pacientů 1-7; Pacienti 8-14; a Pacientů 15-20). Každá skupina pacientů, případně přijaté per os potahovaných tablet (FCT), sublingvální oro-dispergovatelných tablet (ODT), nebo sublingvální oro-dispergovatelných film (ODF) s alespoň 1 týden wash-out z každého podání. Všechny formulace obsahovaly 50 mg sildenafilu (Sild).
Během bydlení, pacienti byli také požádal zaznamenat nežádoucí účinky (ADR) ve speciálně koncipovaný formulář, převzato z ADR formulář pro Agenzia Italiana del Farmaco (AIFA1). Přeložená verze dotazníku je k dispozici jako doplňkový materiál (viz Doplňkový list S1). Pacienti byli požádáni, aby specifikovali typ nežádoucího účinku/s, celkovou intenzitu (v škále subjektivního hodnocení od 1, velmi slabé, do 5, velmi intenzivní), čas nástupu a celkové trvání.
Kvantifikace Sildenafilu v Lidském Séru
Pro kvantitativní stanovení sérové hladiny Sild, 400 µl vzorku séra bylo přidáno 500 µl methanolu doplněných vnitřního standardu (IS) benzanilide (5 µg/ml). Následně bylo do směsi přidáno 5 ml ethylacetátu, vzorky byly vortexovány pro provedení extrakce kapalina-kapalina, obě fáze byly odděleny centrifugací. Organická část se pak odpaří za vakuové odstředivky při 40°C. Získaný zbytek byl znovu rozpuštěn 200 µl methanolu a nakonec použit pro vysoce výkonnou kapalinovou chromatografii-tandemovou hmotnostní spektrometrii (HPLC-MS/MS) analýzu.
vysokoúčinná kapalinová chromatografie-MS/MS analýzy používá systém Agilent-Varian 1260 a třílůžkový-čtyřlůžkový detektor Agilent-Varian 320 PANÍ Chromatografická separace byla provedena na koloně Phenomenex C-18 Evo 3 × 100 a mobilní fáze složené z acetonitrilu s 0,1% mravenčí kyselina ve vodě s gradientem v podrobné Doplňující Obrázek S2A. Pozitivní detekce-režim byla použita pro přechod 198 > 105 Da JE, získané s kapilární napětí 40 V a kolizní energie 16 V, zatímco 475 > 100 Da na Sild s kapilární napětí 40 V a kolizní energie 22,5 V, resp. Reprezentativní chromatogramy IS a Sild v reálných vzorcích jsou uvedeny na doplňkovém obrázku S2B.
Statistické Analýzy
Farmakokinetické parametry (PK), jako jsou maximální sérové koncentrace (Cmax), čas do dosažení maximální koncentrace v séru (tmax) a plochy pod křivkou (AUC) v různých časových bodů, byly vypočteny s konkrétní postupy aplikací s GraphPad software (san Diego, CA, Spojené Státy). Statistická analýza dat byla provedena pomocí SPSS 21.0 pro Windows (SPSS, Chicago, IL, Spojené státy americké). Kolmogorov-Smirnovův test byl použit ke kontrole normálnosti distribuce. Proměnné, které nevykazují normální rozdělení, byly transformovány do protokolu. Základní charakteristiky pacientů, PKs, a údaje z in vitro experimentů byly porovnány s nepárový studentův t-testů s Bonferroniho–Holmovou korekcí pro vícenásobné porovnání. Opakovaná opatření ANOVA byla provedena za účelem testování rozdílů v uvolňování léčiva a koncentraci Sild v séru. Leveneův test byl použit k testování homogenity rozptylu mezi skupinami. Pokud byla porušena homogenita předpokladu rozptylu, byl proveden Welchův test a byla hlášena příslušná hodnota P. Podíl ADR byl porovnán s přesným testem χ2. P-hodnoty < 0.05 byly považovány za statisticky významné.
Výsledky
In Vitro Analýza Vydání/Permeační Sildenafilu z Různých lékových forem
dynamické uvolnění a pronikání Sild ze tří lékových forem byla dříve zkoumána in vitro (Obrázek 2). Doba do dokončení disagregace pro FCT, ODT a ODF byla hodnocena standardním testem popsaným v Evropském lékopisu (2016; Obrázek 2A). ODF vykazoval nejvyšší čas do členění ve srovnání s FCT a ODT (p = 0, 017 a P = 0, 008).
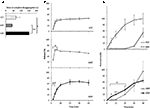
OBRÁZEK 2. In vitro hodnocení bio-technologických vlastností FCT, ODT, andODFs obsahujících 50 mg Sild. Výsledky jsou reprezentativní pro tři nezávislé experimenty a jsou uváděny jako průměrné hodnoty ± směrodatná odchylka. (A) výsledky testu členění, vykazující čas (v sekundách) do úplného členění formulace. Význam: ∗P < 0,05 a ∗∗P < 0,01 mezi uvedenými formulacemi. (B) výsledky testu rozpouštění, udávající množství Sild uvolněného každou formulací jako procento dávky léčiva. Význam: aP < 0.01 vs. FCT; bP < 0.001 vs. ODT. (C) Výsledky permeační test (podrobně v sekci „Materiál a Metody“) vykazování množství Sild prostupuje přes acetát celulózy membrány, jako procento nejvyšší hodnoty dosaženo 50 mg čistého Sild prášek (nespojité linie v horním panelu). Význam: ∗P < 0,05 vs. ODT; ∗∗P < 0,01 vs. ODT; aP < 0,01 vs. FCT.
za účelem vyhodnocení vlivu těchto důkazů na uvolňování léčiva z formulace byl proveden standardní test rozpouštění (Evropský lékopis, 2016; Obrázek 2B). Ve srovnání s referenční formulace FCT, ODT, vykazovaly rychlejší uvolňování léčiva, jejichž maximální míře bylo dosaženo i po pouze 2 min od začátku testu (P = 0.006 vs. FCT). Na druhé straně bylo procento léčiva uvolněného z ODF během prvních 4 minut testu nižší ve srovnání s FCT i ODT (p = 0, 004 a P < 0, 001). Zejména ODF vykazoval progresivnější uvolňování léčiva ve srovnání s FCT a dosáhl maximálního rozsahu po 20 minutách od začátku testu.
Na tomto základě, trans-slizniční pronikání Sild z každé formulace byla hodnocena pomocí speciálně vyvinuté zařízení (Obrázek 2C). Pro referenční účely, čistý Sild citrát, který se používá v hmotnostní ekvivalent 50 mg Sild, byl posuzuje pro trans-slizniční propustnost a ukázal, zdarma a rychlé šíření mezi oběma komorami. U FCT byl pozorován téměř opačný profil, který vykazoval zanedbatelnou prostupnost až do 30 minut od začátku testu. Permeační profily ODT a ODF vykazovaly přechodné chování ve srovnání s předchozími dvěma podmínkami. Během prvních 20 min testu, ODF, prokázali výrazně vyšší rozsah propustnosti ve srovnání s ODT (respektive, P = 0.033 na 5 min, P = 0.003 na 10 min, P = 0,041 na 20 min). Jinak od FCT a ODT, že zcela rozložené v dárce komory, reziduální měkké želé hmotnost ODF trval na acetát celulózy membrány i na konci testu (Doplňující Obrázek S2C).
Diferenciální Farmakokinetiku Sildenafilu
Dvacet mužských pacientů postižených psychogenní DE přijal přijímat alternativně FCT, ODT, nebo ODF, oddělené týden umýt. Jak je podrobně uvedeno v oddíle „Materiál a Metody“ FCT byl klasicky polykají, aby umožnila klasické per os podání při ODT a ODF byly udržovány pod jazyk 15 min podporovat sublingvální podání. Klinické charakteristiky pacientů jsou uvedeny v tabulce 1. Sérové hladiny Sild odpovídající třem dávkovacím podmínkám jsou uvedeny na obrázku 3. Značná variabilita představovala sérový profil léčiva těchto tří formulací. Ve srovnání s FCT vykazovala ODT zjevné časné zvýšení sérových hladin Sild; tento trend však nebyl statisticky významný. Na druhou stranu, rychlejší rozpad Sild hladiny na 120 a 240 min od podání dávky bylo pozorováno pro ODT formulace (v tomto pořadí, P = 0.044 a P = 0.024 vs. FCT).
TABULKA 1. Klinické charakteristiky účastníků studie (N = 20).
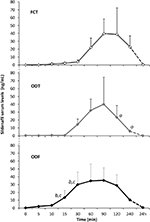
OBRÁZEK 3. In vivo hodnocení sérové hladiny Sild, u 20 pacientů postižených psychogenní ED, přijímání alternativně buď FCT per os, nebo sublingvální ODT, nebo sublingvální ODF, jak je uvedeno v sekci „Materiály a Metody.“Data jsou uváděna jako střední hodnoty ± směrodatná odchylka význam: aP < 0,05 vs. FCT; bP < 0,01 vs. FCT; cP < 0,05 vs. ODT.
léku v séru profil ODF formulace vykazovaly rychlejší nárůst o Sild úrovně ve srovnání s oběma FCT (P = 0,001 a P = 0.003) a ODT (P = 0.048 a P = 0,041), respektive na 15 a 30 min od podání. Po dohodě s pomalým členění času in vitro (Obrázek 2B), ODF průměrná koncentrace v závislosti na čase in vivo byl hladší, než ty z FCT a ODT (Obrázek 3).
farmakokinetické parametry tří lékových forem, získané analýzou sérových hladin Sild, jsou shrnuty v tabulce 2. Navzdory žádný významný rozdíl byl pozorován mezi tři formulace, pokud jde o Cmax, tmax a AUC 0-240 min, ODF ukázal, nejnižší hodnota Cmax (38.2 ± 23.7 ng/ml) a nejkratší tmax (70.0 ± 24.5 min). Zejména ODF vykazoval významně vyšší hodnotu AUC0-60 min ve srovnání s FCT a ODT (P = 0,005 a P = 0.043), což má za následek zvýšenou relativní biologickou dostupnost Sild během první hodiny od podání ODF sublingvální cestou.

TABULKA 2. Farmakokinetické parametry formulací sildenafilu.
nežádoucí účinky
výsledky získané ze Samostatně podávaného dotazníku o typu a vlastnostech ADR, které zažili účastníci studie, jsou shrnuty v tabulce 3. Ze známých nežádoucích účinků hlášených pro přípravek Sild (Taylor et al ., 2009), nejčastěji zaznamenané byly bolesti hlavy, návaly a nosní kongesce. Jeden pacient po podání FCT hlásil bolest svalů nízkého stupně (stupeň 1 na škále subjektivního hodnocení). Žádný z pacientů nehlásil změněné vidění, tachykardii, slabost nebo změněný sluch.

TABULKA 3. Nežádoucí účinky zaznamenané účastníky studie (N = 20).
ve srovnání s FCT jako referenční formulací vykazovala ODT neměnnou prevalenci ADR. Osobní vnímání intenzity zrudnutí však bylo výrazně nižší (P = 0,031). Na druhé straně ODF vykazoval sníženou prevalenci bolesti hlavy ve srovnání s FCT (P = 0, 043). Navíc, trvání a intenzita zčervenání a překrvení nosní sliznice byla vnímána na nižší úrovni ve srovnání s oběma FCT (respektive, P = 0.011 a P = 0.015) a ODT (respektive, P = 0.026 a P = 0.037).
Diskuse
V této studii jsme prokázali, že sublingvální cesta Sild správy společníci se zvýšeným brzy drog biologickou dostupnost a lepší tolerabilitě. Tento důkaz je podporován jak in vitro vyšetřování, ukazuje, že Sild formulace se vyznačuje delší čas na rozložení, ale výrazně favorizoval trans-mukózní absorpce a in vivo důkazy.
inhibitorů Fosfodiesterázy jsou první volbou terapeutické možnosti pro léčbu ED; nicméně, nežádoucí účinky vyskytly u pacientů jsou uznávány jako nejčastější důvod pro ukončení terapie (Corona et al., 2016). Změny farmakokinetiky prostřednictvím designu nových drog formulace může představovat atraktivní strategii pro zlepšení bezpečnosti/účinnosti profil léku sám (Mehrotra et al., 2007). V tomto ohledu platnost patentu na citrát Sild v roce 2013 v několika evropských zemích umožnila uvolnění řady nových formulací Sild. Je třeba poznamenat, že většina formulací Sild dostupných na současném trhu je ve skutečnosti schválena jako bioekvivalentní formy původního FCT (Leoni et al ., 2013). Zajímavé je, ústně rozpadající lékové formy, vybavený rychlým členění v ústech pacienta bez nutnosti polykání s vodou, byly vyvinuty (Goel et al., 2008). Tyto nové formulace shledávají zlepšenou shodu v populacích pacientů s obtížemi při polykání konvenčních pevných dávek, jako jsou děti, geriatričtí pacienti a dysfagičtí pacienti. Kromě toho, tím, že poskytuje vyšší perorální dostupnost drog, ústně rozpadající lékové formy mohou představovat oceňují systémů, aby prospěch trans-slizniční, a zejména sub-lingual, absorpce (Kathpalia a Gupte, 2013). Zejména v Itálii jsou v lékárenských zařízeních oficiálně k dispozici dvě perorálně rozpadající se formulace Sild: ODT a ODF.
V této studii jsme posuzovali možné farmakokinetické rozdíly, a odpovídající vzor ALTERNATIVNÍHO řešení sporů, vyplývajících z favorizovat trans-slizniční vstřebávání Sild prostřednictvím sub-kulturní správa k dispozici dva ústně rozpadající lékové formy léku. Výsledky byly porovnány s původní formulací Sild, konkrétně s FCTs. Zajímavé je, že jsme našli přísnou korelaci, a to jak in vitro, tak in vitro, mezi bio-technologickými vlastnostmi a PKs různých formulací. Zejména, a to navzdory stejné dávkování léčiv (50 mg) a mírně snížena rychlost uvolňování léčiva v disolučním testu, ODF byl charakterizován větší čas na rozložení a vyšší rychlost permeace v trans-slizniční model, na jedné straně, a zvýšené drog bio-dostupnost během první hodiny od podání léku, na druhé straně. Pak bychom mohli předpokládat, že sub-lingvální absorpce Sild je zvýhodněna dlouhodobým kontaktem lék-sliznice. Ve skutečnosti je tento jev obecně sledován u perorálních trans-mukózních léčiv, kde se doporučuje použití mukoadhezivních polymerů k zajištění prodloužené doby kontaktu mezi formulací a ústní sliznicí (Lam et al ., 2014), zejména z těch léků, jako je Sild, postižených nízkou rozpustností ve vodě (Zayed et al., 2012; Sun a kol., 2014). Tyto předběžné výsledky také naznačují možné zlepšení klinické účinnosti pro tuto třídu léčiv ve srovnání s původními formulacemi. Další studie jsou oprávněné k objasnění těchto aspektů.
nejvýraznějším důkazem této studie je významné snížení nežádoucích účinků sub-kulturní správa ODF, ve srovnání s ODT a FCT podáván ve stejné dávce, což může mít za následek zvýšenou pacientů souladu. Tento důkaz lze interpretovat ve světle principu, že výskyt vedlejšího účinku léčiva se zvyšuje zvýšením sérových hladin a doby expozice samotnému léku (Gupta et al ., 2005; Taylor a kol., 2009). A to i navzdory unvaried globální bio-dostupnost ve srovnání s jinými lékovými analyzovány, sub-kulturní správa ODF vykazovaly nižší hodnoty Cmax a kratšího času tmax, což má za následek výrazně vyšší podíl Sild bio-k dispozici během první hodiny od podání. Mohli bychom tedy spekulovat, že sublingvální podávání ODF kombinuje účinnou absorpci léčiva s dosažením průměrných nižších sérových hladin Sild a následným nižším rizikem nežádoucích účinků. Uznáváme však nízkou velikost vzorku jako hlavní nevýhodu studie. K potvrzení tohoto problému je nutné další vyšetřování větších kohort as různými dávkami.
Na závěr v této studii jsme zprávu, že sublingvální podání Sild ODF zlepšuje snášenlivost léku profil přes pravděpodobné, že zapojení modifikované farmakokinetické oproti generátor FCTs. Ačkoli ODF nebyl původně koncipován pro tento účel, představuje to atraktivní strategii ke zlepšení souladu pacienta s terapií. Vyvíjíme další srovnávací studie k posouzení klinické účinnosti u psychogenních a organických pacientů s ED.
autorské příspěvky
LDT a CF koordinovaly studii a vypracovaly rukopis. MDRP hodnotil a zařazoval pacienty. EF provedl analýzu in vitro. SDA provedla analýzu séra. RP provedl srovnání farmakokinetiky. RP, NR, a AG kriticky revidoval a dokončil rukopis.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
Poděkování
děkujeme Dr. Alberto Barosso, Dr. Giuseppe Maggioni, a Dr. Dimitrij Portale pro pacienty, poradny, Dr. Flavia Rosano a Dr. Alice Passadore pro pacienty řízení, a všichni zaměstnanci Jednotky, Andrologie a Reprodukční Medicíny.
Doplňkový Materiál
Doplňkový Materiál pro tento článek lze nalézt online na: https://www.frontiersin.org/articles/10.3389/fphar.2018.00059/full#supplementary-material
OBRÁZEK S1 | Zástupce obrazy Rozpadu Tablet Tester (a) a Zničení Přístroje (B) používají pro členění testu a zrušení testu, resp.
OBRÁZEK S2 |(A) Údaje z mobilní fáze gradient použit pro vysokoúčinná kapalinová chromatografie-tandemová hmotnostní spektrometrie (HPLC-MS/MS) analýza sérových hladin sildenafilu (Sild). Jsou uvedeny reprezentativní chromatogramy a hmotnostní spektra obou Sild na vnitřním standardu benzanilidu v reálných vzorcích (B). (C) Reprezentativní obraz zbytkové oro-dispergovatelných film (zvýrazněné přerušované čáry), přetrvávající po permeační test v zařízení použit pro in vitro odhad trans-slizniční absorpce přes acetát celulózy membrány.
datový list S1 / dotazník o nežádoucích účincích.
Poznámka pod čarou
- ^http://www.aifa.gov.it/en/content/reporting-adverse-reaction
Banner, L. L., Anderson, R. U. (2007). Integrovaný sildenafil a sexuální terapie kognitivním chováním pro psychogenní erektilní dysfunkci: pilotní studie. J.Sex. Med. 4, 1117–1125. doi: 10.1111 / j. 1743-6109. 2007. 00535.x
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Bischoff, e. (2004). Účinnost, selektivita a důsledky neselektivity inhibice PDE. Int. J. Rez.Suppl. 1, S11-S14. doi: 10.1038 / sj.ijire.3901208
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Boolell, M., Allen, M. J., Ballard, S. a., Gepi-Attee, S., Muirhead, G. J., Naylor, A. M., et al. (1996). Sildenafil: perorálně aktivní inhibitor cyklické GMP specifické fosfodiesterázy typu 5 pro léčbu erektilní dysfunkce penisu. Int. J. Rez.8, 47-52.
PubMed Abstrakt / Google Scholar
Caretta, N., Palego, P., Ferlin, a., Garolla, a., Bettella, a., Selice, R., et al. (2005). Obnovení spontánní erekce u vybraných pacientů postižených erektilní dysfunkcí a různými stupni změny stěny karotidy: role tadalafilu. Euro. Urol. 48, 326–331. doi: 10.1016 / j. eururo.2005.01.013
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Caretta, N., Palego, P., Schipilliti, M., Ferlin, A., Di Mambro, A., a Foresta, C. (2009). Tloušťka kavernózní tepny intima – media: nový parametr v diagnostice vaskulární erektilní dysfunkce. J.Sex. Med. 6, 1117–1126. doi: 10.1111 / j. 1743-6109. 2008. 01112.x
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Carvalheira, a. a., Pereira, s. N. M., Maroka, J., a Forjaz, V. (2012). Výpadek v léčbě erektilní dysfunkce s PDE5: studie o prediktorech a kvalitativní analýza důvodů přerušení léčby. J.Sex. Med. 9, 2361–2369. doi: 10.1111 / j. 1743-6109. 2012. 02787.x
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Centrum pro hodnocení a výzkum léčiv (2003). NDA 021400 Levitra (Vardenafil hydrochlorid) tablety: Přehled Klinické Farmakologie / Biofarmaceutiky. Rockville, Md: Ministerstvo zdravotnictví a sociálních služeb. Silver Spring, MD: Food and Drug Administration.
Google Scholar
Corona, G., Rastrelli, G., Burri, A., Serra, E., Gianfrilli, D., Mannucci, E., et al. (2016). Vypadnutí inhibitorů fosfodiesterázy typu první generace 5: komplexní přehled a metaanalýza. Andrologie 4, 1002-1009. doi: 10.1111 / andr.12255
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Delvadia, P. R., Barr, W. H., a Karnes, H. T. (2012). A biorelevant in vitro release/permeation system for oral transmucosal dosage forms. Int. J. Pharm. 430, 104–113. doi: 10.1016/j.ijpharm.2012.03.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Eardley, I., Donatucci, C., Corbin, J., El-Meliegy, A., Hatzimouratidis, K., McVary, K., et al. (2010). Pharmacotherapy for erectile dysfunction. J. Sex. Med. 7, 524–540. doi: 10.1111/j.1743-6109.2009.01627.x
PubMed Abstract | CrossRef Full Text | Google Scholar
European Pharmacopoeia (2016). Evropské ředitelství pro jakost léčivých přípravků &zdravotnictví (EDQM), 9.Edn. Štrasburk: Rada Evropy.
Google Scholar
Fejős, i., Neumajer, G., Béni, s., and Jankovics, P. (2014). Kvalitativní a kvantitativní analýza inhibitorů PDE-5 v padělaných léčivých přípravcích a doplňcích stravy HPLC-UV za použití sildenafilu jako jediné reference. J. Pharm. Biomed. Anální. 98, 327–333. doi: 10.1016 / j. jpba.2014.06.010
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Goel, h., Rai, P., Rana, V., and Tiwary, a. k. (2008). Orálně se rozpadající systémy: inovace ve formulaci a technologii. Nedávná Pat. Drogové Deliv. Formule. 2, 258–274. doi: 10.2174/187221108786241660
CrossRef Plný Text | Google Scholar
Gupta, M., Kovář, A., a Meibohm, B. (2005). Klinická farmakokinetika inhibitorů fosfodiesterázy-5 pro erektilní dysfunkci. J. Clin. Farmakol. 45, 987–1003. doi: 10.1177/0091270005276847
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Hatzimouratidis, k., Amar, e., Eardley, i., Giuliano, F., Hatzichristou, D., Montorsi, F., et al. (2010). Evropská urologická asociace. Pokyny pro mužskou sexuální dysfunkci: erektilní dysfunkce a předčasná ejakulace. Euro. Urol. 57, 804–814. doi: 10.1016 / j. eururo.2010.02.020
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Hawksworth, D. J., and Burnett, a. L. (2015). Farmakoterapeutická léčba erektilní dysfunkce. Cline. Farmakol. Další. 98, 602–610. doi: 10.1002 / cpt.261
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Heinig, R., Weimann, B., Dietrich, H., and Böttcher, M. F. (2011). Farmakokinetika nové lékové formy vardenafilu dispergovatelné v ústech: výsledky tří klinických studií. Cline. Vyšetřování Drog. 31, 27–41. doi: 10.2165/11584950-000000000-00000
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
kathpalia, H., and Gupte, a. (2013). Úvod do rychle se rozpouštějících orálních tenkovrstvých lékových systémů: přehled. Curre. Drogové Deliv. 10, 667–684. doi: 10.2174/156720181006131125150249
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Lam, JK, Xu, y., Worsley, A., and Wong, i. c. (2014). Orální transmukosální podávání léků pro pediatrické použití. ADV. Drogové Deliv. Rev. 73, 50-62. doi: 10.1016 / j. addr.2013.08.011
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Leoni, L. a., Leite, G. S., Wichi, R. B., a Rodrigues, B. (2013). Sildenafil: dvě desetiletí výhod nebo rizik? Stárnoucí Muž 16, 85-91. doi: 10.3109 / 13685538.2013.801952
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Lotti, F., Corona, G., Castellini, G., Maseroli, E., Fino, M. G., Cozzoliny, M., et al. (2016). Zhoršení kvality spermatu je spojeno se sexuální dysfunkcí podle jeho závažnosti. Hučení. Reprod. 31, 2668–2680. doi: 10.1093/humrep/dew246
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Ludwig, W., Phillips, M. (2014). Organické příčiny erektilní dysfunkce u mužů mladších 40 let. Urol. Int. 92, 1–6. doi: 10.1159/000354931
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Lugnier, C. (2006). Nadrodina cyklické nukleotidové fosfodiesterázy (PDE): nový cíl pro vývoj specifických terapeutických látek. Farmakol. Další. 109, 366–398. doi: 10.1016 / j. Pharm.2005.07.003
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Mehrotra, N., Gupta, M., Kovář, A., a Meibohm, B. (2007). Úloha farmakokinetiky a farmakodynamiky v terapii inhibitorem fosfodiesterázy-5. Int. J. Rez.19, 253-264. doi: 10.1038 / sj.ijire.3901522
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Munoz, m., Bancroft, J., and Marshall, i. (1993). Výkon Rigiscanu při měření tumescence a rigidity penisu. Int. J. Rez.5, 69-76.
Google Scholar
Porst, h., Burnett, a., Brock, G., Ghanem, h., Giuliano, F., Glina, S., et al. (2013). Výbor pro standardy ISSM pro sexuální medicínu. SOP konzervativní (lékařské a mechanické) léčba erektilní dysfunkce. J.Sex. Med. 10, 130–171. doi: 10.1111 / jsm.12023
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Slunce, D., Wei, X., Xue, X., Fang, Z., Ren, M., Lou, H., et al. (2014). Zvýšená perorální absorpce a terapeutický účinek acetylpuerarinu na bázi nanoemulzí d-α-tokoferyl-polyethylenglykolu 1000 sukcinátu. Int. J. Nanomedicína 9, 3413-3423. doi: 10.2147 / IJN.S63777
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Taylor, J., Baldo, O. B., Patrový, s. A., Cartledge, J., a Eardley, I. (2009). Rozdíly v délce trvání nežádoucích účinků a souvisejících hladinách mezi inhibitory fosfodiesterázy typu 5. BJU Int. 103, 1392–1395. doi: 10.1111 / j. 1464-410X. 2008. 08328.x
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Zayed, R., Kamel, a. O., Shukr, M., El-Shamy, a. H. (2012). Srovnávací studie in vitro a in vivo přímo stlačených pevných disperzí a lyofilizovaných sublingválních tablet sildenafilu citrátu pro léčbu plicní arteriální hypertenze. Acta Pharm. 62, 411–432. doi: 10.2478/v10007-012-0027-9
PubMed Abstract | CrossRef Full Text | Google Scholar