Neben der Proteinverarbeitung kümmern sich ER und Golgi auch um einige Arten des Proteintransports. Vesikel (im Wesentlichen membrangebundene Blasen) kneifen sich von den ER-, Golgi- und anderen Membranorganellen ab und tragen alle löslichen Moleküle mit sich, die sich in der eingeschlossenen Flüssigkeit befanden, sowie alle Moleküle, die in diesen Abschnitt der Membran eingebettet sind. Diese Vesikel nehmen dann eine Fahrt auf einem molekularen Motor wie Kinesin oder Myosin auf und bewegen sich entlang des Zytoskeletts, bis sie am entsprechenden Ziel andocken und mit der Zielmembran oder Organelle verschmelzen. Im Allgemeinen bewegen sich Vesikel vom ER zum Cis-Golgi, vom cis zum medialen Golgi, vom medialen zum Trans-Golgi und vom Trans-Golgi zur Plasmamembran oder zu anderen Kompartimenten. Obwohl die meisten Bewegungen in diese Richtung gehen, gibt es auch Vesikel, die sich vom Golgi zurück in die Notaufnahme bewegen und Proteine tragen, die in der Notaufnahme verbleiben sollten (z. PDI) und wurden versehentlich in einem Vesikel aufgeschöpft.
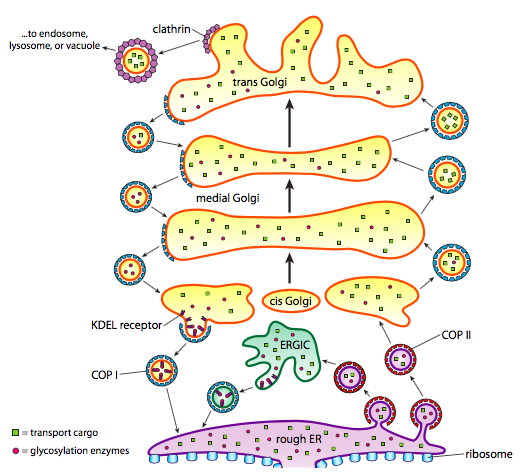
Die Bildung von Vesikeln hängt von Hüllproteinen ab, die sich unter geeigneten Bedingungen selbst zu kugelförmigen Käfigen zusammenbauen. Wenn sie mit Transmembranproteinen assoziiert sind, können sie die angehängte Membran auch in eine Kugelform ziehen. Die Haupttypen von Hüllproteinen, die bei der Vesikelbildung verwendet werden, sind COPII, COPI und Clathrin.
COPII-Hüllproteine bilden die Vesikel, die sich von ER zu Golgi bewegen. COPI-Hüllproteine werden zwischen Teilen des Golgi-Apparats sowie zur Bildung von Vesikeln verwendet, die vom Golgi zurück zum ER gehen. Schließlich wird Clathrin verwendet, um Vesikel zu bilden, die den Golgi für die Plasmamembran verlassen, sowie für Vesikel, die aus der Plasmamembran für die Endozytose gebildet werden.
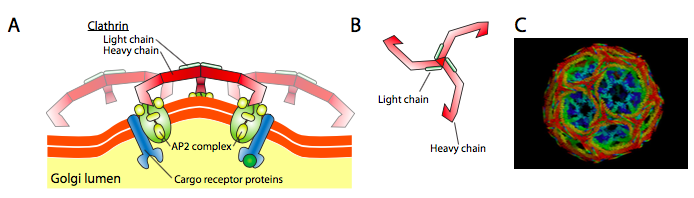
Clathrin (Abbildung \(\pageIndex{17}\)) ist das am besten beschriebene der drei, und die vesikulären Mäntel bestehen aus Anordnungen von Clathrin-Triskelionen (aus dem Griechischen, was dreibeinig bedeutet). Jedes Triskelion besteht aus drei schweren Ketten, die am C-Terminus miteinander verbunden sind, und drei leichten Ketten, von denen eine jeder schweren Kette zugeordnet ist. Die schweren Ketten der verschiedenen Triskelions interagieren entlang der Länge ihrer schweren Kette „Beine“, um ein sehr stabiles Konstrukt zu schaffen. Die leichten Ketten sind für die Vesikelbildung unnötig und sollen dazu beitragen, versehentliche Wechselwirkungen von Clathrinmolekülen im Zytoplasma zu verhindern.
Es besteht eine signifikante Ähnlichkeit zwischen den Vesikelbildungsmechanismen unter Verwendung dieser verschiedenen Hüllproteine, beginnend mit der Rekrutierung von ARF1 (ARF steht für ADP-Ribosylierungsfaktor, der hier nichts mit seiner Funktion zu tun hat) an die Membran. Dies erfordert den ARNO-erleichterten Austausch eines GTP gegen GDP (ARNO ist ARF nucleotide binding site Opener). Sobald ARF1 GTP gebunden hat, zeigt die Konformationsänderung eine N-terminale Myristoylgruppe, die sich in die Membran einfügt. Sowohl COPI als auch Clathrin-beschichtete Vesikel verwenden ARF1 und ARNO, aber COPII verwendet ähnliche Proteine namens Sar1p und Sec12p.
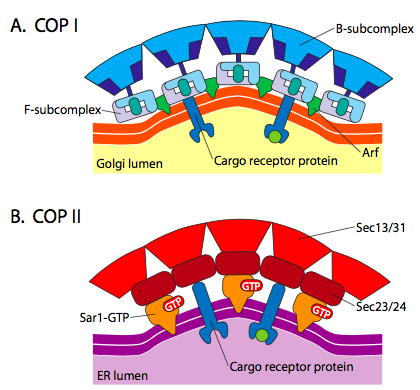
Abbildung \(\pageIndex{18}\). COP-beschichtete Vesikel
Das ARF1 (oder Sar1p) wird verwendet, um Adapterproteine zu rekrutieren, die an das „Schwanzende“ von membrangebundenen Rezeptorproteinen binden. Das andere Ende dieser Rezeptoren bindet an Car-Go-Moleküle, die in das Vesikel verpackt werden müssen. Die Adapterproteine fungieren als Bindeglied zwischen der Membran (durch die Rezeptoren) und den Hüllproteinen. Für Clathrin sind die Adapterproteine AP1 für trans-Golgi-abgeleitete Vesikel und AP2 für endozytäre Vesikel. Für COPI-Vesikel sind die ungefähren Homologen die β-, γ-, δ- und ζ- COPs, während das COPII-System Sec23p und Sec24p verwendet.
Schließlich verbinden sich die Adapter mit den eigentlichen Hüllproteinen: Clathrin, α- oder ε-COP, Sec13p und Sec31p. b. ohne Energieaufwand), bauen sie sich selbst zu käfigartigen Kugelstrukturen zusammen. Unter dem Elektronenmikroskop sind die mit Clathrin beschichteten Vesikel schärfer definiert und die hexagonalen und fünfeckigen Formen, die von den Clathrin-Untereinheiten begrenzt werden, verleihen dem Vesikel ein „Fußball“ -Aussehen. Copatamer-beschichtete Vesikel sehen unter EM viel unschärfer aus.
Alle drei Arten von Vesikelhüllproteinen haben die Fähigkeit, sich spontan zu einem kugelförmigen Konstrukt zu assoziieren, aber nur das mit COPI und COPII beschichtete Vesikel „kneift“ auch spontan die Membran ab, um das Vesikel von seiner Ursprungsmembran zu lösen. Clathrin-beschichtete Vesikel benötigen einen externen Mechanismus, um das Vesikel freizusetzen (Abbildung \(\pageIndex{19}\)).
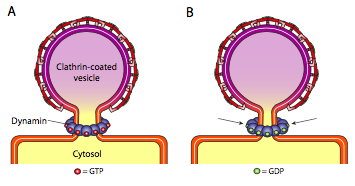
Sobald das Vesikel fast fertig ist, gibt es noch einen kleinen Stiel oder Membranhals, der das Vesikel mit der Membran verbindet. Um diesen Stiel aggregieren dynamische GTP-Moleküle in einer Ring- / Spiralkonstruktion. Dynaminmoleküle sind globuläre GTPasen, die sich bei der Hydrolyse von GTP zusammenziehen. Wenn sie sich um den Vesikelstängel verbinden, zieht sich jedes Dynaminprotein zusammen, mit dem kombinierten Effekt, den Stiel so weit einzuengen, dass die Membran zusammenquetscht, abdichtet und das Vesikel von der Ursprungsmembran freigibt.
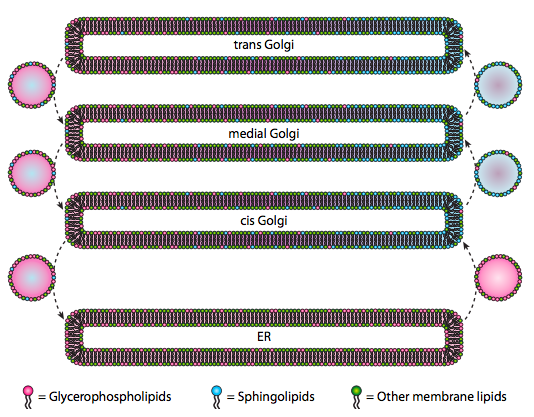
Obwohl Lipide und Membranen in Kapitel 4 diskutiert wurden, haben wir es versäumt, den Ort ihrer Synthesen in Eukaryoten zu diskutieren. Wie Abbildung \(\pageIndex{20}\) zeigt, ist die Synthese bestimmter Arten von Lipiden getrennt und exklusiv. Glycerophospholipide werden hauptsächlich im endoplasmatischen Retikulum gebildet, obwohl sie auch in Mitochondrien und Peroxisomen gebildet werden. Im Gegensatz dazu werden Sphingolipide nicht in der ER (obwohl ihre Ceramid-Vorläufer sind) in Säugetieren hergestellt, die notwendigen Enzyme werden im Lumen der cis und medialen Golgi gefunden. Es gibt Hinweise auf einen anterograden und retrograden vesikulären Verkehr zwischen den verschiedenen Golgi- und ER-Kompartimenten, was theoretisch auf eine Umverteilung der Lipidtypen hindeuten würde. Die Sphingolipide neigen jedoch dazu, sich zu Lipidflößen zu aggregieren und scheinen in anterograden sich bewegenden Vesikeln konzentrierter zu sein.
Die Hüllproteine lösen sich kurz nach der vesikulären Freisetzung ab. Bei Clathrin handelt es sich um Hsc70, eine ATPase. Bei mit COPI oder COPII beschichteten Vesikeln scheint jedoch die Hydrolyse des GTP auf ARF / Sar1p die Hüllproteinaffinität für die Adapter zu schwächen und die Entschichtung einzuleiten. Der GTPase-Aktivator ist ARF GAP (oder Sec23p) und ist ein integraler Bestandteil der COP I (oder II) -Schicht.
Die Vesikel tragen zwei Kategorien von Fracht: lösliche Proteine und Transmembranproteine. Von den löslichen Proteinen werden einige durch Bindung an einen Rezeptor im Vesikel aufgenommen. Andere Proteine sind zufällig in der Nähe und werden geschöpft, wenn sich die Vesikel bilden. Gelegentlich wird ein Protein aufgenommen, das nicht sein sollte; Zum Beispiel kann PDI in einem Vesikel eingeschlossen sein, das sich aus dem ER bildet. Es hat wenig Funktion im Golgi und wird in der Notaufnahme benötigt, also was passiert damit? Glücklicherweise haben PDI und viele andere ER-Proteine eine C-terminale Signalsequenz, KDEL (Lysin-Asparaginsäure-Glutaminsäure-Leucin), die schreit: „Ich gehöre in die ER.“ Diese Sequenz wird von KDEL-Rezeptoren im Golgi erkannt, und die Bindung der KDEL-Proteine an die Rezeptoren löst die Vesikelbildung aus, um sie zurück in die Notaufnahme zu schicken.
Sekretorische Vesikel haben ein besonderes Problem mit löslicher Fracht. Wenn das Vesikel während des Bildungsprozesses einfach darauf angewiesen wäre, Proteine darin einzuschließen, wäre es schwierig, hohe Konzentrationen dieser Proteine zu erhalten. Viele sekretierte Proteine werden vom Organismus schnell und in signifikanten Mengen benötigt, so dass es im Trans-Golgi einen Mechanismus zur Aggregation sekretorischer Proteine gibt. Der Mechanismus verwendet aggregierende Proteine wie Secretogranin II und Chromogranin B, die die Zielproteine in großen konzentrierten Granulaten zusammenbringen. Diese Granine funktionieren am besten im Trans-Golgi-Milieu mit niedrigem pH-Wert und hohem Ca2 +, wenn also das Vesikel seinen Inhalt außerhalb der Zelle freisetzt, zerbricht der höhere pH-Wert und das niedrigere Ca2 + die Aggregate, um die einzelnen Proteine freizusetzen.
Während der Reifung des Golgi ändert sich der pH-Wert ständig, so dass jedes Kompartiment von ER zu Golgi einen zunehmend niedrigeren (saureren) lumenalen pH-Wert aufweist.
Schließlich stellt sich die Frage, auf die Vesikel abzuzielen. Die Vesikel sind viel weniger nützlich, wenn sie auf einen molekularen Güterzug geworfen und zufällig abgesetzt werden. Daher gibt es einen Andockmechanismus, der eine Anpassung des v-SNARE-Proteins an der zytoplasmatischen Oberfläche des Vesikels und der t-SNARE an der zytoplasmatischen Oberfläche der Zielmembran erfordert. Die Fusion des Vesikels mit der Membran erfolgt nur bei Übereinstimmung. Andernfalls kann das Vesikel nicht verschmelzen und wird sich an einen anderen molekularen Motor anlagern, um zu einem anderen, hoffentlich korrekten Ziel zu gelangen. Dieser Prozess wird durch Tethering-Proteine unterstützt, die zunächst Kontakt mit einem ankommenden Vesikel aufnehmen und es nahe genug an das Ziel ziehen, um die SNARE-Protein-Interaktion zu testen. Andere Proteine auf dem Vesikel und den Zielmembranen interagieren dann und wenn die Schlingen übereinstimmen, können sie dazu beitragen, das Vesikel in die Zielmembran zu „winden“, woraufhin die Membranen verschmelzen. Eine wichtige Faustregel zum Verständnis der vesikulären Fusion und auch der Direktionalität von Membranproteinen und Lipiden ist, dass die zytoplasmatisch zugewandte Seite einer Membran immer dem Zytoplasma zugewandt ist. Daher wurde zunächst ein Protein, das sich schließlich auf der äußeren Oberfläche der Zellmembran befindet, in die lumenale Oberfläche der ER-Membran eingeführt.
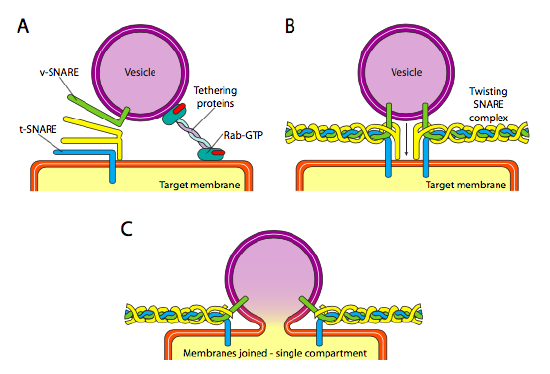
Genauer gesagt, wenn sich ein Vesikel der Zielmembran nähert, assoziiert sich das Tethering-Protein Rab-GTP, das über einen doppelten Geranylgeranyl-Lipidschwanz mit der Zielmembran verbunden ist, lose mit dem Vesikel und hält es in der Nähe der Zielmembran, um den SCHLINGEN eine Chance zu geben, zu arbeiten. Die v-SNAREs und t-SNAREs haben jetzt die Möglichkeit zu interagieren und für ein Spiel zu testen. Vor kurzem wurden die Schlingen in R-Schlingen bzw. Q-Schlingen umbenannt, basierend auf konservierten Arginin- und Glutaminresten. Zusätzlich zu diesen beiden primären Schlingen ist mindestens eine weitere SCHLINGE beteiligt, die zusammen ein Bündel von vier α-Helices bildet (vier, nicht drei, da zumindest im am besten untersuchten Beispiel eine der Schlingen so gebogen ist, dass zwei ihrer alpha-helikalen Domänen an der Wechselwirkung teilnehmen. Die vier Helices wickeln sich umeinander und es wird angenommen, dass sie dabei das Vesikel und die Zielmembran zusammenziehen.
Das Tetanustoxin Tetanospasmin, das von Clostridium tetani-Bakterien freigesetzt wird, verursacht Krämpfe, indem es auf Nervenzellen einwirkt und die Freisetzung von Neurotransmittern verhindert. Der Mechanismus dafür ist, dass es Synaptobrevin, ein SNARE-Protein, spaltet, so dass die synaptischen Vesikel nicht mit der Zellmembran verschmelzen können. Botulinumtoxin aus Clostridium botulinum wirkt auch auf Schlingen, um die Vesikelfusion und die Freisetzung von Neurotransmittern zu verhindern, obwohl es auf verschiedene Neuronen abzielt und daher den gegenteiligen Effekt hat: tetanus wird durch die Verhinderung der Freisetzung von inhibitorischen Neurotransmittern verursacht, während Botulismus durch die Verhinderung der Freisetzung von exzitatorischen Neurotransmittern verursacht wird.