Reaktion: Hydratation von Alkinen
Wie bei Alkenen erfordert die Hydratation (Zugabe von Wasser) zu Alkinen eine starke Säure, üblicherweise Schwefelsäure, und wird durch Quecksilbersulfat erleichtert. Im Gegensatz zu den Additionen an Doppelbindungen, die Alkoholprodukte ergeben, ergibt die Addition von Wasser an Alkine Ketonprodukte (mit Ausnahme von Acetylen, das Acetaldehyd ergibt). Die Erklärung für diese Abweichung liegt in der Enol-Keto-Tautomerisierung, die durch die folgende Gleichung veranschaulicht wird. Das Ausgangsprodukt aus der Zugabe von Wasser zu einem Alkin ist ein Enol (eine Verbindung mit einem Hydroxylsubstituenten, der an eine Doppelbindung gebunden ist), und dieses ordnet sich sofort zu dem stabileren Keto-Tautomer um.
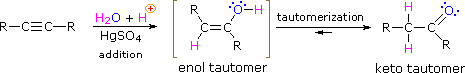
Tautomere sind definiert als schnell interkonvertierte Konstitutionsisomere, die sich üblicherweise durch eine unterschiedliche Bindungsstelle für ein labiles Wasserstoffatom (hier rot gefärbt) und eine unterschiedlich gelegene Doppelbindung auszeichnen. Das Gleichgewicht zwischen Tautomeren ist nicht nur unter normalen Bedingungen schnell, sondern begünstigt häufig eines der Isomere stark ( Aceton ist beispielsweise 99,999% Keto-Tautomer ). Selbst in solchen einseitigen Gleichgewichten kommt der Beweis für das Vorhandensein des kleinen Tautomers aus dem chemischen Verhalten der Verbindung. Tautomere Gleichgewichte werden durch Spuren von Säuren oder Basen katalysiert, die in den meisten chemischen Proben im Allgemeinen vorhanden sind. Die drei unten gezeigten Beispiele veranschaulichen diese Reaktionen für verschiedene Substitutionen der Dreifachbindung. Der Tautomerisierungsschritt ist durch einen roten Pfeil gekennzeichnet. Für endständige Alkine folgt die Zugabe von Wasser der Markovnikov-Regel, wie im zweiten Beispiel unten, und das Endprodukt ist ein Methylketon (mit Ausnahme von Acetylen, im ersten Beispiel gezeigt ). Für interne Alkine (die Dreifachbindung ist längerkettig) ist die Zugabe von Wasser nicht regioselektiv. Wenn die Dreifachbindung nicht symmetrisch angeordnet ist (d. H. Wenn R & R‘ in der dritten Gleichung nicht gleich ist), werden zwei isomere Ketone gebildet.
HC≡CH + H2O + HgSO4 & H2SO4 –> –> H3C-CH=O
RC≡CH + H2O + HgSO4 & H2SO4 –> –> RC(=O)CH3
RC≡CR‘ + H2O + HgSO4 & H2SO4 –> –> RCH2-C(=O)R‘ + RC(=O)-CH2R‘
Mit der Zugabe von Wasser können Alkine hydratisiert werden, um Enole zu bilden, die spontan zu Ketonen tautomerisieren. Die Reaktion wird durch Quecksilberionen katalysiert. Folgt Markovnikovs Regel: Endständige Alkine ergeben Methylketone
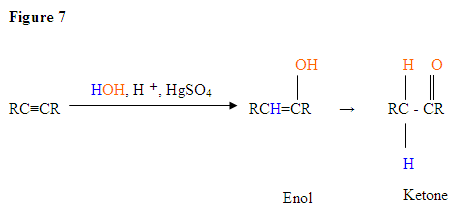
- Der erste Schritt ist eine Säure / Base-Reaktion, bei der die π-Elektronen der Dreifachbindung als Lewis-Base wirken und das Proton angreifen, wodurch der Kohlenstoff mit den meisten Wasserstoffsubstituenten protoniert wird.
- Der zweite Schritt ist der Angriff des nukleophilen Wassermoleküls auf das elektrophile Carbokation, das ein Oxoniumion erzeugt.
- Als nächstes deprotonieren Sie durch eine Base und erzeugen einen Alkohol namens Enol, der dann zu einem Keton tautomerisiert.
- Tautomerie ist eine gleichzeitige Proton- und Doppelbindungsverschiebung, die von der Enolform zur Ketoisomerform übergeht, wie oben in Abbildung 7 gezeigt.
Schauen wir uns nun einige Hydratationsreaktionen an.
Hydratation von terminalem Alkin erzeugt Methylketone
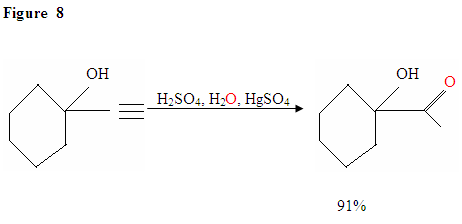
Wie in Abbildung 7 beschrieben, greifen die π-Elektronen ein Proton an und bilden ein Carbokation, das dann von den nukleophilen Wassermolekülen angegriffen wird. Nach der Deprotinierung erzeugen wir ein Enol, das dann in die gezeigte Ketonform tautomerisiert.
Hydratation von Alkin
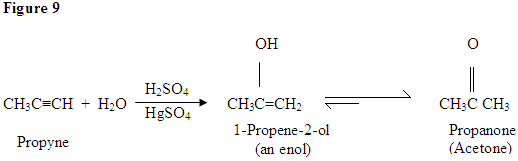
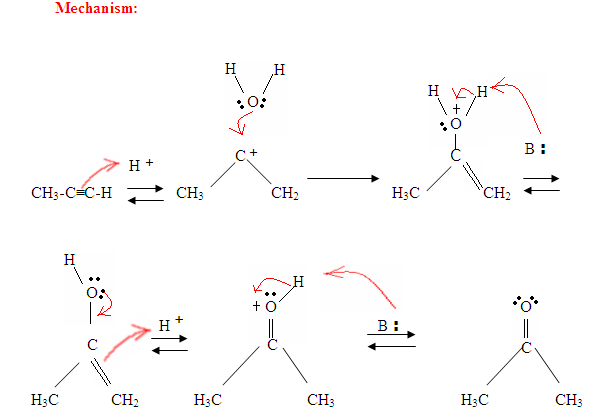
Wie Sie hier sehen können, greifen die π-Elektronen der Dreifachbindung das Proton an, das eine kovalente Bindung an den Kohlenstoff mit den meisten Wasserstoffsubstituenten bildet. Sobald der Wasserstoff gebunden ist, haben Sie ein Carbokation, das vom Wassermolekül angegriffen wird. Jetzt haben Sie eine positive Ladung auf den Sauerstoff, was dazu führt, dass eine Base hereinkommt und das Molekül entschützt. Einmal deprotiniert, haben Sie ein Enol, das dann tautomerisiert wird.
Tautomerie wird hier gezeigt, wenn das Proton durch die Doppelbindung π Elektronen angegriffen wird, die eine kovalente Bindung zwischen dem Kohlenstoff und dem Wasserstoff auf dem weniger substituierten Kohlenstoff bilden. Elektronen aus dem Sauerstoff gelangen zum Kohlenstoff, bilden eine Doppelbindung mit Kohlenstoff und geben sich eine positive Ladung, die dann von der Base angegriffen wird. Die Base deprotiniert den Sauerstoff, was zu dem stabileren Endprodukt im Gleichgewicht führt, das ein Keton ist.
Übung \(\pageIndex{1}\)
- Zeichnen Sie die Struktur des Produkts, das entsteht, wenn jede der folgenden Substanzen mit H2O / H2SO4 in Gegenwart von H2SO4 behandelt wird.
- $\ce{\sf{CH3-CH2-C#C-H}}$
-
- Zeichnen Sie die Struktur der Ketoform der unten gezeigten Verbindung. Welche Form würden Sie am stabilsten erwarten?
Antwort
Antworten:
Die Ketoform sollte am stabilsten sein.
Fragen
Q9.4.1
Mit welchem Alkin würden Sie beginnen, um die folgenden Produkte in einer Oxidationsreaktion zu gewinnen? Denken Sie an Resonanz.

Frage 9.4.2
Schlagen ein Reaktionsschema für die folgende Verbindung vor, das vom Alkin ausgeht und die erforderlichen Reagenzien und Zwischenprodukte zeigt.

Lösungen
S9.4.1

S9.4.2
