Zelladhäsion
Zelladhäsion ist der Prozess, bei dem Zellen mit bestimmten Molekülen auf der Zelloberfläche interagieren und sich an benachbarte Zellen anlagern. Dieser Prozess kann durch direkte oder indirekte Wechselwirkungen zwischen Zelloberflächen erfolgen, wobei sich die Zellen an die umgebende extrazelluläre Matrix anlagern, die die von den Zellen in den Raum zwischen den Zellen freigesetzten Moleküle enthält. Zelladhäsion tritt auf, wenn das Zelladhäsionsmolekül (CAM) mit einem Transmembranprotein interagiert, das sich auf der Zelloberfläche befindet. Die Zelladhäsion verbindet Zellen auf unterschiedliche Weise und kann an der Signaltransduktion teilnehmen, damit Zellen Veränderungen in der Umgebung erkennen und darauf reagieren können. Andere zelluläre Prozesse, die durch Zelladhäsion reguliert werden, umfassen Zellmigration und Gewebeentwicklung in mehrzelligen Organismen. Veränderungen der Zelladhäsion können wichtige zelluläre Prozesse stören und zu einer Vielzahl von Krankheiten führen, darunter Krebs und Arthritis. Die Zelladhäsion ist auch für Krankheiten, die durch infektiöse Organismen wie Bakterien oder Viren verursacht werden, unerlässlich.
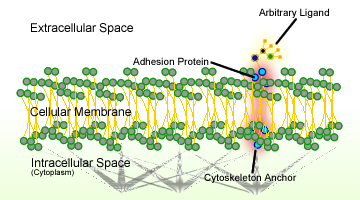 Abbildung 1. Schema der Zelladhäsion
Abbildung 1. Schema der Zelladhäsion
Klassifikationen
CAMs sind in vier Hauptfamilien unterteilt: Integrine, Immunglobulin (Ig) -Superfamilie, Cadherin und Selektine. Jedes dieser Adhäsionsmoleküle hat eine andere Funktion und erkennt einen anderen Liganden. Cadherine und Immunglobuline sind homotypische Nocken, da sie direkt an denselben Nockentyp auf einer anderen Zelle binden, während Integrine und Selektine heterologe Nocken sind, die an verschiedene Nockentypen binden. Defekte in der Zelladhäsion werden oft auf Defekte in der Genexpression zurückgeführt. In mehrzelligen Organismen bewirkt die Bindung zwischen Nocken, dass Zellen aneinander haften und eine Struktur bilden, die als Zellverbindung bezeichnet wird.
Entsprechend ihrer Funktionen können die Zellverbindungen klassifiziert werden als:
Verankerungsverbindungen (Adherens Junctions, Desmosomen und Hemidesmosomen), die Zellen entlang halten und den Kontakt zwischen Zellen stärken.
Verschließende Übergänge (Tight Junctions), die Lücken zwischen Zellen durch Zell–Zell-Kontakt abdichten und eine wasserfeste Barriere für die Diffusion bilden.
Kanalbildende Übergänge (Gap Junctions), die das Protoplasma benachbarter Zellen verbinden und den Transport von Molekülen zwischen Zellen ermöglichen.
Signal-Relaying Junctions, die Synapsen innerhalb des Systems sein könnten.
Alternativ können Zellübergänge in 2 Hauptvarianten eingeteilt werden, je nachdem, was mit der Zelle interagiert: Zell–Zell–Übergänge, die hauptsächlich durch Cadherin vermittelt werden, und Zell-Matrix-Übergänge, die hauptsächlich durch Integrine vermittelt werden.
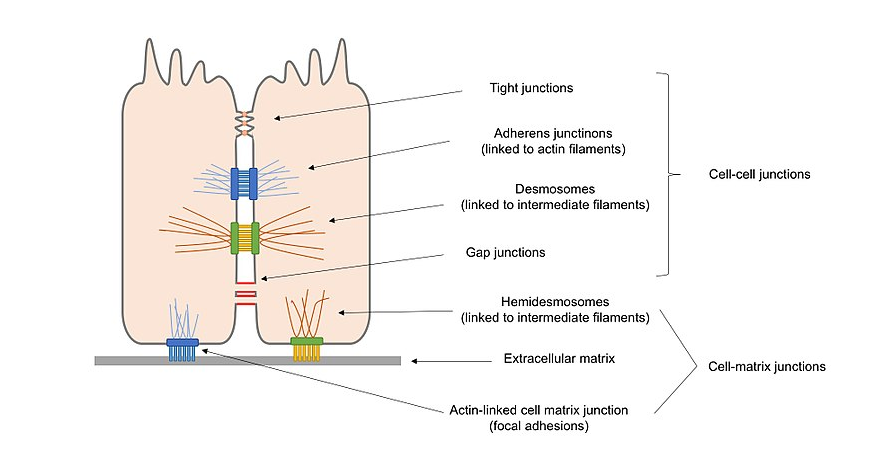 Abbildung 2. Übersichtsdiagramm der verschiedenen Arten von Zellverbindungen in Epithelzellen, einschließlich Zell-Zell-Verbindungen und Zell–Matrix-Verbindungen.
Abbildung 2. Übersichtsdiagramm der verschiedenen Arten von Zellverbindungen in Epithelzellen, einschließlich Zell-Zell-Verbindungen und Zell–Matrix-Verbindungen.
Strukturelle Eigenschaften von Zelladhäsionsproteinen
Zelladhäsionsproteine sind üblicherweise Glykoproteine, die die Zell-Zell- und Zell-Extrazellularmatrix-Erkennung an der extrazellulären Oberfläche vermitteln. Die meisten Zelladhäsionsmoleküle haben ähnliche Konformationen in ihren adhäsiven Domänen. Zum Beispiel: Die adhäsiven Domänen von Cadherin, Immunglobulin ii, Fibronektin Typ III und EGF sind überwiegend β-Blattstrukturen. Das gemeinsame Motiv, das an der Zelladhäsion beteiligt ist, ist die griechische Schlüsselfass-Struktur, die ein oder zwei antiparallele β-Sandwiches enthält.
Ig-ähnliche Domänen sind eine Hauptklasse der griechischen Schlüsseldomänen. Sie haben Sequenzähnlichkeiten mit der variablen oder konstanten Domäne von Antikörpern, die sieben bis neun antiparallele β-Stränge enthalten. Die antiparallelen P-Bleche bilden einen 3D-β-Zylinder. Ig-ähnliche Domänen werden durch hydrophobe Kern- und Disulfidbindungen stabilisiert. Sie sind in zwei Hauptgruppen unterteilt: Ig C-ähnliche und Ig V-ähnliche Domänen.
Funktionell verwandte strukturelle Eigenschaften von Zelladhäsionsproteinen
Zelladhäsionsproteine weisen eine funktionelle Vielfalt auf. Die Wechselwirkung von Zelladhäsionsmolekülen könnte homophil oder heterophil sein Protein-Protein-Wechselwirkungen oder Protein-Kohlenhydrat-Wechselwirkungen. Strukturelle Veränderungen der Zelladhäsionsmoleküle hängen oft mit ihren funktionellen Eigenschaften zusammen.
Homophile Protein-Protein-Wechselwirkungen.
Cadherin sind beispielsweise Transmembran-Ca2+-abhängige homophile Adhäsionsmoleküle. Cadherin sind für die Aufrechterhaltung der Verbindungen zwischen ähnlichen Zellen in Geweben verantwortlich. Die Zell-Zell-Adhäsion wird durch die N-terminale Domäne der Cadherin vermittelt. Es enthält fünf ähnliche extrazelluläre Domänen EC1 bis EC5. Röntgenkristallographische Untersuchungen an N-Cadherin zeigten, dass die EC1-Domäne ein Dimer bildet, in dem die Monomere parallel zu ihrer von der Plasmamembran nach außen weisenden adhäsiven Bindungsfläche orientiert sind. Die Monomereinheiten der EC1-Domänen interagieren antiparallel miteinander, nutzen ihre adhäsiven Bindungsflächen und bilden eine β-Barrel-Struktur. Es wurde vorgeschlagen, dass eine mutmaßliche Grenzfläche der Wechselwirkung sowohl hydrophoben als auch polaren / geladenen Charakter hat, der die Grenzfläche der Wechselwirkung von Immunglobulindomänen miteinander in der Ig-Superfamilie nachahmt.
Heterophile Protein-Protein-Wechselwirkungen.
Beispielsweise ist die Bindung der Integrine an verschiedene Zelloberflächenrezeptoren und extrazelluläre Matrixliganden eine Hauptklasse der heterophilen Protein-Protein-Interaktion in Zelladhäsionssystemen. Bei Bindung an lösliches Fibrinogen wird das Integrin aIIbß3 in einen hochaffinen Bindungszustand überführt. Die in diesem Fall durch Ligandenbindung induzierten Konformationsänderungen des Integrins sind entscheidend für dessen adhäsive Aktivität. Die Bindung eines T-Zell-Rezeptors kann auch die Bindungsaffinität des Integrin, leukozytenfunktionsassoziiertes Antigen- 1 (LFA-1), an seine Rezeptoren wie ICAM-l oder ICAM-2 (interzelluläres Zelladhäsionsmolekül) modulieren. Die Bindung von ICAM-l kann weitere Konformationsänderungen von LFA-1 induzieren. Die adhäsive Bindungsstelle des Proteins befindet sich im C-Terminal von LFA-l basierend auf röntgenkristallographischen Untersuchungen.Ein Tripeptid, Arginin-Glycin-Asparaginsäure (RGD), ist ein häufiges Integrin-Ligandenbindungsmotiv. Zum Beispiel hat das Integrin-bindende Ligand-Typ-III-Modul von Fibronektin eine griechische Schlüsselfass-Struktur, deren RGD-Motiv, das sich an der Spitze der Schleife befindet, die F- und G-β-Stränge verbindet, Adhäsion vermittelt. Das Begradigen der RGD-Schleife in eine linearere fluktuierende Konformation durch Entfaltung verringert die Zugänglichkeit der Schleife zu den oberflächengebundenen Integrinen und verringert daher die Affinität und Selektivität der Bindung.
Protein-Kohlenhydrat-Wechselwirkungen.
Die Selektine sind wichtig für die Interaktion von Lymphozyten und Neutrophilen mit dem vaskulären Endothel. Die Selektine sind Adhäsionsmoleküle, die an Kohlenhydrate binden. Direkte strukturelle Daten zur Bindung von Selektinen an Kohlenhydrate liegen noch nicht vor. Die Selektine binden Kohlenhydrate mit geringer Affinität und haben sehr schnelle Ein- und Ausschaltraten.