DISKUSSION
Wir haben hier die Genomgrößen von 25 Chironomidenarten bestimmt; diese Werte deckten sich mit den Genomgrößen der drei zuvor in der Literatur berichteten Arten (Petitpierre, 1996; Schmidt-Ott et al., 2009), die zwischen 0,13 und 0,21 pg DNA enthielten. Die Ergebnisse dieser Studie zeigten, dass die Genomgrößen von Chironomiden einheitlich sehr klein waren (Abb. 3, Tabelle 1). Der erhaltene mittlere C-Wert für die Familie der Chironomidae beträgt 0,13 + 0.03 pg DNA, die deutlich kleiner ist als D. melanogaster Genomgröße. Die kleinste Genomgröße unter den Insekten wurde in der Strepsiptera Caenocholax fenyesi mit etwa 0,11 pg DNA (entspricht etwa 108 Mb) registriert, obwohl auch die hessische Fliege Mayetiola destructor eine noch kleinere Genomgröße von 0,09 pg aufwies (Johnston et al., 2004; Gregory, 2014). Hier berichten wir über mindestens drei Arten mit kleineren Genomen als jedes bekannte Insekt: C. tsushimensis, Diamesa japonica und Hydrobaenus tsukubalatus mit C-Werten von 0,07 pg, 0,08 pg bzw. 0,08 pg (Tabelle 1). Nach unserem Kenntnisstand ist C. tsushimensis (Abb. 1B) kann nun als die kleinste Genomgröße eines bekannten Insekts angesehen werden, mit einem C-Wert von 0,07 pg DNA, was ungefähr 68 Mb entspricht. Dieser Wert deckt sich mit der Genomgröße einer verwandten Spezies, Clunio marinus, die einmal auf 95 Mb und in jüngerer Zeit auf 87,2 Mb geschätzt wurde (Kaiser und Heckel, 2012; Tobias S. Kaiser, personal communication).
Kürzlich wurde das Genom der antarktischen Mücke B. antarctica sequenziert (Kelley et al., 2014). Die Autoren behaupteten, dass die Genomgröße dieser Art auf 89 geschätzt wird.5-105 Mb, war die kleinste unter allen Insekten. Wir zeigen hier jedoch, dass diese Genomgröße im normalen Bereich der Chironomidenwerte liegt. Die Autoren schlugen auch vor, dass die kleine Genomgröße von B.. Die Antarktis war eine Anpassung an extrem kalte Umgebungen. Unsere Daten können diese Hypothese bestätigen, da D. japonica, eine alpine Art aus der Unterfamilie Diamesinae, ebenfalls eine winzige Genomgröße aufweist. Eine weitere verwandte Diamesinae, die Himalaya-Mücke Diamesa sp. es wurde tatsächlich festgestellt, dass es bei Temperaturen von bis zu -16 ° C aktiv ist (Kohshima, 1984). Telmatogeton japonicus, das sich auch bei sehr niedrigen Temperaturen entwickeln kann (Danks, 1971; Sunose und Fujisawa, 1982), zeigt jedoch im Vergleich zum Durchschnitt der Chironomidenfamilie eine relativ große Genomgröße. Ein phylogenetischer Einfluss auf die Genomgröße sollte hier berücksichtigt werden, da B. antarctica zur Unterfamilie Orthocladiinae gehört, die im Durchschnitt kleine Genomgrößen aufweist. Die Arten C. tsushimensis und Hydrobaenus tsukubalatus, die die kleinsten Genomgrößen unter den Chironomiden aufweisen, gehören ebenfalls zur Unterfamilie Orthocladiinae. Somit ist die geringe Genomgröße von B. die Antarktis kann einfach ein Ahnenmerkmal darstellen, nicht das Ergebnis extremer Kälteanpassung.
P. vanderplanki ist die einzige bekannte Insektenart, die eine Anhydrobiose in einem vollständig dehydrierten Zustand erreicht (Abb. 1D) und erholen sich nach Rehydratation (Hinton, 1951, 1960a; Watanabe, 2006; Cornette und Kikawada, 2011). Unsere Forschungsgruppe hat kürzlich eine vergleichende Analyse der Genomsequenzen des desikkationstoleranten Polypedilum vanderplanki und des desikkationssensitiven kongeneren Polypedilum nubifer veröffentlicht (Gusev et al., 2014). Der Vergleich zeigte, dass beide Arten ähnliche Genomgrößen aufwiesen und dass nur ein begrenzter Satz duplizierter Gencluster mit Anhydrobiose in P. vanderplanki (Gusev et al., 2014). Die aus der Genomassemblierung abgeleiteten Genomgrößen betrugen 104 Mb für P. vanderplanki und 107 Mb für P. nubifer und diese Werte unterschieden sich nicht wesentlich von den für diese Arten in der vorliegenden Studie gemessenen Genomgrößen, die ungefähr 98 Mb entsprachen. P. vanderplanki und P. nubifer-Genome zeigten einen ähnlich geringen Anteil an DNA-Wiederholungen und es wurde nur eine geringe Anzahl transponierbarer Elemente im Vergleich zu anderen Dipteran-Arten gefunden. Diese Reduktion des Anteils transponierbarer Elemente wurde auch bei der antarktischen Mücke, B. antarctica (Kelley et al., 2014). Die durchschnittliche Intronlänge war auch in der antarktischen Mücke und sowohl in P. vanderplanki als auch in P. nubifer erheblich reduziert (Gusev et al., 2014). Da die Austrocknung empfindlich und einfrieren intolerant P. nubifer teilt diese Merkmale mit der antarktischen Mücke und der anhydrobiotischen Mücke, ein geringer Anteil transponierbarer Elemente und eine kurze Intronlänge können ein Merkmal darstellen, das allen Chironomiden gemeinsam ist, und stehen möglicherweise nicht in direktem Zusammenhang mit der Toleranz gegenüber extremen Umgebungen, auch wenn ein adaptiver Effekt nicht ausgeschlossen werden konnte.
Abb. 3.
Phylogenie der Dipteren mit geschätzten C-Werten. Die Chironomidenfamilie ist in Schwarz dargestellt. Die gestrichelte Linie zeigt die Genomgröße von D. melanogaster. Das phylogenetische Kladogramm ist ein Konsens aus verschiedenen Chironomiden- und Dipteranbäumen (Yeates und Wiegmann, 1999, 2005; Saether, 2000; Cranston et al., 2012). Fehlerbalken zeigen die Standardabweichung an. Genomgrößen ohne Fehlerbalken wurden aus früheren Studien erhalten, die in der Animal Genome Size Database (Gregory, 2014) aufgeführt sind.
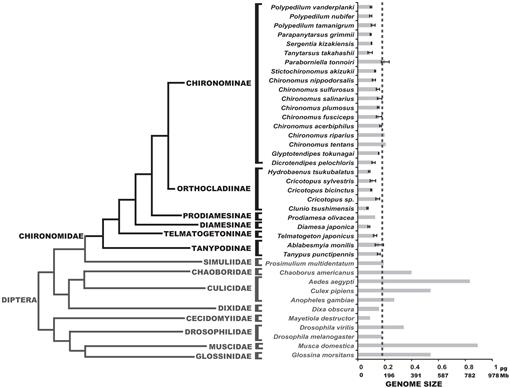
Abb. 4.
Beziehung zwischen Körpergröße und Genomgröße bei den in der vorliegenden Studie untersuchten Chironomidenarten. (A) Für jede Spezies wird die mittlere Gesamtkörperlänge in Millimetern angegeben und der mittlere C-Wert in pg-DNA ausgedrückt. Nur eine schwache positive Korrelation (r2 = 0,171, n = 25), materialisiert durch eine durchgezogene Linie, wurde zwischen den beiden Variablen beobachtet. (B) Auf Gattungsebene wurden Mittel der gleichen Werte durch die Methode der phylogenetisch unabhängigen Kontraste transformiert, basierend auf der Phylogenie von Cranston et al. (2012). Die Korrelation zwischen diesen transformierten Kontrasten, die durch eine durchgezogene Linie materialisiert wurden, war nicht signifikant (r2 = 0, 118, n = 13). Die Datenanalyse wurde an Prism 4 durchgeführt.0 software für Macintosh (GraphPad Software, Inc.).

Was könnten die adaptiven Merkmale sein, die möglicherweise mit den winzigen Genomgrößen in der Familie der Chironomidae verbunden sind? Tatsächlich wurden mehrere Entwicklungs- und ökologische Faktoren vorgeschlagen, um mit der Genomgröße zu korrelieren. Erstens wurde in vielen Taxa eine positive Korrelation zwischen Genomgröße und Körpergröße gefunden, und diese Korrelation erscheint als relativ allgemeines Phänomen (Gregory, 2005). Diese Korrelation wurde auch bei Moskitos berichtet (Ferrari und Rai, 1989), aber bei anderen Insektentaxa ist sie nicht immer klar (Gregory und Hebert, 2003; Ardila-Garcia und Gregory, 2009). Innerhalb der Chironomiden fanden wir nur eine schwache positive Korrelation zwischen Genomgröße und Körpergröße (Abb. 4A). Der mittlere C-Wert für die Gattung Chironomus (0,15 pg) war höher als der für die Gattung Polypedilum (0,10 pg), und dieser Unterschied kann auf die allgemein größere Körpergröße von Chironomus-Arten zurückzuführen sein. Der phylogenetische Abstand zwischen beiden Gattungen könnte jedoch auch diesen Unterschied der Genomgrößen erklären. Folglich korrigierten wir unsere Daten auf Gattungsebene mit phylogenetisch unabhängigen Kontrastanalysen (Garland und Adolph, 1994; Garland et al., 2005) und als Ergebnis erwies sich die Korrelation zwischen Genomgröße und Körpergröße als nicht signifikant (Abb. 4B). Der enge Bereich der Chironomidengenomgrößen (nur zwei—dreifach) und die durchschnittliche kleine Körpergröße dieser Arten (die meisten überschreiten nicht einige Millimeter) machen es wahrscheinlich schwierig, eine Korrelation zwischen beiden Merkmalen innerhalb der Chironomidae-Familie zu finden.
Bei Insekten wurde eine weitere Korrelation zwischen Genomgröße und Entwicklungskomplexität vorgeschlagen. Während hemimetabole Insekten, mit nur allmählichen nymphalen Häutungen, eine breite Palette von Genomgrößen zeigen (C-Werte von 0,18 bis 16.93 pg) haben holometabole Insekten mit ihrer komplexen Metamorphose C-Werte, die für die meisten von ihnen innerhalb einer mutmaßlichen 2 pg-Schwelle begrenzt sind (Gregory, 2002, 2005). Der Einfluss der Entwicklungskomplexität auf die Genomgröße ist hier offensichtlich, da holometabole Insekten während der begrenzten Zeit der Metamorphose eine intensive morphologische Umgestaltung erfahren und eine kleine Genomgröße Vorteile für die Durchführung von Zellteilungen mit hoher Geschwindigkeit bietet. Chironomiden sind holometabole Insekten und ihre Metamorphose ist extrem schnell. Ihr Puppenstadium kann nur einen Tag oder bei bestimmten Arten sogar nur wenige Stunden dauern (Cranston, 1995c). Beispielsweise zeigt C. tsushimensis eine komplexe Metamorphose mit ausgeprägtem Geschlechtsdimorphismus (Abb. 1B).
Die Beziehung zwischen Genomgröße und Zellteilungsrate beeinflusst auch die Entwicklungsrate. Zum Beispiel wurde vorgeschlagen, dass der schnelle Lebenszyklus von Blattläusen mit ihren kleinen Genomgrößen zusammenhängt (Ma et al., 1992). Daher sollten kleine Genomgrößen einen Vorteil für chironomide Arten darstellen, die sich in temporären Umgebungen schnell entwickeln. Chironomiden aus der Gattung Clunio können sich zu temporären Gezeitenbecken entwickeln und zeigen auch im Verhältnis zum Mondzyklus und während des kurzen Fensters der Ebbe ein synchrones Auftauchen der Falter (Kaiser und Heckel, 2012). Um dies zu erreichen, sollte eine hohe Entwicklungsrate erforderlich sein. Beachten Sie, dass kleine Polychaeten-Anneliden, die sich in ähnlichen interstitiellen Umgebungen schnell entwickeln, kleinere Genomgrößen aufweisen als makrobenthische Arten (Gambi et al., 1997). Für antarktische Mücken, wie z. B. antarctica oder Eretmoptera murphyi (Lee et al., 2006; Worland, 2010) dauert die Larvenentwicklung zwei Jahre, meist in gefrorenem Zustand, aber Metamorphose und Fortpflanzung müssen während der sehr kurzen Sommerperiode erfolgen. In diesem Fall ist eine hohe Entwicklungsrate erforderlich, und dies kann durch das kleine Genom von B. antarctica erleichtert werden. Dieses Phänomen wurde durch eine Studie an Angiospermenpflanzen veranschaulicht, die zeigte, dass die Arten, die ihren gesamten Lebenszyklus während des kurzen antarktischen Sommers abschließen konnten, die kleinsten Genomgrößen aufwiesen (Bennett et al., 1982). Ein weiteres Extrem, die anhydrobiotische Mücke P. vanderplanki, ist an ephemere Gesteinspools angepasst. Auch hier kann eine hohe Entwicklungsrate in einem temporären Lebensraum mit der geringen Genomgröße dieser Art zusammenhängen. Allerdings ist die australische Art P. tonnoiri, die auch auf ähnlichen Gesteinspools der Austrocknung ausgesetzt ist (Jones, 1975; Adams, 1985; Frouz et al., 2003), zeigt eine relativ große Genomgröße für ein Chironomid (Abb. 3 und Tabelle 1).
Abiotische Belastungen beeinflussen wahrscheinlich auch die DNA-Integrität und damit die Genomgröße. Zum Beispiel Larven von P. vanderpianki erleben massive DNA-Schäden nach Anhydrobiose und eine effiziente DNA-Reparatur tritt in den wenigen Tagen nach der Rehydratation auf (Gusev et al., 2010). In Pflanzen wurde eine negative Korrelation zwischen Genomgröße und Strahlentoleranz gefunden (Bennett und Leitch, 2005) und die Mutationsrate war auch bei Arten mit kleinerer Genomgröße niedriger (Abrahamson et al., 1973). Folglich kann die geringe Genomgröße von P. vanderpianki einen Vorteil darstellen, um die Anhäufung schädlicher Mutationen während der DNA-Reparaturereignisse zu vermeiden, die mit Zyklen der Austrocknung und Rehydratation verbunden sind. Als Meeresart ist C. tsushimensis auch einem hohen Salzgehalt ausgesetzt, der für die meisten Insektenarten tödlich ist. Es ist bekannt, dass hoher Salzgehalt und andere abiotische Belastungen intrazelluläre reaktive Sauerstoffspezies (ROS) erzeugen, die als Hauptquelle für DNA-Schäden vorgeschlagen wurden (Franca et al., 2007; Gill und Tuteja, 2010). Dies könnte auch mit der geringen Genomgröße zusammenhängen. Andere marine und salztolerante Arten wie T. japonicus oder Chironomus salinarius zeigen jedoch keine Genomgrößen, die so klein sind wie C. tsushimensis. Säuretolerante Arten wie Chironomus sulfurosus, Chironomus acerbiphilus oder Polypedilum tamanigrum (Abb. 1C) kann in heißen Quellen mit einem pH-Wert von nur 1,4 überleben (Doi et al., 2004; Takagi et al., 2005). Auch hier konnte keine eindeutige Korrelation zwischen Toleranz gegenüber saurem Stress und geringer Genomgröße beobachtet werden und der phylogenetische Einfluss erschien wichtiger, mit kleinerer Genomgröße für die Gattung Polypedilum und größeren Genomgrößen in der Gattung Chironomus.
Zusammenfassend lässt sich sagen, dass die winzigen Genomgrößen, die bei Chironomiden beobachtet werden, wahrscheinlich das Ergebnis einer Ahnenreduktion der Anzahl transponierbarer Elemente und der Länge von Introns in ihrer Genomstruktur sind. Unter der Familie der Chironomidae unterschieden sich die Genomgrößen je nach Phylogenie auf Unterfamilienebene und auf Gattungsebene. Wie aus Korrelationen in verschiedenen Taxa hervorgeht, könnte die geringe Genomgröße von Chironomiden theoretisch eine Präadaptation an instabile und extreme Umgebungen durch hohe Entwicklungsrate und niedrige Mutationsrate darstellen. Wir hoffen, dass diese Studie zukünftige Chironomid-Genomprojekte anregen wird und dass die vergleichende Genomik innerhalb dieses Taxons dazu beitragen wird, zu verstehen, wie Chironomid-Genome mit ihrer Umgebung interagieren.