Einleitung
Die enzymatische Wirkung der Phosphodiesterase vom Typ 5 (PDE5) ist der primäre Mechanismus für die Inaktivierung von cGMP, dem nachgeschalteten Mediator des gefäßerweiternden Mittels Stickoxid (NO) (Lugnier, 2006).
Im Verlauf der erektilen Dysfunktion (ED)kann die gestörte Produktion von NO aus den endothelialen kavernösen Gefäßen pharmakologisch durch die Verwendung von PDE5-Inhibitoren (PDE5i) überwunden werden, um die cGMP-Halbwertszeit zu verlängern und die verbleibende vasodilatierende Funktion zu verbessern (Hawksworth und Burnett, 2015). Mehrere Moleküle mit inhibitorischer Aktivität auf PDE5 wurden dann projiziert und auf den Markt gebracht, was unterschiedlichen Wirkungseintritt und -dauer zeigt. Derzeit sind PDE5i die Medikamente erster Wahl zur Behandlung von ED (Mehrotra et al., 2007).
Trotz einer anerkannten Wirksamkeit bei fast 80% der nicht selektierten ED-Patienten (Eardley et al., 2010; Hatzimouratidis et al., 2010; Porst et al., 2013) wurde kürzlich über einen bemerkenswerten Abbruch der Behandlung mit PDE5I berichtet. Quantitativ wurde eine durchschnittliche Abbruchrate von 4% pro Monat berichtet, wobei die Therapie insgesamt in 50% der Fälle auf Jahresbasis abgebrochen wurde (Carvalheira et al., 2012; Corona et al., 2016). Unter den Hauptgründen, die von Patienten zur Rechtfertigung des Therapieabbruchs angegeben werden, werden die mangelnde Wirksamkeit und Nebenwirkungen als die häufigsten bezeichnet (Corona et al., 2016). Es können zwei Arten von Nebenwirkungen unterschieden werden: solche, die eng mit der PDE5-Hemmung zusammenhängen, wie Kopfschmerzen, Flushing und Dyspepsie, und solche, die mit der verbleibenden inhibitorischen Aktivität von Arzneimitteln auf andere PDE verbunden sind, wie Vasodilatation und Tachykardie (PDE1), Sehstörungen (PDE6) und Rückenschmerzen (PDE11) (Bischoff, 2004; Gupta et al., 2005). Da das Auftreten von Nebenwirkungen sowohl mit den Serumspiegeln als auch mit der zeitlichen Exposition gegenüber dem Arzneimittel zunimmt (Gupta et al., 2005; Taylor et al., 2009) kann das Sicherheits- / Wirksamkeitsprofil eines Arzneimittels alternativ durch einen pharmakokinetischen Ansatz durch das Design einer neuartigen Arzneimittelformulierung verbessert werden (Mehrotra et al., 2007). Dieser Ansatz wurde erfolgreich auf PDE5i im Fall von Vardenafil angewendet. Tatsächlich leidet dieses Molekül an einer relativ geringen Bioverfügbarkeit (∼15%, Center for Drug Evaluation and Research, 2003). Im Vergleich zur Filmtablette (FCT), der ursprünglichen Formulierung für die klassische per os-Verabreichung, erhöhte die Formulierung von orodispergierbaren Tabletten (ODT) für Vardenafil die Bioverfügbarkeit des Arzneimittels signifikant, indem sie die sublinguale Resorption begünstigte, ein Weg, der bekanntermaßen weniger vom First-Pass-Metabolismus beeinflusst wird (Heinig et al., 2011).
Sildenafil (Sild) war der erste selektive PDE5-Inhibitor, der zur Behandlung von ED zugelassen wurde (Boolell et al., 1996). Es ist ein relativ lipophiles Molekül und nach oraler Verabreichung wird die maximale Plasmakonzentration in einer Zeit von 0,5 bis 2 h erreicht. Sild zeigt eine relativ geringe orale Bioverfügbarkeit (38-41%), hauptsächlich aufgrund eines ausgedehnten Darm- und First-Pass-Metabolismus (Gupta et al., 2005). Trotz der langen Präsenz auf dem Markt, die Entwicklung neuartiger Formulierungen von Arzneimittel hat schlecht verfolgt, bis die jüngste Veröffentlichung auf dem italienischen Markt einer neuen Formulierung: die oro-dispersible Film (ODF). Tatsächlich wurde ODF als bioäquivalente Form von FCT zugelassen (Leoni et al., 2013). Oral zerfallende Formulierungen können jedoch geeignete Systeme darstellen, um die trans-mukosale und insbesondere sublinguale Resorption zu begünstigen (Kathpalia und Gupte, 2013).
In dieser Studie untersuchten wir die Sild-Pharmakokinetik im Zusammenhang mit der sublingualen Verabreichung von ODF oder ODT im Vergleich zur FCT als ursprüngliche per os-Formulierung. Zu diesem Zweck untersuchten wir das Freisetzungs- / Permeationsprofil der verschiedenen Sild-Formulierungen durch In-vitro-Systeme, die speziell zur Bewertung der trans-mukosalen Absorption von Arzneimitteln entwickelt wurden. Darüber hinaus quantifizierten wir die Serumprofile der Sild-Pharmakokinetik nach Verabreichung von per os FCT und sublingualer ODT und ODF bei Patienten mit ED.
Materialien und Methoden
Chemikalien und Arzneimittelformulierungen
Hank’s balance salts solution pH 7.4 (HBSS), HEPES solution, benzanilide und Sild citrate wurden alle von Sigma–Aldrich (Mailand, Italien) gekauft. Um störende Ergebnisse zu vermeiden, die sich aus der Verwendung alternativer bioäquivalenter Produkte auf dem Markt ergeben, wurden die folgenden Produkte verwendet: Viagra® FCT (Pfizer, Mailand, Italien), Viagra ORO® ODT (Pfizer) und Rabestrom® ODF (IBSA, Lodi, Italien). Den Patienten wurden während der ambulanten Untersuchung Medikamente für den privaten Gebrauch verschrieben. Für In-vitro-Tests und die In-vivo-Bewertung der Pharmakokinetik (siehe unten) wurden Arzneimittel speziell von an der Studie beteiligtem Personal in örtlichen Apothekeneinrichtungen gekauft und dann unter optimalen Bedingungen gehandhabt / gelagert.
Disaggregationstest
Die in vitro Disaggregationstests wurden gemäß European Pharmacopoeia (2016) mit dem Tablet Disintegration Tester (Sotax DT 2, Ergänzende Abbildung S1A) unter Verwendung von Wasser als Immersionsflüssigkeit bei 37 ± 0,5°C durchgeführt. Vollständiger Zerfall ist definiert als der Zustand, in dem ein auf dem Bildschirm der Testvorrichtung verbleibender oder an der Unterseite der Scheiben haftender Rückstand der Einheit eine weiche Masse ohne fühlbar festen Kern ist. Die Tests wurden in dreifacher Ausfertigung durchgeführt und die Ergebnisse als Mittelwert ± Standardabweichung angegeben.
Auflösungstest
In-vitro-Arzneimittelauflösungstests wurden gemäß der Europäischen Pharmakopöe durchgeführt. Die Auflösungstests wurden mit einem Paddelapparat, Paddelgeschwindigkeit 50 U / min, durchgeführt und HBSS pH 7,4 wurde als Auflösungsmediumvolumen (900 ml bei 37 ± 0,5 ° C) verwendet.
Während der Freisetzungstests wurden 2 ml Lösungsmittelprobe bei 0, 2, 4, 6, 10, 20, 30, und 40 min, entfernt und über 0,45 µm Celluloseesterfilter filtriert und damit verdünnt. Anschließend wurde die Sild-Quantifizierung mittels Hochleistungsflüssigkeitschromatographie (HPLC)-UV durchgeführt. Das entnommene Volumen wurde jedes Mal durch frisches Medium ersetzt. Die Tests wurden in dreifacher Ausfertigung durchgeführt und die Ergebnisse als Mittelwert ± Standardabweichung angegeben. Die Daten wurden auf den Wirkstoffgehalt der Formulierung normalisiert.
Trans-Mukosa-Permeationstest
Das Trans-Mukosa-Permeationsprofil von Sild wurde in vitro mit einem speziellen Gerät nach Delvadia et al. (2012) entsprechend modifiziert. Kurz gesagt, die Vorrichtung bestand aus einem vertikalen Diffusionssystem, das aus Donor–Empfänger–Kammern bestand, die durch eine Einweg-Cellulose-Acetat-Membran (Pore 0,45 µm) getrennt waren. Die Spenderzelle enthielt 1,5 ml HBSS, während die Empfängerkammer Teil eines geschlossenen Rezirkulationskreislaufs von 30 ml einschließlich der Volumina von Schlauch und Reservoir war. Die Probenahme wurde aus dem Empfängerkammerreservoir in den Zeitintervallen von durchgeführt 0, 5, 10, 20, 30, und 40 min und durch ein äquivalentes Volumen an frischem HBSS ersetzt. Die Proben wurden mittels HPLC-UV auf Wirkstoffgehalt analysiert (Fejős et al., 2014). Die Daten wurden auf die höchste permeierte Sild-Konzentration normalisiert, die für reines Sild-Citrat beobachtet wurde. Die Tests wurden in dreifacher Ausfertigung durchgeführt und die Ergebnisse als Mittelwert ± Standardabweichung angegeben.
Pharmakokinetische Studie an freiwilligen psychogenen ED-Patienten
Die Studie wurde in der Abteilung für Andrologie und Reproduktionsmedizin (Universitätsklinikum Padua, Italien) zwischen Mai und September 2017 gemäß der Erklärung von Helsinki unter Genehmigung der Ethikkommission des Universitätsklinikums Padua durchgeführt (Protokollnummer 3982 / AO / 16 und nachfolgende Änderungen). Um verwirrende Ergebnisse zu vermeiden, wurden Probanden mit psychogener ED eingeschrieben, da das geringere Auftreten organischer Störungen mit ED zusammenhängt (Ludwig und Phillips, 2014).
Die Stichprobengröße wurde berechnet, um eine Effektgröße von mindestens 0,5 mit einer statistischen Potenz von 0,8 und einem Signifikanzniveau von 0,05 für einen Dreigruppenvergleich zu erreichen (siehe Potenzrechner – Einweg-unabhängige ANOVA).
Zwanzig Patienten (Durchschnittsalter 31,4 ± 5,7 Jahre) wurden nacheinander durch die Freigabe der unterzeichneten Einwilligung nach Aufklärung aufgenommen. Die Patienten nahmen an einer ambulanten Untersuchung teil und berichteten über die anhaltende Unfähigkeit, eine Erektion für einen zufriedenstellenden Geschlechtsverkehr in den letzten 6 Monaten oder länger zu erhalten und aufrechtzuerhalten. Eine anschließende klinische Bewertung wurde bei allen Patienten durchgeführt, um das Fehlen von Krankheiten im Zusammenhang mit ED wie Diabetes mellitus, Bluthochdruck, neurologischen Störungen und der Verwendung von Antidepressiva festzustellen. Die Diagnose einer psychogenen ED wurde durch die Erfüllung eines Indexscores <26 bei der Verabreichung des Fragebogens International Index of Erectile Function-15 (IIEF-15) (Lotti et al., 2016) und die Aufrechterhaltung nächtlicher spontaner Erektionen, bewertet durch nächtliche Penistumeszenz und Rigiditätsüberwachung durch das RigiScan Plus Rigiditätsbewertungssystem (Dacomed, USA) für zwei aufeinanderfolgende Nächte wie zuvor beschrieben (Munoz et al., 1993; Caretta et al., 2005). Ausschlusskriterien waren die Diagnose von Malignomen, abnormale Hormonplasmaspiegel (jeweils luteinisierendes Hormon > 8 UI / l, Gesamttestosteron < 10,4 nmol / l, Thyrotropin > 4,5 mUI / l, Prolaktin > 20 ng / ml) und erhöhte Intima-Media-Dicke an supra-Aortenstämmen (> 0.9 mm) und/ oder kavernöse Arterien (> 0,3 mm), beurteilt durch Farbdoppler-Ultraschall wie zuvor beschrieben (Caretta et al., 2005, 2009).
Die Patienten stimmten zu, sich an eine offene Drei-Wege-Crossover-Studie mit einer Einzeldosis zu halten. Medikamentendosierungsschema wird in Abbildung 1 berichtet. Die Dosierung von Sild wurde als 50 mg gewählt, in Übereinstimmung mit früheren Berichten über die Behandlung von psychogenen ED (Banner und Anderson, 2007). Die Patienten wurden gebeten, 1 Woche vor und während der Studie keine Drogen oder Alkohol einzunehmen Verlauf der Studie. Darüber hinaus wurden die Patienten während des Tages der Medikamentendosierung gebeten, mindestens 2 h vor dem Test ein fettfreies Frühstück (keine Milch oder andere fetthaltige Lebensmittel) zu sich zu nehmen. FCT, als Referenzformulierung betrachtet, wurde klassisch per os verabreicht, indem die orale Tablette mit einem Glas Wasser geschluckt wurde. Bei ODT und ODF wurden die Patienten angewiesen, die Formulierung 15 Minuten lang ohne Wasserzufuhr unter die Zunge zu halten, gefolgt von Schlucken. Venöse Blutproben wurden in Standardröhrchen (Vacutainer, BD Biosciences, Mailand, Italien) entnommen. 0, 5, 10, 15, 30, 60, 90, 120, und 240 min nach der Verabreichung des Arzneimittels. Die Kompensation durch kontinuierliche Infusion von steriler Kochsalzlösung wurde durchgeführt. Nach der Dosierung wurden die Probanden bis zum Abschluss der Blutentnahme untergebracht. Eine zusätzliche Blutentnahme wurde bei 24 h von der Dosierung aus Kontrollgründen durchgeführt, um die vollständige Arzneimittelclearance festzustellen. Als Auswaschperioden wurden 7 Tage zwischen einer Dosierung und der folgenden zugelassen. Nach der Blutentnahme wurde das Plasma sofort isoliert und bis zur Verwendung bei -80 ° C gelagert.
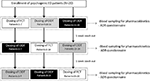
ABBILDUNG 1. Dosierungsschema und Bewertungen zur Bewertung pharmakokinetischer Parameter bei 20 Patienten mit psychogener erektiler Dysfunktion (ED), unterteilt in drei Gruppen (Patienten 1-7; Patienten 8-14; und Patienten 15-20). Jede Patientengruppe erhielt alternativ per os Filmtablette (FCT), sublinguale orodispergierbare Tablette (ODT) oder sublinguale orodispergierbare Folie (ODF) mit mindestens 1 Woche Auswaschen von jeder Dosierung. Alle Formulierungen enthielten 50 mg Sildenafil (Sild).
Während der Behandlung wurden die Patienten auch gebeten, unerwünschte Arzneimittelwirkungen (ADR) in einer speziell konzipierten Form aufzuzeichnen, die dem ADR-Meldeformular der Agenzia Italiana del Farmaco (AIFA1) angepasst ist. Eine übersetzte Version des Fragebogens steht als Ergänzungsmaterial zur Verfügung (siehe Ergänzendes Datenblatt S1). Die Patienten wurden gebeten, die Art der Nebenwirkung (en), die Gesamtintensität (in einer subjektiven Bewertungsskala von 1, sehr schwach, bis 5, sehr intensiv), den Zeitpunkt des Auftretens und die Gesamtdauer anzugeben.
Quantifizierung von Sildenafil im Humanserum
Zur Quantifizierung der Serumspiegel von Sild wurden 400 µl Serumprobe mit 500 µl Methanol, ergänzt mit dem internen Standard (IS) Benzanilid (5 µg/ml), zugegeben. Anschließend wurden 5 ml Ethylacetat zu der Mischung gegeben, die Proben zur Flüssig–Flüssig-Extraktion vortext, die beiden Phasen durch Zentrifugation getrennt. Der organische Anteil wurde dann unter Vakuumzentrifuge bei 40°C eingedampft. Der erhaltene Rückstand wurde mit 200 µl Methanol nachgelöst und schließlich für die Hochleistungsflüssigkeitschromatographie-Tandem-Massenspektrometrie (HPLC-MS/MS)-Analyse verwendet.
Hochleistungsflüssigkeitschromatographie-MS / MS-Analyse verwendete ein System Agilent-Varian 1260 und den Dreifach-Vierfachdetektor Agilent-Varian 320 MS. Die chromatographische Trennung wurde an einer Säule Phenomenex C-18 Evo 3 × 100 und einer mobilen Phase aus Acetonitril mit 0,1% Ameisensäure in Wasser mit einem Gradienten durchgeführt, der in der ergänzenden Abbildung S2A aufgeführt ist. Ein positiver Detektionsmodus wurde für den Übergang 198 > 105 Da des IS angewendet, erhalten mit einer Kapillarspannung von 40 V und einer Kollisionsenergie von 16 V, während 475 > 100 Da für Sild mit einer Kapillarspannung von 40 V bzw. einer Kollisionsenergie von 22,5 V. Repräsentative Chromatogramme des IS und Sild in realen Proben sind in der ergänzenden Abbildung S2B angegeben.
Statistische Analyse
Pharmakokinetische Parameter (PK) wie maximale Serumkonzentration (Cmax), Zeit bis zur maximalen Serumkonzentration (tmax) und Fläche unter der Kurve (AUC) zu verschiedenen Zeitpunkten wurden mit spezifischen Anwendungsroutinen mit der GraphPad-Software (La Jolla, CA, USA) berechnet. Die statistische Analyse der Daten wurde mit SPSS 21.0 für Windows (SPSS, Chicago, IL, USA) durchgeführt. Der Kolmogorov-Smirnov-Test wurde verwendet, um die Normalität der Verteilung zu überprüfen. Variablen, die keine Normalverteilung zeigen, wurden logarithmisch transformiert. Baseline-Eigenschaften von Patienten, PKs und Daten aus In-vitro–Experimenten wurden mit ungepaarten Studenten-T-Tests mit Bonferroni-Holm-Korrektur für Mehrfachvergleiche verglichen. Eine ANOVA mit wiederholten Messungen wurde durchgeführt, um Unterschiede in der Wirkstofffreisetzung und der Sild-Serumkonzentration zu testen. Levenes Test wurde verwendet, um die Homogenität der Varianz zwischen Gruppen zu testen. Wenn die Homogenität der Varianzannahme verletzt wurde, Welch-Test wurde durchgeführt und der jeweilige P-Wert wurde gemeldet. Der Anteil der ADR wurde mit χ2 exact Test verglichen. P-Werte < 0.05 wurden als statistisch signifikant angesehen.
Ergebnisse
In-vitro-Analyse der Freisetzung / Permeation von Sildenafil aus den verschiedenen Arzneimittelformulierungen
Die Dynamik der Freisetzung und Permeation von Sild aus den drei Arzneimittelformulierungen wurde zuvor in vitro untersucht (Abbildung 2). Die Zeit bis zur vollständigen Disaggregation für FCT, ODT und ODF wurde anhand eines im Europäischen Arzneibuch (2016; Abbildung 2A) beschriebenen Standardtests bewertet. ODF zeigte die höchste Zeit bis zur Disaggregation im Vergleich zu FCT und ODT (P = 0,017 bzw. P = 0,008).
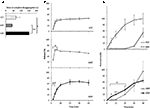
ABBILDUNG 2. In-vitro-Bewertung der biotechnologischen Eigenschaften von FCTs, ODTs und DFS mit 50 mg Sild. Die Ergebnisse sind repräsentativ für drei unabhängige Experimente und werden als Mittelwerte ± Standardabweichung angegeben. A) Ergebnisse des Disaggregationstests, wobei die Zeit (in Sekunden) bis zur vollständigen Disaggregation der Formulierung anzugeben ist. Signifikanz: ∗P < 0,05 und ∗∗P < 0,01 zwischen den angegebenen Formulierungen. (B) Ergebnisse des Auflösungstests, in denen die von jeder Formulierung freigesetzte Sild-Menge als Prozentsatz der Dosierung des Arzneimittels angegeben wird. Signifikanz: aP < 0,01 vs. FCT; bP < 0,001 vs. ODT. (C) Ergebnisse des Permeationstests (siehe Abschnitt „Materialien und Methoden“), der die Menge an Sild angibt, die durch eine Celluloseacetatmembran permeiert wird, als Prozentsatz des höchsten Wertes, der mit 50 mg reinem Sild-Pulver erreicht wurde (diskontinuierliche Linie in der oberen Tafel). Signifikanz: ∗P < 0,05 vs. ODT; ∗∗P < 0,01 vs. ODT; aP < 0,01 vs. FCT.
Um den Einfluss dieser Evidenz auf die Wirkstofffreisetzung aus der Formulierung zu bewerten, wurde ein Standardauflösungstest durchgeführt (European Pharmacopoeia, 2016; Abbildung 2B). Im Vergleich zur Referenzformulierung FCT zeigte ODT eine schnellere Freisetzung des Arzneimittels, deren maximale Ausdehnung bereits nach 2 min ab Testbeginn erreicht wurde (P = 0,006 vs. FCT). Andererseits war der Prozentsatz des Arzneimittels, das innerhalb der ersten 4 Minuten des Assays aus ODF freigesetzt wurde, im Vergleich zu FCT und ODT niedriger (P = 0,004 bzw. P < 0,001). Insbesondere zeigte ODF eine progressivere Freisetzung des Arzneimittels im Vergleich zu FCT und erreichte das maximale Ausmaß nach 20 Minuten ab Beginn des Tests.
Auf dieser Grundlage wurde die trans-mukosale Permeation von Sild aus jeder Formulierung mit einem speziell entwickelten Gerät bewertet (Abbildung 2C). Zu Referenzzwecken wurde reines Sild-Citrat, das in einem Gewicht von 50 mg Sild verwendet wurde, auf trans-mukosale Permeation untersucht und zeigte eine freie und schnelle Diffusion zwischen den beiden Kammern. Für FCT wurde ein nahezu entgegengesetztes Profil beobachtet, das eine vernachlässigbare Permeation bis 30 min nach Beginn des Tests zeigte. Die Permeationsprofile von ODT und ODF zeigten im Vergleich zu den beiden vorherigen Bedingungen ein mittleres Verhalten. Innerhalb der ersten 20 min des Assays zeigte ODF im Vergleich zu ODT ein signifikant höheres Permeationsniveau (P = 0,033 bei 5 min, P = 0,003 bei 10 min und P = 0,041 bei 20 min). Anders als bei FCT und ODT, die sich in der Donorkammer vollständig auflösten, blieb auch am Ende des Assays eine restliche weiche Geleemasse von ODF auf der Celluloseacetatmembran bestehen (ergänzende Abbildung S2C).
Differentielle Pharmakokinetik von Sildenafil
Zwanzig männliche Probanden, die von psychogener DE betroffen waren, akzeptierten alternativ FCT, ODT oder ODF, getrennt durch eine Woche Auswaschen. Wie im Abschnitt „Materialien und Methoden“ beschrieben, wurde FCT klassisch geschluckt, um die klassische per os-Verabreichung zu ermöglichen, während ODT und ODF 15 Minuten lang unter der Zunge gehalten wurden, um den sublingualen Weg zu fördern. Die klinischen Merkmale der Patienten sind in Tabelle 1 aufgeführt. Die Serumspiegel von Sild, die den drei Dosierungsbedingungen entsprechen, sind in Abbildung 3 angegeben. Eine beträchtliche Variabilität zeigte das Arzneimittelserumprofil der drei Formulierungen. Im Vergleich zu FCT zeigte ODT einen offensichtlichen frühen Anstieg der Sild-Serumspiegel; Dieser Trend war jedoch statistisch nicht signifikant. Andererseits wurde für die ODT-Formulierung ein schnellerer Abfall der Sild-Spiegel nach 120 und 240 Minuten nach der Dosierung beobachtet (P = 0,044 bzw. P = 0,024 vs. FCT).
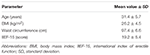
TABELLE 1. Klinische Merkmale der Studienteilnehmer (N = 20).
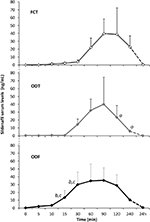
ABBILDUNG 3. In-vivo-Bewertung der Serumspiegel von Sild bei 20 Patienten, die von psychogener ED betroffen waren und alternativ entweder die FCT per os oder die sublinguale ODT oder die sublinguale ODF erhielten, wie im Abschnitt „Materialien und Methoden.“ Die Daten werden als Mittelwerte ± Standardabweichungswert angegeben: aP < 0,05 vs. FCT; bP < 0,01 vs. FCT; cP < 0,05 vs. ODT.
Das Arzneimittelserumprofil der ODF-Formulierung zeigte einen schnelleren Anstieg der Sild-Spiegel im Vergleich zu FCT (P = 0,001 und P = 0,003) und ODT (P = 0,048 und P = 0,041) jeweils 15 und 30 Minuten nach der Dosierung. In Übereinstimmung mit seiner langsamen Disaggregationszeit in vitro (Abbildung 2B) war die mittlere Konzentrations–Zeit-Kurve von ODF in vivo glatter als die von FCT und ODT (Abbildung 3).
Die pharmakokinetischen Parameter der drei Formulierungen, die aus der Analyse der Sild-Serumspiegel gewonnen wurden, sind in Tabelle 2 zusammengefasst. Obwohl zwischen den drei Formulierungen kein signifikanter Unterschied in Bezug auf Cmax, tmax und AUC0-240 min beobachtet wurde, zeigte ODF den niedrigsten Wert von Cmax (38,2 ± 23,7 ng / ml) und den kürzesten tmax (70,0 ± 24,5 min). Insbesondere zeigte ODF einen signifikant höheren Wert der AUC0-60 min im Vergleich zu FCT und ODT (P = 0,005 bzw. P = 0.043), was zu einer erhöhten relativen Bioverfügbarkeit von Sild innerhalb der ersten Stunde nach der sublingualen Verabreichung von ODF führt.

TABELLE 2. Pharmakokinetische Parameter von Sildenafil-Formulierungen.
Nebenwirkungen
Die Ergebnisse des selbstverwalteten Fragebogens zu Art und Merkmalen der Nebenwirkungen der Studienteilnehmer sind in Tabelle 3 zusammengefasst. Unter den bekannten ADR für Sild berichtet (Taylor et al., 2009) wurden am häufigsten Kopfschmerzen, Hitzewallungen und verstopfte Nase aufgezeichnet. Ein Patient berichtete über niedriggradige Muskelschmerzen (Grad 1 auf der subjektiven Bewertungsskala) nach der Gabe von FCT. Keiner der Patienten berichtete über Sehstörungen, Tachykardie, Schwäche oder Hörstörungen.

TABELLE 3. Von den Studienteilnehmern aufgezeichnete Nebenwirkungen (N = 20).
Im Vergleich zu FCT als Referenzformulierung zeigte ODT eine unveränderte Prävalenz von UAW. Die persönliche Wahrnehmung der Spülintensität war jedoch signifikant geringer (P = 0,031). Auf der anderen Seite zeigte ODF eine reduzierte Prävalenz von Kopfschmerzen im Vergleich zu FCT (P = 0,043). Darüber hinaus wurden Dauer und Intensität der Spülung und der verstopften Nase im Vergleich zu FCT (P = 0,011 bzw. P = 0,015) und ODT (P = 0,026 bzw. P = 0,037) auf niedrigeren Ebenen wahrgenommen.
In dieser Studie belegen wir, dass der sublinguale Weg der Sild-Verabreichung mit einer erhöhten frühen Arzneimittelbioverfügbarkeit und einem verbesserten Verträglichkeitsprofil verbunden ist. Diese Evidenz wird sowohl durch In-vitro-Untersuchungen gestützt, die zeigen, dass sich die Sild-Formulierung durch eine längere Zeit bis zur Disaggregation auszeichnet, aber die trans-mukosale Absorption signifikant begünstigt, als auch durch In-vivo-Evidenz.
Phosphodiesterase-Inhibitoren sind die erste Wahl therapeutische Option für die Behandlung von ED; Nebenwirkungen Bei Patienten werden jedoch als der häufigste Grund für den Abbruch der Therapie anerkannt (Corona et al., 2016). Die Modifikation der Pharmakokinetik durch das Design neuartiger Arzneimittelformulierungen kann eine attraktive Strategie zur Verbesserung des Sicherheits- / Wirksamkeitsprofils des Arzneimittels selbst darstellen (Mehrotra et al., 2007). In diesem Zusammenhang ermöglichte das Auslaufen des Patents für Sild-Citrat in mehreren europäischen Ländern im Jahr 2013 die Freigabe einer Reihe neuer Sild-Formulierungen. Es ist zu beachten, dass die meisten der heute auf dem Markt erhältlichen Sild-Formulierungen tatsächlich als bioäquivalente Formen des ursprünglichen FCT zugelassen sind (Leoni et al., 2013). Interessanterweise wurden oral zerfallende Formulierungen entwickelt, die sich durch schnelle Disaggregation im Mund des Patienten auszeichnen, ohne dass Wasser geschluckt werden muss (Goel et al., 2008). Diese neuen Formulierungen finden eine verbesserte Compliance in jenen Populationen von Patienten mit Schwierigkeiten beim Schlucken herkömmlicher fester Dosierungen, wie Kinder, geriatrische Patienten und dysphagische Patienten. Darüber hinaus können oral zerfallende Formulierungen durch die Bereitstellung einer höheren oralen Arzneimittelverfügbarkeit wertvolle Systeme darstellen, um die trans-mukosale und insbesondere sublinguale Absorption zu begünstigen (Kathpalia und Gupte, 2013). Insbesondere in Italien sind zwei oral zerfallende Formulierungen von Sild offiziell in Apothekeneinrichtungen erhältlich: die ODTs und die ODFs.
In dieser Studie wollten wir die möglichen pharmakokinetischen Variationen und das entsprechende Muster der UAW bewerten, die sich aus der Begünstigung der trans-mukosalen Resorption von Sild durch die sublinguale Verabreichung der beiden verfügbaren oral auflösenden Formulierungen des Arzneimittels ergeben. Die Ergebnisse wurden mit der ursprünglichen Formulierung von Sild, nämlich dem FCTs, verglichen. Interessanterweise fanden wir sowohl in vitro als auch in vitro eine strikte Korrelation zwischen den biotechnologischen Eigenschaften und den PKs der verschiedenen Formulierungen. Insbesondere zeichnete sich ODF trotz gleicher Wirkstoffdosis (50 mg) und leicht reduzierter Wirkstofffreisetzungsrate im Auflösungstest einerseits durch eine längere Zeit bis zur Disaggregation und eine höhere Permeationsrate im trans-mukosalen Modell und andererseits durch eine erhöhte Wirkstoffbio-Verfügbarkeit innerhalb der ersten Stunde nach der Dosierung aus. Wir könnten dann die Hypothese aufstellen, dass die sublinguale Sild-Absorption durch einen längeren Kontakt zwischen Arzneimittel und Schleimhaut begünstigt wird. In der Tat wird dieses Phänomen im Allgemeinen für orale trans-mukosale Arzneimittel verfolgt, bei denen die Verwendung von mukoadhäsiven Polymeren empfohlen wird, um einen längeren Kontakt zwischen der Formulierung und der Mundschleimhaut sicherzustellen (Lam et al., 2014), insbesondere von Arzneimitteln wie Sild, die von einer geringen Wasserlöslichkeit betroffen sind (Zayed et al., 2012; Sun et al., 2014). Diese vorläufigen Ergebnisse deuten auch auf eine mögliche Verbesserung der klinischen Wirksamkeit dieser Arzneimittelklasse im Vergleich zu Originalformulierungen hin. Weitere Studien sind erforderlich, um diese Aspekte zu klären.
Der auffälligste Beweis der vorliegenden Studie ist eine signifikante Verringerung der Nebenwirkungen der sublingualen Verabreichung von ODF im Vergleich zu ODT und FCT bei gleicher Dosierung, was wiederum zu einer erhöhten Compliance der Patienten führen kann. Diese Evidenz kann im Lichte des Prinzips interpretiert werden, dass die Inzidenz einer Arzneimittelnebenwirkung durch Erhöhung der Serumspiegel und der Expositionszeit gegenüber dem Arzneimittel selbst zunimmt (Gupta et al., 2005; Taylor et al., 2009). Trotz einer im Vergleich zu den anderen analysierten Formulierungen unveränderten globalen Bioverfügbarkeit zeigte die sublinguale Verabreichung von ODF einen niedrigeren Wert von Cmax und eine kürzere tmax, was zu einem signifikant höheren Anteil an Sild-Bioverfügbarkeit innerhalb der ersten Stunde nach der Dosierung führte. Daher könnten wir spekulieren, dass die sublinguale Verabreichung von ODF eine effiziente Absorption des Arzneimittels mit dem Erreichen von durchschnittlich niedrigeren Serumspiegeln von Sild und einem daraus resultierenden geringeren Risiko für UAWs kombiniert. Wir erkennen jedoch die geringe Stichprobengröße als Hauptnachteil der Studie an. Weitere Untersuchungen an größeren Kohorten und mit unterschiedlichen Dosierungen sind erforderlich, um dieses Problem zu bestätigen.
Zusammenfassend berichten wir in dieser Studie, dass die sublinguale Verabreichung von Sild ODF das Arzneimittelverträglichkeitsprofil durch die wahrscheinliche Beteiligung einer modifizierten Pharmakokinetik im Vergleich zu herkömmlichen FCTs verbessert. Obwohl ODF ursprünglich nicht für diese Zwecke konzipiert wurde, stellt dies eine attraktive Strategie dar, um die Therapietreue des Patienten zu verbessern. Wir entwickeln weitere Vergleichsstudien, um die klinische Wirksamkeit bei psychogenen und organischen ED-Patienten zu bewerten.
Autorenbeiträge
LDT und CF koordinierten die Studie und entwarfen das Manuskript. MDRP bewertete und schrieb die Patienten ein. EF führte eine In-vitro-Analyse durch. SDA führte die Serumanalyse durch. RP führte den pharmakokinetischen Vergleich durch. RP, NR und AG überarbeiteten und finalisierten das Manuskript kritisch.
Interessenkonflikterklärung
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken Dr. Alberto Barosso, Dr. Giuseppe Maggioni und Dr. Dimitri Portale für die Patientenberatung, Dr. Flavia Rosano und Dr. Alice Passadore für die Patientenverwaltung und allen Mitarbeitern der Abteilung für Andrologie und Reproduktionsmedizin.
Ergänzungsmaterial
Das Ergänzungsmaterial zu diesem Artikel finden Sie online unter: https://www.frontiersin.org/articles/10.3389/fphar.2018.00059/full#supplementary-material
ABBILDUNG S1 / Repräsentative Bilder des Tablettenzerfallsprüfgeräts (A) und des Auflösungsgeräts (B), die für den Auflösungstest bzw. den Auflösungstest verwendet werden.
ABBILDUNG S2 / (A) Einzelheiten des mobilen Phasengradienten, der für die Hochleistungsflüssigkeitschromatographie-Tandem-Massenspektrometrie (HPLC-MS / MS) -Analyse der Serumspiegel von Sildenafil (Sild) verwendet wird. Es werden repräsentative Chromatogramme und Massenspektren beider Sild am internen Standardbenzanilid in realen Proben berichtet (B). (C) Repräsentatives Bild des verbleibenden orodispergierbaren Films (hervorgehoben durch eine diskontinuierliche Linie), der nach dem Permeationstest in der Vorrichtung, die für die In-vitro-Schätzung der trans-mukosalen Absorption durch eine Celluloseacetatmembran verwendet wird, erhalten bleibt.
DATENBLATT S1 / Fragebogen zu Nebenwirkungen.
Fußnote
- ^http://www.aifa.gov.it/en/content/reporting-adverse-reaction
Banner, LLUND Anderson, RU (2007). Integrierte Sildenafil- und kognitive Verhaltenssex-Therapie für psychogene erektile Dysfunktion: eine Pilotstudie. J. Geschlecht. Med. 4, 1117–1125. doi: 10.1111/j.1743-6109.2007.00535.x
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Bischoff, E. (2004). Potenz, Selektivität und Folgen der Nichtselektivität der PDE-Hemmung. Int. In: J. Impot. In: Res. Suppl. 1, S11-S14. doi: 10.1038/sj.ijir.3901208
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Boolell, M., Allen, M. J., Ballard, S. A., Gepi-Attee, S., Muirhead, G. J., Naylor, A. M., et al. (1996). Sildenafil: ein oral wirksamer zyklischer GMP-spezifischer Phosphodiesterasehemmer vom Typ 5 zur Behandlung der erektilen Dysfunktion des Penis. Int. In: J. Impot. Entschließung 8, 47-52.
PubMed Zusammenfassung / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Caretta, N., Palego, P., Ferlin, A., Bettella, A., Selice, R., et al. (2005). Wiederaufnahme spontaner Erektionen bei ausgewählten Patienten, die von erektiler Dysfunktion und verschiedenen Graden der Karotiswandveränderung betroffen sind: Rolle von Tadalafil. EUR. Urol. 48, 326–331. doi: 10.1016/j.eururo.2005.01.013
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Caretta, N., Palego, P., Schipilliti, M., Ferlin, A., Di Mambro, A. und Foresta, C. (2009). Kavernöse Arterie Intima-Media-Dicke: ein neuer Parameter in der Diagnose der vaskulären erektilen Dysfunktion. J. Geschlecht. Med. 6, 1117–1126. doi: 10.1111/j.1743-6109.2008.01112.x
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Carvalheira, A. A., Pereira, N. M., Maroco, J. und Forjaz, V. (2012). Dropout bei der Behandlung der erektilen Dysfunktion mit PDE5: eine Studie über Prädiktoren und eine qualitative Analyse der Gründe für das Absetzen. J. Geschlecht. Med. 9, 2361–2369. doi: 10.1111/j.1743-6109.2012.02787.x
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Zentrum für Arzneimittelbewertung und -forschung (2003). NDA 021400 Levitra (Vardenafil Hydrochlorid) Tabletten: In: Clinical Pharmacology/ Biopharmaceutics Review. Rockville, Md: Ministerium für Gesundheit und menschliche Dienste. Silver Spring, MD: Lebensmittel- und Arzneimittelbehörde.
Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitationen Corona, G., Rastrelli, G., Burri, A., Serra, E., Mannucci, E., et al. (2016). Phosphodiesterase-Typ-5-Inhibitoren der ersten Generation Dropout: eine umfassende Überprüfung und Metaanalyse. Andrologie 4, 1002-1009. Ursprungsbezeichnung: 10.1111/andr.12255
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Delvadia, P. R., Barr, W. H., und Karnes, H. T. (2012). A biorelevant in vitro release/permeation system for oral transmucosal dosage forms. Int. J. Pharm. 430, 104–113. doi: 10.1016/j.ijpharm.2012.03.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Eardley, I., Donatucci, C., Corbin, J., El-Meliegy, A., Hatzimouratidis, K., McVary, K., et al. (2010). Pharmacotherapy for erectile dysfunction. J. Sex. Med. 7, 524–540. doi: 10.1111/j.1743-6109.2009.01627.x
PubMed Abstract | CrossRef Full Text | Google Scholar
European Pharmacopoeia (2016). Europäische Direktion für die Qualität von Arzneimitteln &Gesundheitswesen (EDQM), 9. Aufl. Straßburg: Europarat.
Google Scholar
Fejős, I., Neumajer, G., Béni, S. und Jankovics, P. (2014). Qualitative und quantitative Analyse von PDE-5-Hemmern in gefälschten Arzneimitteln und Nahrungsergänzungsmitteln durch HPLC-UV unter Verwendung von Sildenafil als alleinige Referenz. In: J. Pharm. Biomed. Anal. 98, 327–333. ursprungsbezeichnung: 10.1016/j.jpba.2014.06.010
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Goel, H., Rai, P., Rana, V., und Tiwary, A. K. (2008). Oral desintegrierende Systeme: Innovationen in Formulierung und Technologie. Aktuelle Pat. Drogen Deliv. In: Formul. 2, 258–274. doi: 10.2174/187221108786241660
CrossRef Volltext / Google Scholar
Gupta, M., Kovar, A. und Meibohm, B. (2005). Die klinische Pharmakokinetik von Phosphodiesterase-5-Hemmern bei erektiler Dysfunktion. J. Clin. Pharmacol. 45, 987–1003. doi: 10.1177/0091270005276847
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Hatzimouratidis, K., Amar, E., Eardley, I., Giuliano, F., Hatzichristou, D., Montorsi, F., et al. (2010). Europäische Vereinigung für Urologie. Richtlinien zur männlichen sexuellen Dysfunktion: erektile Dysfunktion und vorzeitige Ejakulation. EUR. Urol. 57, 804–814. doi: 10.1016/j.eururo.2010.02.020
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Hawksworth, D. J. und Burnett, A. L. (2015). Pharmakotherapeutische Behandlung der erektilen Dysfunktion. Clin. Pharmacol. Ther. 98, 602–610. zertifikate: 10.1002/cpt.261
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Heinig, R., Weimann, B., Dietrich, H., und Böttcher, M. F. (2011). Pharmakokinetik einer neuen Schmelztablettenformulierung von Vardenafil: Ergebnisse von drei klinischen Studien. Clin. Drug Investig. 31, 27–41. doi: 10.2165/11584950-000000000-00000
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Kathpalia, H. und Gupte, A. (2013). Eine Einführung in schnell auflösende orale Dünnfilm-Drug-Delivery-Systeme: eine Überprüfung. Curr. Drogen Deliv. 10, 667–684. doi: 10.2174/156720181006131125150249
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Lam, JK, Xu, Y., Worsley, A. und Wong, IC (2014). Orale transmukosale Arzneimittelabgabe für die pädiatrische Anwendung. Adv. Drug Deliv. Offenbarung 73, 50-62. doi: 10.1016/j.addr.2013.08.011
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Leoni, L. A., Leite, G. S., Wichi, R. B. und Rodrigues, B. (2013). Sildenafil: zwei Jahrzehnte Nutzen oder Risiken? Altern Männlich 16, 85-91. geburtsdatum: 10.3109/13685538.2013.801952
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Lotti, F., Corona, G., Castellini, G., Maseroli, E., Cozzolino, M., et al. (2016). Eine Beeinträchtigung der Samenqualität ist je nach Schweregrad mit einer sexuellen Dysfunktion verbunden. Summen. Reprod. 31, 2668–2680. doi: 10.1093/humrep/dew246
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Ludwig, W. und Phillips, M. (2014). Organische Ursachen der erektilen Dysfunktion bei Männern unter 40 Jahren. Urol. Int. 92, 1–6. doi: 10.1159/000354931
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Lugner, C. (2006). Zyklische Nukleotidphosphodiesterase (PDE) -Superfamilie: ein neues Ziel für die Entwicklung spezifischer Therapeutika. Pharmacol. Ther. 109, 366–398. doi: 10.1016/j.pharmthera.2005.07.003
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Mehrotra, N., Gupta, M., Kovar, A. und Meibohm, B. (2007). Die Rolle der Pharmakokinetik und Pharmakodynamik in der Phosphodiesterase-5-Inhibitor-Therapie. Int. In: J. Impot. 19, 253-264. Ursprungsbezeichnung: 10.1038/sj.ijir.3901522
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Munoz, M., Bancroft, J. und Marshall, I. (1993). Die Leistung des Rigiscan bei der Messung von Penis Tumeszenz und Steifigkeit. Int. In: J. Impot. Entschließung 5, 69-76.
Google Scholar
Porst, H., Burnett, A., Brock, G., Ghanem, H., Giuliano, F., Glina, S., et al. (2013). Das ISSM Standards Committee für Sexualmedizin. SOP konservative (medizinische und mechanische) Behandlung der erektilen Dysfunktion. J. Geschlecht. Med. 10, 130–171. doi: 10.1111/jsm.12023
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
In diesem Fall ist die Verwendung von Cookies verboten. (2014). Verbesserte orale Absorption und therapeutische Wirkung von Acetylpuerarin basierend auf D-α-Tocopheryl-Polyethylenglykol 1000 Succinat-Nanoemulsionen. Int. J. Nanomedizin 9, 3413-3423. doi: 10.2147/IJN.S63777
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Taylor, J., Baldo, OB, Storey, A., Cartledge, J. und Eardley, I. (2009). Unterschiede in der Nebenwirkungsdauer und den damit verbundenen Serumspiegeln zwischen Phosphodiesterase-Typ-5-Inhibitoren. BJU Int. 103, 1392–1395. Ursprungsbezeichnung: 10.1111/j.1464-410X.2008.08328.x
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Zayed, R., Kamel, A. O., Shukr, M. und El-Shamy, A. H. (2012). Eine In-vitro- und In-vivo-Vergleichsstudie mit direkt komprimierten festen Dispersionen und gefriergetrockneten Sildenafilcitrat-Sublingualtabletten zur Behandlung der pulmonalen arteriellen Hypertonie. Acta Pharm. 62, 411–432. doi: 10.2478/v10007-012-0027-9
PubMed Abstract | CrossRef Full Text | Google Scholar