Die Addition eines Kohlenhydratanteils an ein Proteinmolekül wird als Proteinglykosylierung bezeichnet. Es ist eine häufige posttranslationale Modifikation für Proteinmoleküle, die an der Zellmembranbildung beteiligt sind. Während dieses Prozesses bildet die Verknüpfung von Monosaccharideinheiten mit den Aminosäureketten die Bühne für eine Reihe enzymatischer Reaktionen, die zur Bildung von Glykoproteinen führen (n- und o-verknüpfte Oligosaccharide, die an eine Proteinentität gebunden sind). Insgesamt 16 bekannte Enzyme sollen diese Reaktion vermitteln. Ein typisches Glykoprotein hat mindestens 41 Bindungen, an denen 8 Aminosäuren und 13 verschiedene Monosaccharideinheiten beteiligt sind, und umfasst die Glykophosphatidylinositol- (GPI) und Phosphoglycosyl-Verknüpfungen. Die Proteinglykosylierung hilft bei der richtigen Faltung von Proteinen, der Stabilität und der Adhäsion von Zelle zu Zelle, die üblicherweise von Zellen des Immunsystems benötigt wird. Die Hauptstellen der Proteinglykosylierung im Körper sind ER, Golgi-Körper, Zellkern und die Zellflüssigkeit.
Die Proteinglykosylierung kann in zwei Haupttypen eingeteilt werden:
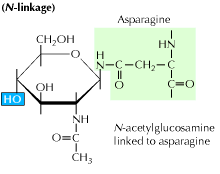 a) N-verknüpfte Glykosylierung: Sie beginnt mit der Zugabe eines 14-Zucker-Vorläufers zu einer Asparagin-Aminosäure. Es enthält Glucose-, Mannose- und n-Acetylglucosaminmoleküle. Diese Entität wird dann an das ER-Lumen übertragen. Das Oligosaccharyltransferase-Enzym bindet die Oligosaccharidkette an Asparagin, das in der Tripeptidsequenz Asn-X-Ser oder Asn-X-Thr vorkommt. X kann jede andere Aminosäure als Prolin sein. Die an Oligosaccharid gebundene Proteinsequenz faltet sich nun korrekt und wird nun in den Golgi-Körper transloziert, wo der Mannoserest entfernt wird.
a) N-verknüpfte Glykosylierung: Sie beginnt mit der Zugabe eines 14-Zucker-Vorläufers zu einer Asparagin-Aminosäure. Es enthält Glucose-, Mannose- und n-Acetylglucosaminmoleküle. Diese Entität wird dann an das ER-Lumen übertragen. Das Oligosaccharyltransferase-Enzym bindet die Oligosaccharidkette an Asparagin, das in der Tripeptidsequenz Asn-X-Ser oder Asn-X-Thr vorkommt. X kann jede andere Aminosäure als Prolin sein. Die an Oligosaccharid gebundene Proteinsequenz faltet sich nun korrekt und wird nun in den Golgi-Körper transloziert, wo der Mannoserest entfernt wird.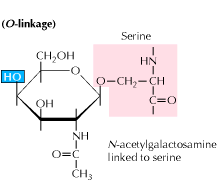
b) O-gebundene Glykosylierung: Die Glykosylierung beginnt mit einer enzymvermittelten Addition von N-Acetyl-Galactosamin, gefolgt von anderen Kohlenhydraten an Serin- oder Threoninreste. Studien zeigen, dass die O-Glykosylierung zu einem späteren Zeitpunkt der Proteinverarbeitung erfolgt.