proteiinin käsittelyn lisäksi ER ja Golgi huolehtivat myös tietyntyyppisestä proteiinin kuljetuksesta. Vesikkelit (kalvoon sidotut kuplat, lähinnä) nipistävät irti ER: stä, Golgista ja muista kalvomaisista organelleista ja kuljettavat mukanaan mitä tahansa liukoisia molekyylejä, jotka olivat suljetun nesteen sisällä, sekä kaikki molekyylit, jotka oli upotettu kyseiseen kalvon osaan. Nämä rakkulat saavat sitten kyytiä molekyylimoottorilla, kuten kinesiinillä tai myosiinilla, ja kulkevat sytoskeletonia pitkin, kunnes ne telakoituvat sopivaan määränpäähän ja sulautuvat kohdekalvoon tai organelliin. Yleensä vesikkelit siirtyvät ER: stä CIS Golgiin, cis: stä mediaaliseen Golgiin, mediaalista Trans Golgiin ja trans Golgista plasmakalvoon tai muihin lokeroihin. Vaikka suurin osa liikkeistä on tähän suuntaan, on myös rakkuloita, jotka siirtyvät Golgilta takaisin ensiapuun kuljettaen proteiineja, joiden piti jäädä ensiapuun (esim. PDI) ja ne kauhottiin vahingossa vesikkelin sisään.
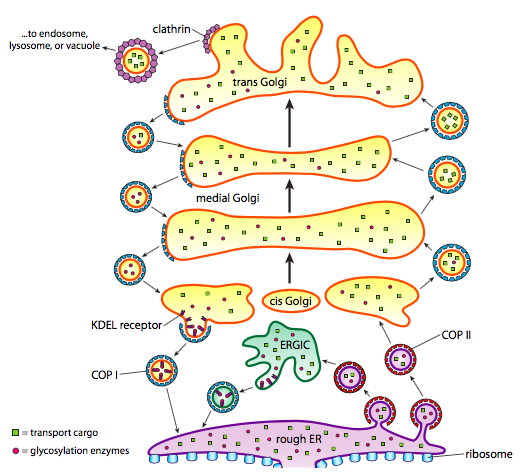
vesikkelien muodostuminen riippuu turkinproteiineista, jotka sopivissa olosuhteissa kasautuvat itsestään pallomaisiksi häkeiksi. Kun ne yhdistetään transmembraaniproteiineihin, ne voivat vetää kiinni olevan kalvon myös pallomaiseen muotoon. Rakkuloiden muodostumisessa käytettävät tärkeimmät turkkiproteiinityypit ovat COPII, COPI ja klatriini.
COPII-päällysteproteiinit muodostavat rakkuloita, jotka siirtyvät ER: stä Golgiin. COPI coat-proteiineja käytetään Golgi-laitteen osien välillä sekä muodostamaan rakkuloita, jotka kulkevat Golgilta takaisin ensiapuun. Lopuksi klatriinia käytetään muodostamaan golgista lähteviä rakkuloita plasmakalvolle sekä plasmakalvosta muodostuvia rakkuloita endosytoosia varten.
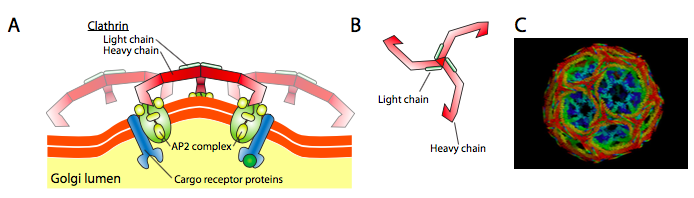
Klatriini (Kuva \(\PageIndex{17}\)) on kolmesta parhaiten kuvattu, ja vesikulaarikuoret on tehty klatriinin triskelionien asetelmista (Kreikasta, joka tarkoittaa kolmijalkaista). Jokainen triskelion koostuu kolmesta raskaasta ketjusta, jotka on liitetty yhteen C-päätepisteessä, ja kolmesta kevyestä ketjusta, joista yksi liittyy jokaiseen raskaaseen ketjuun. Eri triskelionien raskaat ketjut vuorovaikuttavat raskaiden ketjujensa ”jalkojen” pituudessa muodostaen erittäin tukevan rakenteen. Valoketjut ovat tarpeettomia rakkuloiden muodostumiselle, ja niiden arvellaan auttavan estämään klatriinimolekyylien tahattomia vuorovaikutuksia sytoplasmassa.
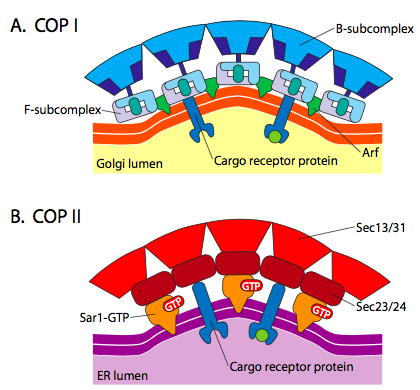
vesikkelin muodostusmekanismit, joissa käytetään näitä eri päällysteproteiineja, ovat merkittävästi samankaltaiset, alkaen arf1: n (ARF tarkoittaa ADP-ribosylaatiotekijää, jolla ei ole mitään tekemistä sen toiminnan kanssa tässä) rekrytoinnista kalvoon. Tämä edellyttää GTP: n Arno-helpotteista vaihtoa BKT: hen (ARNO on ARF-nukleotidisitoutumispaikan avaaja). Kun ARF1 on sitoutunut GTP: hen, konformaatiomuutos paljastaa n-terminaalisen myristoyyliryhmän, joka kiinnittyy kalvoon. Sekä COPI – että klatriinipinnoitetuissa vesikkeleissä käytetään ARF1: tä ja ARNO: ta, mutta COPII käyttää samanlaisia proteiineja, joita kutsutaan Sar1p: ksi ja Sec12p: ksi.
Kuva \(\PageIndex{18}\). Kopilla päällystettyjä vesikkeleitä
ARF1: tä (tai Sar1p: tä) käytetään värittämään adapteriproteiineja, jotka sitoutuvat kalvoon sitoutuneiden reseptoriproteiinien ”häntäpäähän”. Näiden reseptorien liikepää sitoutuu car-go-molekyyleihin, jotka on pakattava vesikkeliin. Adapteriproteiinit toimivat linkkinä kalvon (reseptorien kautta) ja päällysteproteiinien välillä. Klatriinin adapteriproteiinit ovat AP1 trans-Golgista johdetuille vesikkeleille ja AP2 endosyyttisille vesikkeleille. COPI-vesikkeleille likimääräiset homologiat ovat β-, γ-, δ – Ja ζ – COPs kun taas COPII – järjestelmässä käytetään Sec23p: tä ja Sec24p: tä.
lopuksi adapterit linkittyvät varsinaisiin päällysteproteiineihin: klatriini, α-tai ε-COP, Sec13p ja Sec31p. yhteistä näille proteiineille on, että spontaanisti (ts. ilman energiamenovaatimuksia), ne kokoontuvat itse häkkimäisiksi pallomaisiksi rakenteiksi. Elektronimikroskoopissa klatriinipäällysteiset vesikkelit ovat terävämmin määriteltyjä ja klatriinialayksiköiden rajaamat heksagonaaliset ja viisikulmaiset muodot antavat vesikkelille ”futispallon” ilmeen. COP coatamer-päällysteiset rakkulat ovat emin alla ulkonäöltään paljon pörröisempiä.
kaikilla kolmella vesikkeliturkkiproteiinityypillä on kyky spontaanisti yhtyä pallomaiseksi rakenteeksi, mutta vain Kopi-ja KOPIIPÄÄLLYSTEINEN vesikkeli myös spontaanisti ”nipistää” kalvon irti vapauttaakseen vesikkelin sen alkukalvosta. Klatriinipäällysteiset vesikkelit vaativat ulkoisen mekanismin vesikkelin vapauttamiseksi (Kuva \(\PageIndex{19}\)).
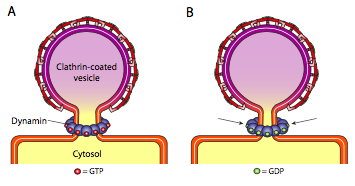
kun vesikkeli on lähes valmis, jäljellä on vielä pieni kalvomainen varsi tai kaula, joka yhdistää vesikkelin kalvoon. Tämän varren ympärillä dynaamiset GTP-molekyylit muodostavat renkaan / spiraalin rakenteen. Dynamiinimolekyylit ovat pallomaisia Gtpaaseja, jotka supistuvat GTP: n hydrolyysin yhteydessä. Kun ne yhtyvät vesikkelin varren ympärille, kukin dynamiiniproteiini supistuu siten, että se supistaa vartta niin paljon, että kalvo puristuu yhteen, sulkee vesikkelin pois ja vapauttaa sen siitä peräisin olevasta kalvosta.
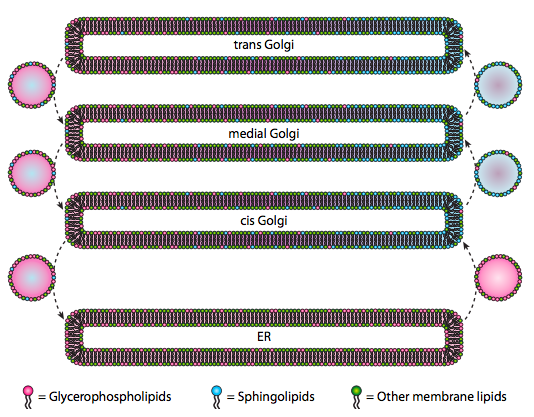
vaikka lipidejä ja kalvoja käsiteltiin luvussa 4, emme käsitelleet niiden syntetisointien sijaintia eukaryooteissa. Kuten kuva \(\PageIndex{20}\) osoittaa, tiettyjen lipidityyppien synteesi on segregoitu ja eksklusiivinen. Glyserofosfolipidejä muodostuu pääasiassa endoplasmaisessa retikulumissa, joskin niitä muodostuu myös mitokondrioissa ja peroksisomeissa. Sen sijaan sfingolipidejä ei valmisteta ER: ssä (vaikka niiden seramidin esiasteet ovat) nisäkkäillä, tarvittavat entsyymit löytyvät cis: n ja mediaalisen Golgin lumenista. On todisteita anterogradisesta ja retrogradisesta vesikulaariliikenteestä eri Golgi-ja ER-osastojen välillä, mikä teoriassa viittaisi lipidityyppien uudelleenjakautumiseen. Sfingolipidit kuitenkin kasautuvat yleensä lipidilautoiksi ja näyttävät keskittyvän enemmän anterogradisesti liikkuviin vesikkeleihin.
karvaproteiinit irtoavat pian vesikulaarisen vapautumisen jälkeen. Klatriinin osalta prosessissa on mukana Hsc70, ATPaasi. COPI-tai COPII-pinnoitettujen vesikkelien osalta GTP: n hydrolyysi ARF/Sar1p: llä näyttää kuitenkin heikentävän päällysteproteiinin affiniteettia adaptereihin ja käynnistää päällystämisen. GTPase-aktivaattori on ARF GAP (tai Sec23p) ja se on olennainen osa COP I (tai II) – kerrosta.
vesikkeleissä on kaksi lastiluokkaa: liukoiset proteiinit ja transmembraaniproteiinit. Liukoisista proteiineista osa kulkeutuu rakkulaan sen vuoksi, että ne sitoutuvat reseptoriin. Muita proteiineja vain sattuu olemaan lähistöllä ja ne kauhotaan ylös vesikkelin muodostuessa. Silloin tällöin otetaan proteiinia, jota ei pitänyt olla; esimerkiksi PDI voi olla suljettuna ER: stä muodostuvaan rakkulaan. Sillä ei ole juurikaan tehtävää Golgissa, ja sitä tarvitaan ensiavussa, joten mitä sille tapahtuu? Onneksi PDI: llä ja monilla muilla ER-proteiineilla on C-terminaalinen signaalijakso, KDEL (lysiini-asparagiinihappo-glutamiinihappo-leusiini), joka huutaa ”kuulun ER: ään.”Tämän sekvenssin tunnistaa Golgin sisällä olevista kdel-reseptoreista, ja kdel-proteiinien sitoutuminen reseptoreihin laukaisee vesikkelin muodostumisen ja lähettää ne takaisin ER: lle.
Eritysrakkuloissa on erityinen liukoisen lastin ongelma. Jos rakkula luottaisi vain siihen, että sen sisällä on muodostumisprosessin aikana proteiineja, olisi vaikea saada suuria pitoisuuksia näistä proteiineista. Eliö tarvitsee monia erittämiään proteiineja nopeasti ja merkittäviä määriä,joten trans Golgissa on mekanismi erittämisproteiinien kokoamiseksi. Mekanismissa käytetään aggregoituvia proteiineja, kuten sekretograniini II: ta ja kromograniini B: tä, jotka kokoavat kohdeproteiinit suuriksi tiivistetyiksi rakeiksi. Nämä graniinit toimivat parhaiten matalan pH: n ja korkean Ca2+: n Trans Golgi-ympäristössä, joten kun vesikkeli vapauttaa sisältönsä solun ulkopuolelle, korkeampi pH ja alempi Ca2+ hajottavat aggregaatit vapauttaakseen yksittäisiä proteiineja.
Golgin kypsymisen aikana pH muuttuu jatkuvasti niin, että siirryttäessä ER: stä Golgiin jokaisessa lokerossa on asteittain matalampi (happamampi) lumenaalin pH.
lopuksi on kysymys vesikkelien kohdentamisesta. Vesikkelit ovat paljon vähemmän hyödyllisiä, jos ne heitetään molekulaariseen tavarajunaan ja pudotetaan pois sattumanvaraisesti. Siksi on olemassa telakointimekanismi, joka vaatii v-VIRVELIPROTEIININ sovittamisen vesikkelin sytoplasmapintaan ja t-virvelin kohdekalvon sytoplasmapintaan. Fuusio rakkulan kalvoon etenee vain, jos on ottelu. Muuten vesikkeli ei voi sulautua ja kiinnittyy toiseen molekyylimoottoriin suunnatakseen toiseen, toivottavasti oikeaan, määränpäähän. Tätä prosessia auttaa kytkeminen proteiineja, jotka aluksi ottaa yhteyttä saapuvan rakkula ja vetää sen tarpeeksi lähelle kohdetta testata SNARE proteiini vuorovaikutus. Muut proteiinit rakkula ja kohde kalvot sitten vuorovaikutuksessa ja jos ansat täsmäävät, voi auttaa ”vinssata” rakkula kohdekalvon, jolloin kalvot sulake. Tärkeä nyrkkisääntö vesikulaarisen fuusion ymmärtämisessä ja myös kalvoproteiinien ja lipidien suunnassa on se, että solukalvon sytoplasma kohtaa aina soluliman. Siksi proteiini, joka lopulta löytyy ulkopinnalla solukalvon on työnnetty LUMENAALI pintaan ER kalvo aluksi.
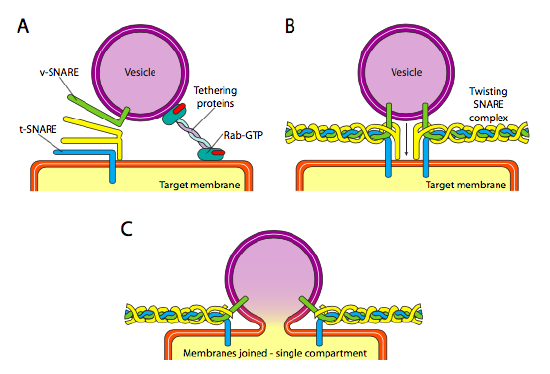
tarkemmin sanottuna, kun vesikkeli lähestyy kohdekalvoa, kiinnittyvä proteiini Rab-GTP, joka on yhteydessä kohdekalvoon kaksinkertaisen geranyyligeranyylilipidihännän kautta, liittyy löyhästi vesikkeliin ja pitää sitä kohdekalvon läheisyydessä antaakseen ansoille mahdollisuuden toimia. V-virveleillä ja t-virveleillä on nyt mahdollisuus vuorovaikuttaa ja testata toisiaan. Viime aikoina Virvelit on nimetty uudelleen R-Virveleiksi ja Q-Virveleiksi, jotka perustuvat säilyneisiin arginiini-ja glutamiinijäämiin. Näiden kahden ensisijaisen virvelin lisäksi mukana on ainakin yksi muu virveli, joka muodostaa yhdessä neljän α-kierteen (neljä, Ei kolme, sillä ainakin parhaiten tutkitussa esimerkissä yksi Virveleistä on taivutettu ympäri niin, että kaksi sen alfa-kierteisistä domeeneista osallistuu vuorovaikutukseen. Neljä heliceä kietoutuvat toistensa ympärille ja ajatellaan, että samalla ne vetävät vesikkelin ja kohdekalvon yhteen.
Clostridium tetani-bakteerien vapauttama jäykkäkouristustoksiini, tetanospasmiini, aiheuttaa kouristuksia vaikuttamalla hermosoluihin ja estämällä välittäjäaineiden vapautumista. Mekanismi tähän on se, että se pilkkoo synaptobreviiniä, VIRVELIPROTEIINIA, niin että synaptiset rakkulat eivät voi sulautua solukalvoon. Clostridium botulinumin botuliinitoksiini vaikuttaa myös ansoihin estääkseen rakkuloiden fuusion ja välittäjäaineen vapautumisen, vaikka se kohdistuu eri neuroneihin ja siten on päinvastainen vaikutus: jäykkäkouristus johtuu estävien välittäjäaineiden vapautumisen estämisestä, kun taas botulismi johtuu eksitatoristen välittäjäaineiden vapautumisen estämisestä.