Cell adheesion
Cell adheesion on prosessi, jossa solut vuorovaikuttavat tiettyjen molekyylien kanssa solun pinnalla ja kiinnittyvät viereisiin soluihin. Tämä prosessi voi tapahtua solupintojen välisissä suorissa tai epäsuorissa vuorovaikutuksissa, joissa solut kiinnittyvät ympäröivään solunulkoiseen matriisiin, joka sisältää solujen vapauttamat molekyylit solujen väliseen tilaan. Solun adheesio tapahtuu, kun solun adheesiomolekyyli (CAM) vuorovaikuttaa solun pinnalla sijaitsevan transmembraaniproteiinin kanssa. Solun adheesio yhdistää soluja eri tavoin ja voi osallistua signaalin transduktioon, jotta solut voivat havaita ja reagoida muutoksiin ympäröivässä ympäristössä. Muita solujen adheesiolla säädeltyjä soluprosesseja ovat solunsiirto ja kudoskehitys monisoluisissa eliöissä. Muutokset solujen tarttumisessa voivat häiritä tärkeitä soluprosesseja ja johtaa erilaisiin sairauksiin, kuten syöpään ja niveltulehdukseen. Solujen tarttuvuus on välttämätöntä myös tarttuvien eliöiden, kuten bakteerien tai virusten, aiheuttamissa sairauksissa.
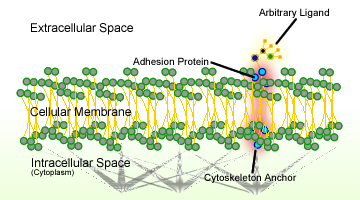 Kuva 1. Solujen adheesiokaavio
Kuva 1. Solujen adheesiokaavio
luokitukset
kamerat on jaettu neljään pääperheeseen: integriinit, immunoglobuliini (IG) superfamiiniperhe, cadheriini ja selektiinit. Jokaisella näistä adheesiomolekyyleistä on erilainen tehtävä ja ne tunnistavat eri ligandin. Kadheriinit ja immunoglobuliinit ovat homotyyppisiä kameroita, koska ne sitoutuvat suoraan samantyyppiseen CAM: iin toisessa solussa, kun taas integriinit ja selektiinit ovat heterologisia kameroita, jotka sitoutuvat erilaisiin CAM: iin. Solujen tarttuvuusvirheet johtuvat usein kameroiden ilmaisuvirheistä. Monisoluisissa eliöissä kameroiden välinen sitoutuminen saa solut tarttumaan toisiinsa ja muodostamaan soluliitokseksi kutsutun rakenteen.
tehtäviensä mukaan solun liitokset voidaan luokitella seuraavasti:
Ankkurointiliitokset (adherens junctions, desmosomes ja hemidesmosomes), jotka ylläpitävät soluja pitkin ja vahvistavat solujen välistä kontaktia.
sulkevat liitokset (tiiviit liitokset), jotka tiivistävät solujen väliset raot solun ja solun välisessä kosketuksessa ja luovat siten vedenkestävän esteen diffuusiolle.
Kanavaliitokset (rakoliitokset), jotka yhdistävät vierekkäisten solujen protoplasmaa mahdollistaen molekyylien kuljetuksen solujen välillä.
Signaalinvälitysliitännät, jotka voivat olla järjestelmän sisäisiä synapseja.
vaihtoehtoisesti soluliitokset voidaan luokitella 2 päälajikkeeseen sen mukaan, mikä on vuorovaikutuksessa solun kanssa: soluliitokset, päävälittäjinä cadheriinit, ja soluliitokset, päävälittäjinä integriinit.
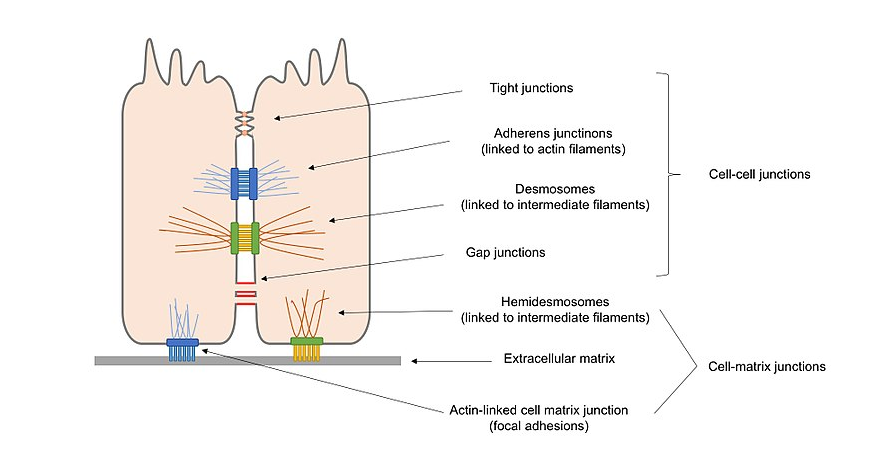 kuva 2. Yleiskatsaus kaavio eri soluliitosten läsnä epiteelisoluissa, mukaan lukien solu-solu liitokset ja solu–matriisi liitokset.
kuva 2. Yleiskatsaus kaavio eri soluliitosten läsnä epiteelisoluissa, mukaan lukien solu-solu liitokset ja solu–matriisi liitokset.
solun Adheesioproteiinien rakenteelliset ominaisuudet
solun adheesioproteiinit ovat yleensä glykoproteiineja, jotka välittävät solun-solun ja solunulkoisen matriisin tunnistamista solunulkoisella pinnalla. Useimmilla solujen adheesiomolekyyleillä on samankaltaiset konformaatiot liima-alueissaan. Esimerkiksi: cadherinin, immunoglobuliinin, tyypin III fibronektiinin ja EGF: n liima-aineet ovat pääasiassa β-levyrakenteita. Yleinen solun adheesioon liittyvä motiivi on kreikkalainen avaintynnyrirakenne, joka sisältää yhden tai kaksi anti-yhdensuuntaista β-voileipää.
Ig: n kaltaiset verkkotunnukset ovat kreikkalaisten avaintynnyrialueiden pääluokka. Niillä on sekvenssiyhtäläisyyksiä seitsemästä yhdeksään anti-yhdensuuntaista β-juostetta sisältävien vasta-aineiden muuttuvan tai vakioidun domeenin kanssa. Yhdensuuntaiset P-levyt muodostavat 3-D β-tynnyrin. Ig: n kaltaisia domeeneja stabiloivat hydrofobiset ydin-ja disulfidisidokset. Ne on jaettu kahteen pääjoukkoon: Ig C: n kaltaisiin ja Ig V: n kaltaisiin verkkotunnuksiin.
solun Adheesioproteiinien toiminnallisesti liittyvät rakenteelliset ominaisuudet
solun adheesioproteiinien funktionaalinen monimuotoisuus. Solujen adheesiomolekyylien yhteisvaikutus voi olla homofiilinen tai heterofiilinen proteiini-proteiini-yhteisvaikutus tai proteiini-hiilihydraatti-yhteisvaikutus. Solun adheesiomolekyylien rakenteelliset muutokset liittyvät usein niiden toiminnallisiin ominaisuuksiin.
Homofiiliset Proteiini-Proteiini-Yhteisvaikutukset.
esimerkiksi cadheriinit ovat transmembraanisia Ca2+-riippuvaisia homofiilisia adheesiomolekyylejä. Cadherinit ovat vastuussa samankaltaisten solujen välisten liitosten ylläpidosta kudoksissa. Solujen ja solujen välinen adheesio välittyy cadheriinien N-terminaalisen domeenin kautta. Se sisältää viisi samanlaista solunulkoista domeenia EC1: stä EC5: een. N-cadherinin röntgenkristallografiset tutkimukset osoittivat, että EC1-domeeni muodostaa dimeerin, jossa monomeerit ovat suuntautuneet rinnakkain sen liimasidontapinnan kanssa, joka osoittaa ulospäin plasmakalvosta. EC1-domeenien monomeeriyksiköt vuorovaikuttavat keskenään vastakkaisella tavalla, käyttäen liimasidontapintojaan ja muodostaen β-tynnyrirakenteen. Interaktion oletetulla rajapinnalla ehdotettiin olevan sekä hydrofobinen että polaarinen/varautunut luonne, joka jäljittelee immunoglobuliinidomeenien vuorovaikutusta keskenään Ig-superperheessä.
Heterofiiliset Proteiini-Proteiini-Vuorovaikutukset.
esimerkiksi integriinien sitoutuminen erilaisiin solun pintareseptoreihin ja solunulkoisiin matriisiligandeihin on solun adheesiojärjestelmien heterofiilisen proteiini-proteiini-vuorovaikutuksen pääluokka. Sitoutuessaan liukoiseen fibrinogeeniin integriini aIIbß3 muuttuu suuren affiniteetin sitoutumistilaan. Ligandin sitoutumisen aiheuttamat integriinin konformaatiomuutokset ovat tässä tapauksessa kriittisiä sen liiman aktiivisuuden kannalta. T-solureseptorin sitoutuminen voi myös moduloida integriinin, leukosyyttifunktioon liittyvän antigeeni – 1: n (LFA-1) sitoutumisaffiniteettia sen reseptoreihin, kuten ICAM-l: ään tai ICAM-2: een (solujen välinen adheesiomolekyyli). ICAM-l: n sitoutuminen voi edelleen indusoida LFA-1: n konformaatiomuutoksia. Proteiinin liimasitoutumiskohta sijaitsee LFA-l: n c-terminaalissa röntgenkristallografisen tutkimuksen perusteella.Tripeptidi, arginiini-glysiini-asparagiinihappo (RGD), on yleinen integriiniligandeja sitova motiivi. Esimerkiksi fibronektiinin integriiniä sitova ligandityypin III-moduulissa on kreikkalainen avaintynnyrirakenne, jonka F-ja G-säikeitä yhdistävän silmukan kärjessä sijaitseva RGD-motiivi välittää adheesiota. RGD-silmukan suoristaminen lineaarisempaan vaihtelevaan konformaatioon avautumalla vähentää silmukan saatavuutta pintaan sidottuihin integriineihin ja siten vähentää sitoutumisen affiniteettia ja selektiivisyyttä.
Proteiini-Hiilihydraatti-Yhteisvaikutukset.
selektiinit ovat tärkeitä lymfosyyttien ja neutrofiilien yhteisvaikutuksessa verisuonten endoteelin kanssa. Selektiinit ovat adheesiomolekyylejä, jotka sitoutuvat hiilihydraatteihin. Selektiinien sitoutumisesta hiilihydraatteihin ei ole vielä suoraa rakenteellista tietoa. Selektiinit sitovat hiilihydraatteja matalalla affiniteetilla ja ovat erittäin nopeita päälle ja pois.