keskustelu
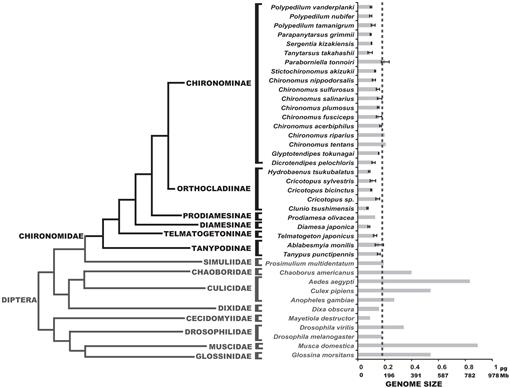
määritimme tässä 25: n hiromidilajin genomikoot; nämä arvot olivat yhdenmukaisia kirjallisuudessa aiemmin ilmoitettujen kolmen lajin genomikokojen kanssa (Petitpierre, 1996; Schmidt-Ott et al., 2009), jotka koostuivat 0,13-0,21 pg DNA: sta. Tutkimuksen tulokset osoittivat, että chironomidien genomikoot olivat tasaisen hyvin pieniä (Fig. 3, taulukko 1). Saatu chironomidae-heimon C-arvon keskiarvo on 0,13 + 0.03 PG DNA, joka on selvästi pienempi kuin D. melanogaster genomin koko. Pienin genomin koko hyönteisten on kirjattu Strepsiptera Caenocholax fenyesi Noin 0.11 PG DNA (vastaa noin 108 Mb), vaikka Hessian lentää Mayetiola destructor ehdotettiin myös on vielä pienempi genomin koko 0.09 pg (Johnston et al., 2004; Gregory, 2014). Tässä raportoimme ainakin kolmesta lajista, joilla on pienemmät genomit kuin millään tunnetulla hyönteisellä: C. tsushimensis, Diamesa japonica ja Hydrobaenus tsukubalatus, joiden C-arvot ovat 0,07 pg, 0,08 pg ja 0,08 pg (Taulukko 1). Tietääksemme C. tsushimensis (Kuva. 1B) voidaan nyt katsoa olevan pienin genomikoko mitään tunnettua hyönteistä, jonka C-arvo on 0,07 PG DNA, joka vastaa karkeasti 68 Mb. Tämä arvo on yhdenmukainen sukulaislajin, Clunio Marinuksen, genomin koon kanssa, joka arvioitiin kerran 95 Mb: ksi ja myöhemmin 87,2 Mb: ksi (Kaiser and Heckel, 2012; Tobias S. Kaiser, personal communication).
äskettäin Etelämantereen midgen, B. antarctica, perimä sekvensoitiin (Kelley et al., 2014). Kirjoittajat väittivät, että genomin koko tämän lajin, arviolta 89.5-105 Mb, oli pienin kaikista hyönteisistä. Kuitenkin, osoitamme tässä, että tämä genomin koko koostuu normaalin vaihteluvälin chironomids arvot. Kirjoittajat esittivät myös, että B. Antarktiksen pieni genomikoko oli sopeutuma äärimmäiseen kylmään ympäristöön. Tietomme voivat vahvistaa tämän hypoteesin, koska myös D. japonica, Diamesinae-alaheimoon kuuluva alppilaji, on kooltaan pieni. Toinen sukua oleva Diamesinae, Himalajan midge Diamesa sp. oli itse asiassa todettu olevan aktiivinen niinkin alhaisissa lämpötiloissa kuin -16°C (Kohshima, 1984). Kuitenkin Telmatogeton japonicus, joka pystyy myös kehittymään hyvin alhaisissa lämpötiloissa (Danks, 1971; Sunose ja Fujisawa, 1982), on suhteellisen suuri genomikoko verrattuna chironomid-suvun keskiarvoon. Fylogeneettinen vaikutus genomin kokoon on tässä otettava huomioon, sillä B. antarctica kuuluu Orthocladiinae-alaheimoon, jonka genomikoot ovat keskimäärin pieniä. Orthocladiinae-alaheimoon kuuluvat myös lajit C. tsushimensis ja Hydrobaenus tsukubalatus, joilla on chironomidien pienin genomikoko. Näin ollen B: n pieni genomikoko. Etelämanner saattaa olla vain esi-isien ominaisuus, ei äärimmäisen kylmän sopeutumisen tulos.
P. vanderplanki on ainoa hyönteislaji, jonka tiedetään saavuttavan anhydrobioosin täysin kuivatussa tilassa (viikuna. 1D) ja recover after rehydration (Hinton, 1951, 1960a; Watanabe, 2006; Cornette and Kikawada, 2011). Tutkimusryhmämme julkaisi äskettäin vertailevan analyysin kuivausta sietävän Polypedilum vanderplankin ja kuivausherkän Kongeneerisen Polypedilum nubiferin genomisekvensseistä (Gusev et al., 2014). Vertailu osoitti, että molemmilla lajeilla oli samanlainen genomikoko ja että vain rajallinen joukko kahdentuneita geeniklustereita liittyi anhydrobioosiin P. vanderplankilla (Gusev et al., 2014). Genomikokoonpanosta päätellyt genomikoot olivat 104 Mb P. vanderplankilla ja 107 Mb P. nubiferilla, eivätkä nämä arvot poikenneet merkittävästi tässä tutkimuksessa näille lajeille mitatuista genomikooista, jotka vastasivat noin 98 Mb: tä. P. vanderplanki ja P. nubiferin genomeissa oli yhtä vähän DNA: n toistumista ja vain pieni määrä transposoituvia alkuaineita löytyi verrattuna muihin dipteraanilajeihin. Tämä transposoituvien alkuaineiden osuuden väheneminen havaittiin myös Etelämantereen midge, B. antarctica (Kelley et al., 2014). Keskimääräinen intronin pituus lyheni huomattavasti myös Etelämantereen midgessä ja sekä P. vanderplankissa että P. nubiferissa (Gusev et al., 2014). Koska kuivaus herkkä ja jäädyttää intolerantti P. nubifer jakaa nämä piirteet Etelämantereen midgen ja anhydrobioottisen midgen kanssa, pieni osuus transposoituvista elementeistä ja lyhyt intronipituus voivat olla kaikille chironomideille yhteinen ominaisuus, eivätkä ne välttämättä liity suoraan ääriympäristöjen sietokykyyn, vaikka adaptiivista vaikutusta ei voitaisikaan sulkea pois.
Kuva. 3.
Dipteran fylogenia, jossa on arvioitu C-arvo. Chironomid-suku näkyy mustana. Viiva näyttää D. melanogasterin genomin koon. Fylogeneettinen kladogrammi on eri Chironomid-ja Dipteraanipuiden konsensus (Yeates and Wiegmann, 1999, 2005; Saether, 2000; Cranston et al., 2012). Virheet palkit osoittavat keskihajonta. Genomikoot ilman virhetankoja saatiin aiemmista Animal Genome Size-tietokantaan listatuista tutkimuksista (Gregory, 2014).
Kuva. 4.
tässä tutkimuksessa tutkittujen chironomid-lajien ruumiinkoon ja genomin koon välinen suhde. A) kunkin lajin kokonaispituuden keskiarvo ilmoitetaan millimetreinä ja C-arvon keskiarvo pg-DNA: na. Näiden kahden muuttujan välillä havaittiin vain heikko positiivinen korrelaatio (r2 = 0,171, n = 25), joka konkretisoitui kiinteällä viivalla. B) sukutasolla samat arvot muunnettiin fylogeneettisesti riippumattomien kontrastien menetelmällä, joka perustui Cranstonin et al. (2012). Näiden muuttuneiden vastakohtien välinen korrelaatio, joka toteutui kiinteän viivan avulla, ei ollut merkitsevä (r2 = 0,118, n = 13). Data-analyysi tehtiin Prismassa 4.0 ohjelmisto Macintosh (GraphPad Software, Inc.).

mitkä voisivat olla mukautuvia piirteitä, jotka mahdollisesti liittyvät chironomidae-heimon pieniin genomikokoihin? Useiden kehitys-ja ekologisten tekijöiden onkin arveltu korreloivan genomikokojen kanssa. Ensinnäkin, positiivinen korrelaatio genomin koon ja kehon koon välillä on löydetty monista taksoneista ja tämä korrelaatio esiintyy suhteellisen yleisenä ilmiönä (Gregory, 2005). Tämä korrelaatio on raportoitu myös hyttysissä (Ferrari ja Rai, 1989), mutta se ei ole aina selvää muissa hyönteisten taksoneissa (Gregory ja Hebert, 2003; Ardila-Garcia ja Gregory, 2009). Sisällä chironomids, löysimme vain heikko positiivinen korrelaatio genomin koon ja kehon koon (Kuva. 4 A). Chironomus-suvun keskimääräinen C-arvo (0,15 pg) oli korkeampi kuin Polypedilum-suvun (0,10 pg), ja tämä ero voi johtua Chironomus-lajin yleensä suuremmasta ruumiinkoosta. Fylogeneettinen etäisyys molempien sukujen välillä voisi kuitenkin selittää myös tämän genomikokojen eron. Näin ollen korjasimme tietoja sukutasolla fylogeneettisesti riippumattomalla kontrastianalyysillä (Garland and Adolph, 1994; Garland et al., 2005) ja tämän seurauksena genomin koon ja kehon koon välinen korrelaatio osoittautui ei-merkittäväksi (Kuva. 4b). Chironomidae—heimon genomikokojen kapean vaihteluvälin (vain kaksi-kolminkertainen) ja näiden lajien keskimääräisen pienen ruumiinkoon (useimmat eivät ylitä muutamaa millimetriä) vuoksi on todennäköisesti vaikea löytää korrelaatiota molempien ominaisuuksien välillä chironomidae-heimon sisällä.
hyönteisillä esitettiin toinen korrelaatio genomin koon ja kehityksen monimutkaisuuden välillä. Kun taas hemimetaboliset hyönteiset, joissa on vain asteittaisia nymfimäisiä sulkia, osoittavat laajan valikoiman genomikokoja (C-arvot 0,18-16.93 pg), holometabolisilla hyönteisillä, joilla on monimutkainen metamorfoosi, on C-arvot rajoitettu oletetun 2 pg: n kynnysarvon sisällä useimmille niistä (Gregory, 2002, 2005). Kehityskompleksisuuden vaikutus genomin kokoon on tässä ilmeinen, koska holometaboliset hyönteiset läpikäyvät intensiivisen morfologisen muokkauksen metamorfoosin rajallisen ajan aikana ja pieni genomikoko tarjoaa etuja solunjakautumisten aikaansaamisessa suurella nopeudella. Chironomidit ovat holometabolisia hyönteisiä ja niiden metamorfoosi on erittäin nopea. Niiden kotelovaihe voi kestää vain yhden päivän tai joillakin lajeilla jopa vain muutaman tunnin (Cranston, 1995c). Esimerkiksi C. tsushimensis osoittaa monimutkaisen metamorfoosin, jossa on voimakas seksuaalinen dimorfismi(Kuva. 1b).
genomin koon ja solunjakautumisnopeuden välinen suhde vaikuttaa myös kehitysnopeuteen. Esimerkiksi kirvojen nopean elinkierron on arveltu liittyvän niiden pieneen genomikokoon (Ma et al., 1992). Pienten genomikokojen pitäisi siis olla etu tilapäisympäristöissä nopeasti kehittyville chironomid-lajeille. Chironomids suvusta Clunio voi kehittyä väliaikaisia vuorovesialtaita ja näyttää myös synkronoitu syntyminen aikuisten suhteessa kuun kierto ja aikana lyhyen ikkunan laskuveden (Kaiser and Heckel, 2012). Tämän saavuttamiseksi tarvitaan korkeaa kehitysastetta. Huomaa, että pienet polychaete annelidit kehittyvät nopeasti samanlaisissa interstitiaaliympäristöissä ovat pienempiä genomikokoja kuin makrobenttiset lajit (Gambi et al., 1997). Etelämantereen kääpiöille, kuten B. antarctica tai Eretmoptera murphyi (Lee et al., 2006; Worland, 2010), toukkakehitys kestää kaksi vuotta, enimmäkseen jäätyneenä, mutta metamorfoosin ja lisääntymisen on tapahduttava hyvin lyhyen kesäkauden aikana. Tällöin tarvitaan korkeaa kehitysnopeutta ja tätä saattaa helpottaa B. antarctica small genomi. Tätä ilmiötä havainnollisti angiospermikasveilla tehty tutkimus, joka osoitti, että lajit, jotka pystyivät suorittamaan koko elinkaarensa lyhyen Antarktisen kesän aikana, esittivät pienimmät genomikoot (Bennett et al., 1982). Toinen ääripää, anhydrobioottinen midge P. vanderplanki on sopeutunut lyhytaikaisiin kivialtaisiin. Tässäkin tapauksessa nopea kehitysnopeus tilapäisessä elinympäristössä voi olla yhteydessä lajin pieneen genomikokoon. Kuitenkin australialainen laji P. tonnoiri, joka myös altistuu kuivumiselle samanlaisilla kivialtailla (Jones, 1975; Adams, 1985; Frouz et al., 2003), osoittaa suhteellisen suuri genomin koko chironomid (Kuva. 3 ja taulukko 1).
abioottiset rasitukset vaikuttavat todennäköisesti myös DNA: n eheyteen ja sitä kautta genomin kokoon. Esimerkiksi P. vanderpianki kokea massiivinen DNA-vaurioita jälkeen anhydrobiosis ja tehokas DNA korjaus tapahtuu muutaman päivän kuluttua nesteytyksen (Gusev et al., 2010). Kasveissa havaittiin negatiivinen korrelaatio genomin koon ja säteilynsietokyvyn välillä (Bennett and Leitch, 2005) ja mutaationopeus oli myös pienempi lajeilla, joilla oli pienempi genomin koko (Abrahamson et al., 1973). Näin ollen P. vanderpiankin pieni genomikoko voi olla etu välttää haitallisten mutaatioiden kertyminen DNA: n korjaustapahtumien aikana, jotka liittyvät kuivausjaksoihin ja nesteytykseen. Merilajina C. tsushimensis altistuu myös suurelle suolapitoisuudelle, mikä on tappavaa useimmille hyönteislajeille. Korkean suolapitoisuuden ja muiden abioottisten jännitysten tiedetään tuottavan solunsisäisiä reaktiivisia happilajeja (ROS), joita on ehdotettu pääasialliseksi DNA-vaurioiden lähteeksi (Franca et al., 2007; Gill and Tuteja, 2010). Tämä saattaa liittyä myös pieneen genomin kokoon. Muilla merellisillä ja suuria suolapitoisuuksia sietävillä lajeilla, kuten T. japonicuksella tai Chironomus salinariuksella, genomikoot eivät kuitenkaan ole yhtä pienet kuin C. tsushimensiksellä. Happoa sietävät lajit, kuten Chironomus sulfurosus, Chironomus acerbiphilus tai Polypedilum tamanigrum (viikuna. 1C) voi selviytyä kuumissa lähteissä, joiden pH on niinkin alhainen kuin 1,4 (Doi et al., 2004; Takagi et al., 2005). Tässäkään tapauksessa ei voitu havaita selvää korrelaatiota happaman stressin sietokyvyn ja pienen genomikoonvälillä, ja fylogeneettinen vaikutus näytti tärkeämmältä, sillä Polypedilum-suvun genomikoko oli pienempi ja chironomus-suvun genomikoko suurempi.
johtopäätöksenä voidaan todeta, että chironomideilla havaitut pienet genomikoot ovat todennäköisesti seurausta transposoituvien alkuaineiden määrän ja intronien pituuden vähenemisestä niiden genomirakenteessa. Chironomidae-heimossa genomikoot vaihtelivat fylogenian mukaan alaheimotasolla ja sukutasolla. Kuten eri taksonien korrelaatioista on päätelty, chironomidien pieni genomikoko on teoriassa voinut muodostaa esiaptaation epävakaisiin ja äärimmäisiin ympäristöihin korkean kehitysnopeuden ja alhaisen mutaationopeuden kautta. Toivomme, että tämä tutkimus kannustaa tulevia Chironomid genome-hankkeita ja että vertaileva genomiikka tämän taksonin sisällä auttaa ymmärtämään, miten Chironomid genomit ovat vuorovaikutuksessa ympäristönsä kanssa.