Johdanto
kudokset, solut ja solujen sisällä olevat pienemmät rakenteet (organellit) ovat enimmäkseen vettä ja siten läpinäkyviä. Kuvantaminen pieni läpinäkyvä pussit vettä johtaa kuvia, jotka eivät sisällä paljon tietoa, ja mikroskopiassa, on tärkeää olla jonkinlainen kontrasti tai tahra, joka antaa alueet näytteen väri ja tehdä niistä paljon helpompi nähdä. Entä jos haluat kuvata vain joitakin solun sisällä olevia pienempiä rakenteita, kuten tumaa tai solukalvoa? Väritys koko solun tekisi mahdottomaksi paikallistaa alueita olet kiinnostunut.
fluoresenssi ratkaisee sekä nämä kontrasti-että lokalisointikysymykset. Fluoresenssissa kappale lähettää valoa absorboituaan valoa. Monissa eri kohteissa esiintyy fluoresenssia, kuten mineraaleissa (fluoresenssi‑sana tulee mineraalifluoriitista), syvänmeren kaloissa (tunnetuin meduusa aequorea victoria, josta löydettiin vihreä fluoresoiva proteiini (GFP)), kasveissa, kemikaaleissa ja monissa muissa.
näytteiden merkitsemiseen käytetään fluoresoivia molekyylejä (ns.fluoroforeja), ja fluoriforeja on saatavilla, jotka lähettävät valoa lähes missä tahansa värissä. Fluoresoivassa mikroskoopissa näyte merkitään fluoroforilla, minkä jälkeen näytettä valaisee kirkas valo (herätevalo), josta lähtee fluoresenssi (emissiovalo). Tällä tavalla näytteet ovat hyvin vastakohtaisia mustalle taustalle, koska fluorifori säteilee kirkkaan väristä valoa. Sijoittamalla nämä fluoriforit kiinnostavalle alueelle voidaan ottaa selkeä kuva mistä tahansa solun osasta, mikä tekee fluoresenssimikroskopiasta tehokkaan työvälineen biotieteille.
Brightfield vs Fluoresenssikuvaus
brightfield-mikroskopiassa näyte valaistaan välitetyllä valkoisella valolla. Näin mikroskoopissa oleva näyte valaistuu tasaisesti, jotta voidaan tarkkailla hyvin vastakkaisia, värjäytyneitä tai luonnollisesti pigmentoituneita näytteitä. Brightfield ei kuitenkaan riitä erottamaan toisistaan läpinäkyviä/läpikuultavia, hallitsemattomia soluja tai solurakenteita kiinnostavien prosessien tutkimiseksi.
Fluoresenssimikroskopiassa käytetään fluoriforeja, molekyylejä, jotka lähettävät valoa tietyllä näkyvällä aallonpituudella altistuessaan valolle, jolla on eri aallonpituus. Kun nämä fluoriforit sitoutuvat kiinnostavaan kohderakenteeseen, fluoriforista emittoituvia fotoneja voidaan käyttää tämän kiinnostavan rakenteen havainnollistamiseen. Fluoresenssimikroskopian etuna on, että kohderakenteet valaistaan, kun taas näytteen ei-toivotuilla alueilla on vain vähän tai ei lainkaan fluoresenssia, mikä mahdollistaa helpon kohdistamisen ja kuvantamisen.
miksi molekyylit fluoresoivat
fluoresenssin alkuperä on elektronit, jotka liikkuvat vapaasti aktiivisen fluoriforin ympärillä ja vapauttavat absorboitunutta energiaa, kuten kuvassa.2.
ennen eksitaatiota elektronit ovat alimmassa niiden käytettävissä olevassa energiatilassa – maan tilassa (S0). Kun elektroniin osuu tietyn energia-alueen fotoni, elektroni absorboi fotonin energian ja hyppää korkeampaan energiatilaan (S1, S2 tai S3). Palatakseen maatilaan (S0) elektroni vapauttaa lisäenergian fotonin emissiona. Tämän fotonin energia on pienempi kuin heräteenergia, joten sillä on pidempi aallonpituus. Tämän vuoksi emissiovalolla on pidempi aallonpituus kuin herätevalolla ja se voi näkyä erivärisenä.
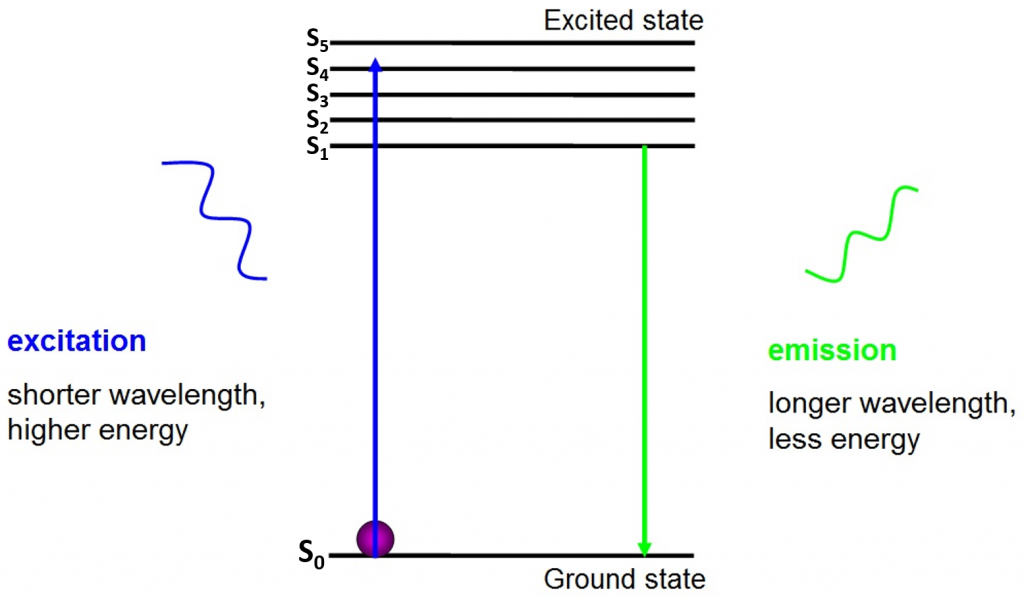
emittoitunut fotoni on yleensä näkyvässä spektrissä ja sitä voidaan tarkastella mikroskoopilla, jos jännittyneitä fluoriforeja on riittävästi. Vapautuvan fotonin aallonpituus on jokaiselle fluoriforille spesifinen ja tämä ennustettavuus mahdollistaa helpon fluoresenssikuvauksen.
fluoresenssin Intensiteettikertoimet
vaikka fluoroforit voivat lähettää fluoresenssia ennustettavalla aallonpituudella, on myös tärkeää tietää, mitkä tekijät ohjaavat fluoresenssin intensiteettiä. Ilman tarpeeksi voimakasta valosäteilyä fluoresenssia ei voi havaita mikroskoopilla.
Kvanttisaanto
fluoriforin kvanttisaanto (ϕ) on vapautuneiden fotonien määrän suhde absorboituneiden fotonien määrään. Kvanttisaanto ilmaistaan usein arvona 0-1, joka 1 on fotonimuunnoksen 100% hyötysuhde. On myös tärkeää huomata, että jokaisella fluorifortilla on ainutlaatuinen pH, ionilujuus ja lämpötila optimaaliselle fluoresenssitehokkuudelle.
Ekstinktiokerroin
jokaisella fluorilla on erilainen kyky absorboida fotoneja, vaikka ne olisivat sopivalla aallonpituusalueella sen herättämiseksi. Jos fluorofori altistuu fotonille, joka vastaa asianmukaisesti sen magnetointiaallonpituutta, fotonin absorboitumisen todennäköisyys on mitattavissa oleva ominaisuus, jota kutsutaan ekstinktiokertoimeksi (ε).
fluoriforin kvanttisaanto ja ekstinktiokerroin esitetään usein yhdessä kuvaamaan, kuinka kirkkaana fluoriforin osoitetaan kokeellisissa olosuhteissa olevan.
fluoresenssin elinikä
kun fluoriforielektroni absorboi fotonin, se ei heti vapauta pidemmän aallonpituuden fotonia. Jonkin energian vapautumisen kiihtyneiden energiatilojen välillä tiedetään vievän eripituisia aikoja. Aika, jonka elektroni viettää virittyneessä tilassa ennen fotonin vapauttamista ja palaamista maatilaan, on sen fluoresenssin eliniän mitta. Jokaisen fluoroforin käyttöikä on ainutlaatuinen ja sitä voidaan mitata kokeellisesti. Kun fluoresoivia väriaineita käytetään kokeellisesti, siitä on hyötyä niiden eliniälle, erityisesti suurta nopeutta vaativissa sovelluksissa, kuten kalsiumkuvantavissa neuroneissa.
Magnetointiaallonpituuden voimakkuus
useimmat fluoresoivat mikroskopiat sisältävät valonlähteen, joka voidaan virittää tuottamaan haluttu aallonpituusalue. Monia loisteputkivalonlähteitä voidaan myös säätää herätevoimakkuuden mukaan lisäämään valoradalla liikkuvien fotonien määrää. Fluoresenssilla merkityssä näytteessä, joka altistuu sen magnetointiaallonpituudelle, jokainen fluorofori ei aktivoidu samanaikaisesti. Lisäämällä magnetoinnin voimakkuutta ja lisäämällä näytteeseen pääsevien fotonien määrää saadaan suurempi todennäköisyys, että fluoriforeja innostuu enemmän.
Fotostabiilisuus
Fotostabiilisuus on molekyylin tai eliön kyky vastustaa vaurioita. Fluoresenssimikroskopiassa fluoriforit lopulta lakkaavat absorboimasta vastaantulevia fotoneja ja menevät pysyvään pimeään tilaan. Kun eliö kerää pimeässä enemmän fluoriforeja, merkityn kohteen ulkonäkö vähenee,ja näytteen sanotaan valottavan. Fluoresenssimikroskopiassa kokeissa pyritään usein vähentämään valoherkistymisen määrää. Joitakin toimenpiteitä ovat näytteen kanssa vuorovaikutuksessa olevan valon voimakkuuden vähentäminen ja erikoistuneiden fluoresoivien väriaineiden käyttö, jotka eivät ole aktiivisia yhtä kauan kuin muut väriaineet.
Fluoresenssimikroskopia
tutkijoille fluoresenssin tärkein hyöty on kyky käyttää fluoresenssimikroskopiaa, jossa näytteet merkitään/värjätään fluoresoivalla aineella, kuten väriaineella, vasta-aineella tai proteiinilla, jolloin kuvissa on kontrastia. Kohdentamalla nämä fluoresoivat merkit tutkijat voivat valita, mitä he haluavat nähdä. Tämä on osoitettu kuvassa.3, jossa neuroni voidaan selvästi nähdä astrosyyttien joukossa, koska ne on merkitty eri värisillä fluoresoivilla merkkiaineilla.
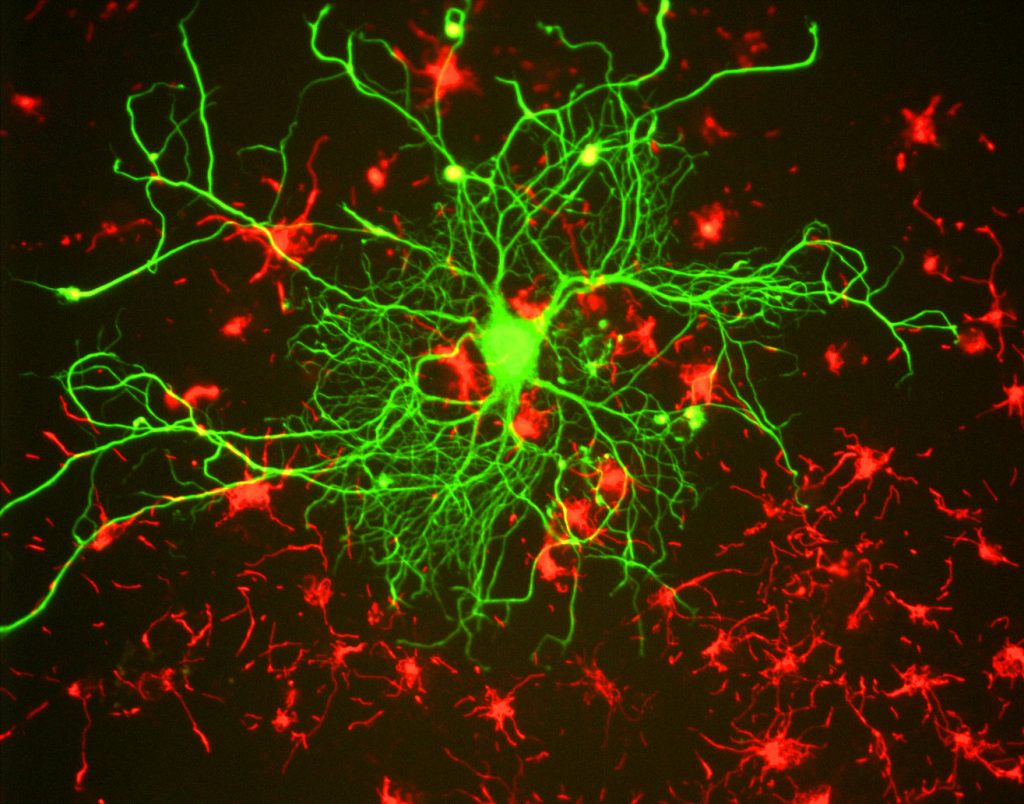
yleensä fluoresenssimikroskopiassa näyte merkitään fluoresoivilla markkereilla (tyypillisesti spesifinen näytteen tietyille osille). Tämän jälkeen näyte valaistaan fluoriforille ominaisella magnetaatioaallonpituudella, ja tuloksena oleva emissio fluoresenssi vastaanotetaan ilmaisimella, yleensä herkällä tieteellisellä kameralla.
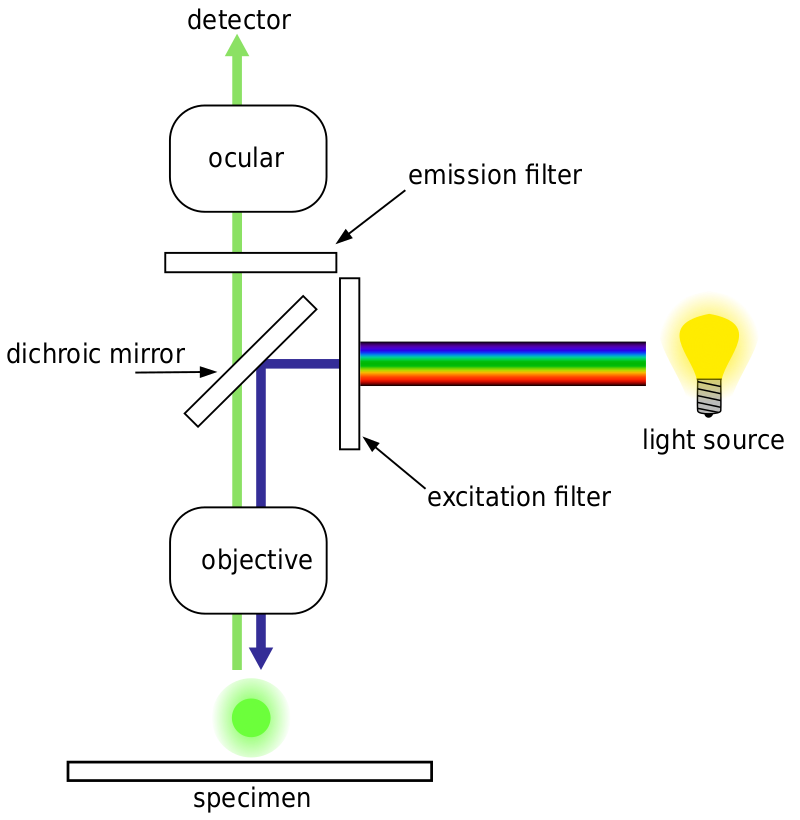
useimmat fluoresenssimikroskoopit ovat epifluoresenssimikroskooppeja, joissa eksitaatio ja emissio tapahtuu samaa valorataa pitkin. Sekä herätevalaistus että emittoitunut fluoresenssi läpäisevät mikroskoopin tavoitteen ja yleensä suodatetaan vain fluoresenssin havaitsemiseksi. Tämä asetus näkyy kuvassa.4.
Autofluoresenssi
joissakin rakenteissa, biologisissa organismeissa ja yleisissä mikroskopianäytteissä voi luontaisesti esiintyä fluoresenssia, jota kutsutaan autofluoresenssiksi. Tämä eroaa leimattujen näytteiden fluoresenssista, mutta sillä on usein samanlaiset aallonpituudet, mikä tarkoittaa, että autofluoresenssimikroskopianäytteet voivat hämärtää keinotekoisesti lisättyä fluoresenssia ja häiritä havaitsemista vähentäen signaalia. On tärkeää tietää, jos näytteissä esiintyy autofluoresenssia, koska tämä vaikuttaa kaikkiin fluoresenssikuvauksiin, ellei tiettyjä aallonpituuksia käytetä sen välttämiseksi.
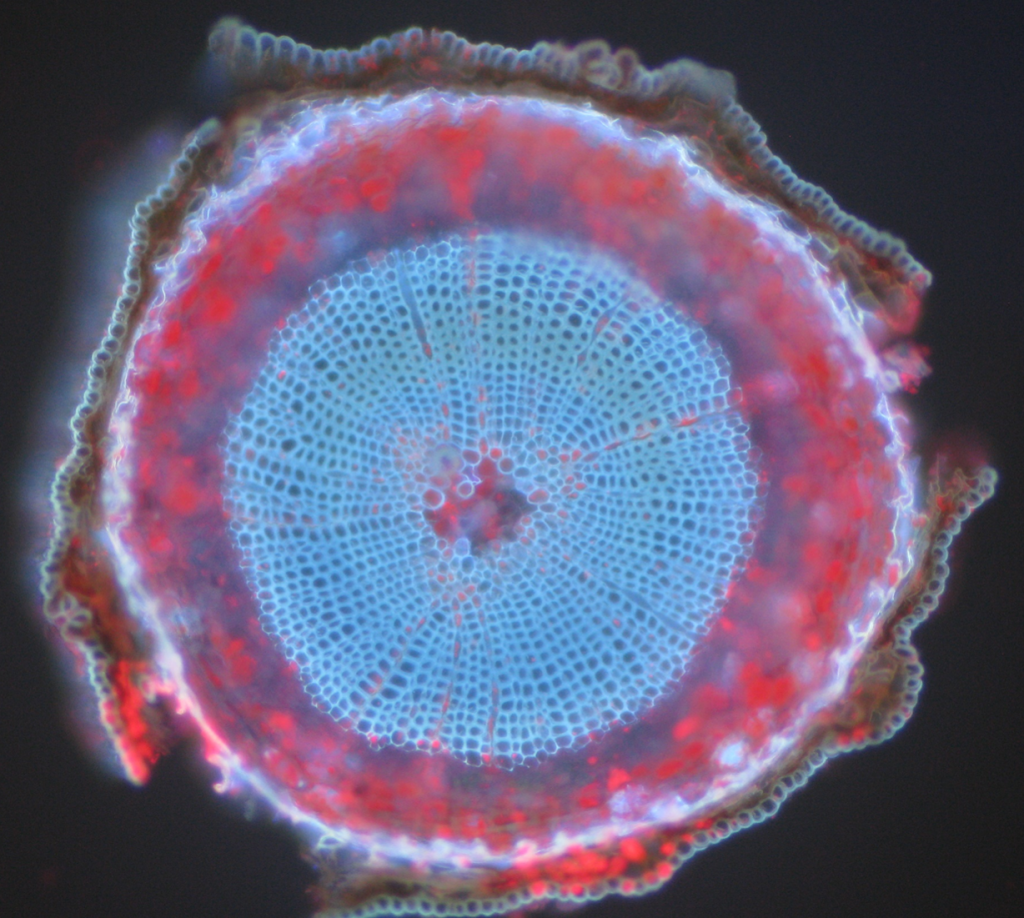
yleisiä esimerkkejä autofluoresoivista kohteista ovat mitokondriot, lysosomit, kollageeni ja eräät aminohapot kuten tryptofaani, tyrosiini ja fenyylialaniini. Erityisesti autofluoresenssi on yleistä kasveissa, koska ne käyttävät klorofylliä ja muita fluoresoivia molekyylejä, kuten ligniinejä ja karoteeneja. Kuva.5 näyttää autofluoresenssin eri värejä merkitsemättömästä mäntynäytteestä.
tiivistelmä
ensimmäisen fluoresoivan väriaineen käyttöönotosta lähtien fluoresenssimikroskopiaa on käytetty hyödyllisesti solujen ja solurakenteiden havainnollistamiseen, mikä on erityisempää kuin perinteisillä brightfield-mikroskopiatekniikoilla. Tutkijat voivatmanipuloida rakenteen, optiset ominaisuudet, ja koetin kiinnostaa vaikuttajaresescence kokeita saada asiaankuuluvaa tietoa. Tällainen joustavuus on mahdollistanut fluoresenssimikroskopian sisällyttämisen moniin biotieteellisiin kokeisiin.
riippuen näytetyypistä ja fluoriforista, tieteellinen kamera on valittava huolellisesti parhaiden kuvantamistulosten saavuttamiseksi.
- Valomikroskopia. (2009) Luonnon Virstanpylväitä. MacMillan Publishers Limited, 6-22.
- Lavis, L. D., & Raines, R. T. (2008). Kirkkaita ideoita kemialliseen biologiaan. ACS Chemical Biology, 3(3): 142-155.
- Liu, Y., Lilly, D. (2017) kiderakenteet, jos Syaniinifluoroforit pinoutuvat kaksijuosteisen RNA: n päähän. Biofysical Journal, 113, (11): 2236-2343.
- Berezin, M. Y., Achilefu, S. (2010). Fluoresenssin Elinaikamittaukset ja biologinen kuvantaminen. Chemical Reviews, 110 (5): 2641-2684.
- Stockert, J., Blazquez-Castro, A. (2017) Fluorescence Microscopy in Life Sciences. Sharjah, Arabiemiirikunnat. Bentham Science Publishers.
- Berezin, M. Y., & Achilefu, S. (2010). Fluoresenssin Elinaikamittaukset ja biologinen kuvantaminen. Chemical Reviews, 110 (5): 2641-2684.
- Denk, W., Strickler, J., Webb, W. (1990). Kahden Fotonin Laserkeilausfluoresenssimikroskopia. Tiede. 248, (1951): 73-76.
- So, P. (2002). Kahden fotonin Fluoresenssivalomikroskopia. Macmillan Publishing Group.
- Schermelleh, L., Heinztmann, R., and Leonardt, H. (2010). A Guide to Super-resoluutioinen Fluoresenssimikroskopia. The Journal of Cell Biology 190 (2): 165-175.
- Betzig, E., Patterson, G. H., Sougrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., Davidson, M. W., LippincottSchwartz, J., Hess, H. F. (2006). Tiede. 313(5793): 1642-5
- Rust, M. J., Bates, M. & Zhuang, X. (2006) Sub-diffraction-limit imaging by stokastic optical reconstruction microscopy (STORM). Nat-Menetelmät. 2, (10):793-5.
- Rego, E., Shao, L., Macklin, J. Winoto, L., Johansson, G., Kamps-Hughes, N., Davidson, M., and Gustasson, M. (2010) PNAS. 109 (3): e135-a143.
- Jungmann, R., Avendaño, M. S., Woehrstein, J. B., Dai, M., Shih, W. M. & Yin, P. (2014) Multiplexed 3D cellular super-resolution imaging with DNA-PAINT and Exchange-PAINT. Nat-Menetelmät. 11(3): 313-318
- Jiang, X., Wang, L., Carroll, S., Chen, J., Wang, M. ja Wang, J. (2018) Challenges and Opportunities for Small Molecule Fluorescent Probes in Redox Biology Applications. Antioxidants & Redox Signaling. Mary Ann Liebert, Inc.