KCSA-kanava: rakenne
tämä paperi keskittyy Streptomyces lividansin kaliumkanavaan KCSA: han, joka sisältää kaksi domeenia. Ensimmäinen on transmembraani osa, joka sisältää 120 jäämiä. Tätä käsitellään yksityiskohtaisesti jäljempänä. Toinen domeeni on sytoplasmainen domeeni, joka sisältää noin 40 jäämää. Sytoplasma-domeeni edistää suljetun tilan vakautta. Tämä on päätelty perustuen tietoihin, joiden mukaan kanavan taitto-ja kokoonpanotehokkuuden heikkeneminen sekä lämpöstabiilisuus vaikuttavat, kun sytoplasma-domeeni poistetaan kiderakenteesta.5 kuten kuvasta 2 nähdään, vedellä täytetty C-terminaalinen sytoplasma-domeeni on 4-helix-pakettirakenne, joka ulottuu lineaarisesti kohti sytoplasmaa.5-6 uysalin tuottaman elektronin paramagneettisen resonanssin eli EPR: n avulla on osoitettu, että C-terminaalissa on venymä, joka pullistuu siinä kohtaa, missä C-terminaalinen domeeni kohtaa transmembraanidomeenin.5 tämä venyttää helix, joka yhdistää kaksi on suurempi joustavuus kuin muut osat, jotka mahdollisesti on rooli avaamisen aikana kanavan.5 on vielä paljon tutkimusta, joka on tehtävä täysin ymmärtää toimivuutta C-terminal domain. Domeenin ehdotettu tehtävä on, että se voi toimia tunnistamattoman plasmisen aktivaattoriproteiinin tai ligandin reseptorina, mutta toiset väittävät, että ionin läpäisypolulla ei ole merkittävää vaikutusta. Rakenne ei vielä sisällä yhdenkään sivuketjun orientaatiota, mutta helisten järjestely viittaa alayksikön sähköstaattisiin vuorovaikutuksiin.6 kuva 3, osoittaa, miten sytoplasma domeeni vertaa välillä avoin kanava vs. suljettu kanava, jossa on kaksi bakteerikanavaa.7 muu paperi keskittyy transmembrane domain, joka valitsee kaliumia.
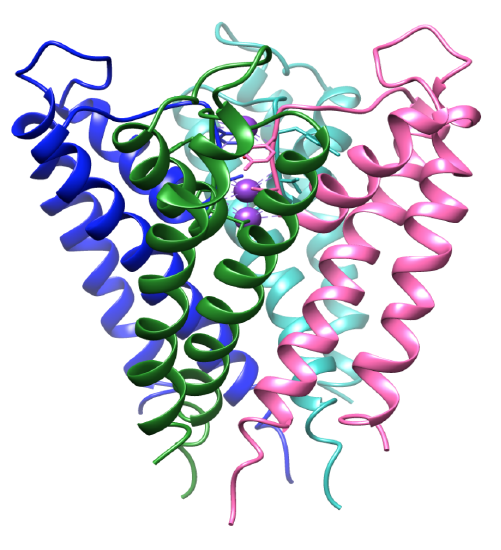
kuva 3. Transmembrane domain. Jokainen alayksikkö on väritetty eri tavalla ja kaliumionit ovat violetteja. PDB 1BL8.
kaliumionien selektiivisyys perustuu voimakkaasti kaliumkanavan selektiivisyyssuodattimen rakenteeseen. Kanavan koordinaatioympäristössä on selektiivisiä ligandeja, jotka sitoutuvat nimenomaan kaliumioneihin.8 kaliumkanavaproteiini on tetrameeri, joka sisältää neljä samanlaista alayksikköä, jotka muodostavat keskihuokoset.8-9 ionit virtaavat huokoseen, joka avautuu ja sulkeutuu ohjaten ionit keskusonteloon. Alayksiköissä on kaksi alfa-heliksiä, joissa toinen kohtaa keskihuokoset, sisempi helix, ja toinen kohtaa lipidikalvon, joka tunnetaan myös ulompana helixinä.3 yhdessä sisä-ja ulompi kierteet, jokainen alayksikkö sisältää huokoskierre.3,8 alayksiköt ovat kallellaan, kuten kuvassa 3 esitetään, kun selektiivisyyssuodatin on lähellä kalvon solunulkoista pintaa. Neljä sisäkierrettä rakentuvat siten, että ne tulevat yhteen lähellä solunsisäistä pintaa. Happamat aminohapot lataavat negatiivisesti sekä solunsisäisiä että solunulkoisia sisäänkäyntejä. Tämä mahdollistaa suuremman pitoisuuden kationeja lähellä kalvoa ja vähemmän anioneja, koska vastakkaiset varaukset.8

Kuva 4. Kalium kanava (KCSA rakenne Streptomyces lividans) tärkeimmät rakenneosat merkitty. Tärkeimmät huomioitavat näkökohdat ovat huokos -, ontelo-ja selektiivisyyssuodatin (SF). Nämä ovat kanavan osia, joiden läpi kaliumionit kulkevat. Ensin ioni virtaa huokosen läpi ja tulee onkaloon hydratoituna huokosen ollessa auki. Sitten kaliumioni kuivataan ja valitaan kulkemaan SF: n läpi, josta se sitten pääsee soluun. Huomaa, että kuvassa näkyy vain kaksi alayksikköä visualisoinnin helpottamiseksi. PBD 1K4C.
huokosalueella havaittiin ensin huokosia salpaavia skorpionimyrkkyjä. Ne vuorovaikuttavat huokosten suulla olevien aminohappojen kanssa aiheuttaen estoja ja toimintahäiriöitä. Huokoseen astuu kaliumioni, josta se siirtyy keskusonteloon, kuten kuvassa 4 nähdään. Tänä aikana kaliumioni pysyy hydratoituneena.8 solunsisäinen huokos on kanavan ominaisuus, joka mahdollistaa kaliumionien pääsyn soluun, kun se on auki, tai estää pääsyn, kun se on suljettu. Kanavat avautuvat, kun kalvon potentiaali muuttuu, jolloin kaliumioneja pääsee sisään ontelosuodattimeen. Kun selektiivinen sitoutuminen tapahtuu selektiivisessä suodattimessa, potentiaali putoaa kalvon poikki, jolloin huokonen sulkeutuu.1 huokos ja ontelo ovat hydrofobisesti vuoratut, jolloin kyky alentaa sähköstaattista estettä. On oltava pienempi sähköstaattinen este, joten nestehukan energiakustannukset kompensoidaan ionipermeaation suuren energiaesteen (Dielektrinen este) vuoksi. Näin ollen vedellä täytetty onkalo mahdollistaa energeettisesti suotuisan ympäristön.3,8,10,11
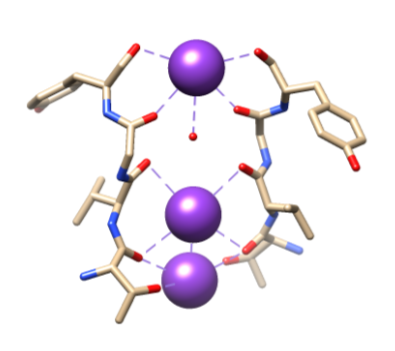
kuva 5. Kaliumionien (purppuranpunaisten) sitoutuminen tiettyihin ligandeihin thr 75: n, Val 76: n, Gly 77: n ja Tyr 78: n selkärangan o: n avulla. Täydellinen koordinointi ei näy tässä helpompaa visualisointi. Kopio Samsomista.11
seuraavaksi ionit on valittava selektiivisyyssuodattimeen (SF), joka on vuorattu aminohappoihin kuuluvilla polaarisilla pääketjuatomeilla. Sf on niin kapea, että ionit on ensin dehydratoitava ennen sinne pääsyä. SF: ssä on kaksi olennaista piirrettä. Ensinnäkin pääketjuatomit luovat sopivat mitat dehydratoidun kaliumionin koordinoimiseksi pinoamalla, jolloin muodostuu peräkkäisiä happirenkaita. Tämä luo hyvin pienen etäisyyden, jonka kaliumionin on kuljettava päästäkseen kuhunkin paikkaan kulkiessaan suodattimen läpi. Tämä muodostaa neljän kuution kahdeksanosaisen koordinaatiopaikkojen sarjan, kuten kuvassa 6 nähdään.3,8 milloin tahansa, nämä sivustot ovat käytössä kaksi K + ioneja ja kaksi vesimolekyyliä vuorotellen järjestyksessä toinen ominaisuus on proteiini pakkaus noin SF, joka seuraa järjestyksessä T-V-G-Y-G, kuvassa 5.9 johtuminen voi sitten tapahtua, kun kaksi kaliumioneja tulee SF, aiheuttaa tasapainon houkutteleva voima, joka tapahtuu SF ionin kanssa hylkivä voima, joka tapahtuu kahden kaliumioneja.8 Tämä hylkimisreaktio auttaa kaliumioneja voittamaan sen sisäisen affiniteetin sitoutumiseen tiukasti sitoutumiskohtiin.3 jäljempänä käsitellään valintamekanismia.
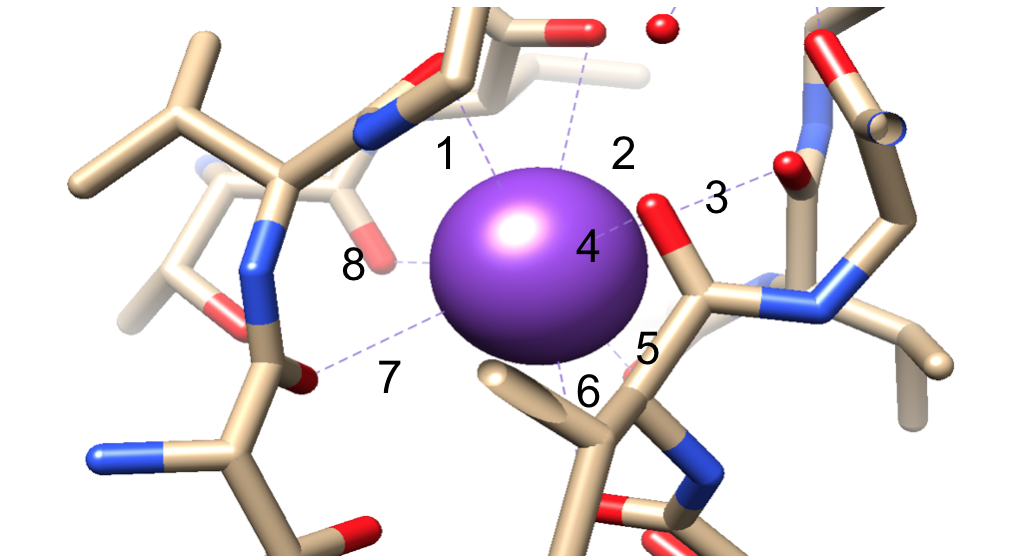
kuva 6. Yksi esimerkki kaliumionista (violetti) kahdeksanosaisessa koordinaatiopaikassa. Sitova numeroitu helpottaa visualisointia.