Johdanto
sydänlihaksen nekroosin merkkiaineiden riittävä tulkinta on välttämätöntä epäiltyä akuuttia koronaarioireyhtymää (ACS) sairastavien potilaiden diagnosoinnissa, kerrostumisessa ja hoidossa. Akuutin sydäninfarktin (ami) sydänmerkkiaineita koskevat protokollat viittaavat AMI: n kolmanteen universaaliin määritelmään.
tässä asiakirjassa todetaan, että sydämen troponiinin (ctn) nousu ja lasku on olennaisen tärkeää iskeemisten oireiden, elektrokardiografisten muutosten tai kuvantamistutkimuksessa äskettäin ilmenneiden segmentaalisten muutosten yhteydessä.1
teknologiset edistysaskeleet cTn: n määrittämisessä ovat parantaneet kykyä havaita ja kvantifioida sydänlihaksen soluvaurioita. CTn-arvojen nousukriteerit riippuvat käytetystä testistä, ja ne on määriteltävä kunkin testin tarkkuusprofiilin perusteella, mukaan lukien herkkyystestaus.2 on olemassa erilaisia kaupallisia ctn-immunomäärityksiä, joissa on erilaiset prosenttipisteet 99 (p99) pitoisuudet; se, että jotkut laboratoriot käyttävät erilaisia viittauksia sydänlihasvauriotestituloksiin (”normaali”, ”määrittelemätön” tai ”vihjaileva”); ja ctn-testauksen mielivaltainen käyttö suurissa populaatioissa, joilla on hyvin erilaiset todennäköisyydet ACS: n esiintymiselle, on omiaan aiheuttamaan sekaannusta kliinisen hoidon yhteydessä.
on huomattava määrä potilaita, joilla AMI: n puuttuessa cTn-pitoisuus on kuitenkin>p99. Näillä potilailla on yleensä sydän-ja verisuonitautien riskitekijöitä, ja komplikaatioiden likeliness tällaisilla henkilöillä on samanlainen kuin potilailla, joilla on ACS.3
viimeisimmissä eurooppalaisissa suosituksissa, jotka koskevat akuuttien sepelvaltimotautikohtausten (nste-ACS) hoitoa potilailla, joilla ei ole St-nousua, suositellaan korkean herkkyyden cTn: n (hs-cTn) käyttöä tavanomaisiin tai neljännen sukupolven (4G) troponiineihin verrattuna, ja niissä harkitaan enintään kahta algoritmia (0h/3h, 0h/1h) AMI: n vahvistamiseksi (rule in) tai poissulkemiseksi (rule out).
sydämen troponiinit ovat erittäin spesifisiä sydänlihasvaurioille. Kuitenkaan millään tavalla sydänlihasvaurio ei ole yksinomaan ACS: n aiheuttama. Kliinisissä ohjeissa korostetaankin, että cTn-pitoisuutta on tulkittava potilaan oireiden perusteella. Tässä suhteessa kohonneet cTn-pitoisuudet potilailla, joilla on sepsis, hypertensiivinen kriisi, keuhkoembolia jne., ovat osoitus sydänlihasvauriosta, mutta eivät sydäninfarktista, eikä niitä tulisi käyttää ACS: n erityishoitojen osoittamiseen.5
termi ”korkea herkkyys” olisi varattava niihin immunomäärityksiin, joilla voidaan määrittää P99, jonka variaatiokerroin (CV) on 6
. tiedeyhteisössä epäillään, merkitseekö hs-cTn: n käyttö merkittävää kliinistä parannusta ja merkitseekö se enemmän testejä ja keskinäisiä kuulemisia.7 Tämä tutkimus toteutettiin korkean herkkyyden troponiini T: n (hs-TnT) diagnostisen suorituskyvyn arvioimiseksi, sen määrittämiseksi, lyhentääkö se aikaa diagnoosiin ja analysoidakseen sen käytön kliinisiä seurauksia.
menetelmä
Hospital clínicon (Valencia), Hospital Clínicon (Málaga), Hospital Severo Ochoan (Leganés), Hospital Sant Paun (Barcelona) ja Hospital Miguel servetin (Zaragoza) (Espanja) sairaaloissa(Hospital) tehtiin prospektiivinen, pitkittäissuuntainen havainnointitutkimus, johon osallistui Tuscan (Troponina Ultrasensible en el SCA) trial8: n potilaita kesäkuun 2009 ja huhtikuun 2010 välisenä aikana. Tutkimus toteutettiin Helsingin julistuksen periaatteiden mukaisesti, ja siihen osallistuneiden keskusten paikalliset eettiset toimikunnat hyväksyivät sen. Kaikilta potilailta saatiin kirjallinen tietoon perustuva suostumus. Me sisällytimme peräkkäin yli 18-vuotiaat potilaat, jotka olivat HES: ssä nste-ACS: ään viittaavan rintakivun vuoksi. Potilasrekisteröinti tehtiin HES: n alkuhoidon aikana, kun mukaan ottaminen ja poissulkemiskriteerit oli arvioitu. Potilaiden johtamisessa ja soveltavassa hoidossa noudatettiin sisäisiä protokollia, jotka perustuivat European Society of Cardiology-yhdistyksen konsensusoppaisiin, aina potilaista vastaavien lääkäreiden ohjeiden mukaisesti ja täysin riippumattomasti tutkimukseen osallistumisesta. ACS: n diagnosointia varten tehtiin 4G: n cTn: n sarjamääritykset kunkin Keskuksen rutiininomaisten kliinisten ja immunomäärityskäytäntöjen mukaisesti.
potilasominaisuudet oli merkitty tapausraporttilomakkeeseen, joka käsitti väestötiedot, oireiden alkamisajankohdan, riskitekijät (valtimoverenpaine, diabetes mellitus , krooninen obstruktiivinen keuhkosairaus, sydämen vajaatoiminta ja munuaisten vajaatoiminta). Tallennimme myös EKG-ominaisuudet kivun kanssa ja ilman kipua sekä tiedot, jotka on tarkoitettu hoitoon ensihoidon jälkeen (katetrointi, angioplastit, ohitusleikkaus jne.), lopullinen diagnoosi ja potilaan määränpää.
potilaat, joilla oli ST-segmentin nousu ACS, suljettiin pois, samoin kuin potilaat, joilla oli juuri ilmennyt vasen nipun lohko, defibrillaatio tai sydämen rytminsiirto ennen ensimmäisiä laboratoriomäärityksiä, sydänleikkaus kolmen viikon aikana ennen sisäänpääsyä, raskaana olevat naiset, vaikeaa kognitiivista heikkenemistä sairastavat potilaat ja kroonista munuaisten vajaatoimintaa sairastavat potilaat, joille tehtiin hemodialyysi.
ensimmäisen 12 tunnin oleskelun aikana HES: ssä, teho-osastolla tai sairaalaosastolla otettiin sarjaverinäytteitä hs-TnT: n mittaamista varten seuraavan protokollan mukaisesti:
- –
Näyte T0. HES: n ensiavun yhteydessä.
- –
Näyte T1. Kaksi tuntia näytteenottoajankohdan 0 jälkeen tai välittömästi ennen pääsyä johonkin sairaalayksikköön (teho-osastolle tai osastolle).
- –
Näyte T2. Välillä 4 ja 6h näytteenoton jälkeen aikapiste 0 tai juuri ennen pääsyä johonkin sairaalayksikköön.
- –
Näyte T3. 8-12 tunnin kuluttua näytteenottoajankohdasta 0, jos potilas oli vielä palveluksessa, tai välittömästi ennen pääsyä johonkin sairaalayksikköön tai potilaan kotiuttamishetkellä HES: stä.
verta kerättiin riittävästi, jotta jokaisesta potilaan näytteestä saatiin 5 alikiintiötä 0, 5 ml heparinisoitua plasmaa rutiinitestaukseen tarvittavan näytteen lisäksi. Aliquotit jäädytettiin -80°C: ssa, ja ne tunnistettiin kunkin Keskuksen koodilla: kolme numeroa, jotka vastasivat potilaan numeroa ja keräysaikaa (T0, T1, T2 tai T3) kyseisen näytteen mukaan. Potilasta kohti saatiin keskimäärin 3,7 näytettä. Kaikki näytteet siirrettiin ydinlaboratorioon (Hospital Sant Pau, Barcelona) 4G cTn: n ja hs-TnT: n analysointia varten, ja kustakin keräyksestä sai kulua enintään kuukausi. Kaikki sairaalat suorittivat tuolloin käytössä olleen rutiininomaisen 4G cTn-testin (2 keskusta cTnT: llä ja 3 ctni: llä). Lopullisen potilasdiagnoosin laati asiantuntija, joka perustui kaikkiin kliinisiin tietoihin, jotka saatiin kunkin Keskuksen johtavan tutkijan täyttämässä tapausraporttilomakkeessa, joka heijasti kliinisiä ja EKG-tietoja, sekä ydinlaboratoriossa tehtyyn keskitettyyn 4G cTn-määritykseen. Asiantuntija sokaistui hs-TTN: n selvityksistä.
infarkti todettiin, kun cTnT-pitoisuus oli noussut tai pienentynyt >20% (Δ-kriteeri) useiden näytteiden joukossa, ja ainakin yksi arvo oli suurempi kuin P99 viiteväestön osalta (≥ 0, 01 µg/l). Epästabiili angina pectoris (UA) diagnosoitiin potilailla, joilla oli kliinistä näyttöä sydänlihasiskemiasta ilman positiivista 4G cTn: ää. UA: ta sairastavilla potilailla oli aikaisemmin todettu lepoinfarkti, aiemman kroonisen angina pectoriksen paheneminen, iskemiaan viittaavia ST-segmentin muutoksia ilman biomarkkerin vaihteluita (kinetiikka), positiivisia iskemian toteamistestejä tai sepelvaltimon ahtauma>70%, kuten sepelvaltimon varjoainekuvaus osoitti. CTnT-tasot puolestaan mitattiin korkean herkkyyden tekniikalla Cobas e601-analysaattorilla (hs-TnT, Roche Diagnostics, Basel, Sveitsi). Menetelmän toteamisraja on 5, 0 ng/l, ja kliinisenä päätösrajana käytetty viite p99 oli 13, 0 ng/l. näiden cTn-testien analyyttistä epätarkkuutta arvioitiin 20 toistolla 8 näyteryhmässä, joiden loppupitoisuudet oli säädetty niin, että ne kattoivat alueen 7-928ng/l, jolloin suuri cTnT-pitoisuus laimennettiin seerumipoolilla, jossa HS-TnT-tasot olivat alle havaitsemisrajan (
ng / l). CTnT-testin P99 (10ng/l=0,01 µg / l) mitattiin variaatiokertoimella (CV) 15,2%. Arvo CV 10%: lla oli 35ng/l=0,035 µg/l. Hs-TnT-testin P99 (13ng/l) CV: ksi mitattiin 6,9%.
esiintymistiheydet ja prosenttiosuudet laskettiin kvalitatiivisten muuttujien kuvailevaa analyysia varten, ja kvantitatiivisten muuttujien kohdalla keskeisimmät trendimittarit. Tiedot ilmaistiin keskiarvona ja keskihajontana (SD) normaalijakauman ollessa kyseessä ja mediaanina ja kvartiilien välisenä vaihteluvälinä (IQR) muun kuin normaalijakauman tapauksessa, kuten Kolmogorov-Smirnov–testi osoitti.
kvantitatiivisten muuttujien vertailu perustui oppilaan t–testiin tai Mann-Whitneyn U-testiin normaalin tietojakauman läsnä ollessa tai sen puuttuessa. Kvalitatiivisten muuttujien vertailu puolestaan perustui soveltuvin osin chi-potenssitestiin tai Fisherin eksaktitestiin.
kaikissa tapauksissa tilastollisen merkitsevyyden tasoksi määriteltiin 5% (α=0, 05%) kaksipyrstötestissä.
4G: n cTn-ja hs-TnT-erottelututkimus tehtiin laskemalla pinta-ala (AUC) vastaanottimen toimintaominaisuuskäyrän (Roc) mukaisesti eri näytteenottoajankohdilla, ja vastaava 95 prosentin luottamusväli (CI). Näiden käyrien merkitystä arvioitiin laskemalla AUC: n luottamusväli ja määrittelemällä merkitseviksi arvot alueella, jonka alaraja on yli 0, 5%. ROC-käyrän alaisten alueiden vertailu tehtiin tutkimalla CI-arvojen päällekkäisyyttä.
diagnostista suorituskykyä arvioitiin laskemalla herkkyys, spesifisyys sekä positiiviset ja negatiiviset ennustearvot. 95%: n luottamusväli laskettiin näiden mittareiden suuruuden kliinistä arviointia varten – aikaväliä pidettiin merkittävänä, koska arvot eivät olleet päällekkäisiä.
tulokset
tutkimukseen osallistui yhteensä 351 potilasta; miehiä oli 234 (67, 9%) ja keski-ikä oli 65, 7 vuotta. Tärkeimmät demografiset tiedot ja sydän-ja verisuonitautien riskitekijät on koottu taulukossa 1. Lopullinen AMI-diagnoosi tehtiin 77 potilaalla ja UA 102 potilaalla. Yhteensä 172 potilaalla todettiin, ettei heillä ollut ACS: ää.
tutkimusnäytteen ominaisuudet ja sydän-ja verisuonitautien riskitekijät.
| muuttujat | yhteensä | ei ACS | epästabiili angina pectoris | AMI | p |
|---|---|---|---|---|---|
| Ei. potilaat n (%) | 351 | 172 (49) | 102 (29.1) | 77 (21.9) | – |
| Ikä (mediaani) | 66 (27-93) | 64.4 (27-93) | 71 (31-90) | 73 (36-88) | |
| miehet, % | 67.9 | 61.5 | 73.5 | 74 | |
| sairaushistoria n (%) | |||||
| AHT | 220 (62) | 101 (58.7) | 73 (71.6) | 46 (59.6) | NS |
| Diabetes | 92 (26.2) | 38 (22.1) | 35 (34.3) | 19 (24.7) | NS |
| sydämen vajaatoiminta | 52 (14.8) | 20 (11.6) | 20 (19.6) | 12 (15.6) | NS |
| Glomerulussuodosnopeus (ml / min / 1. 73m2) | 79.6 | 81.9 | 80.7 | 72.9 | |
| TnT µg / l (mediaani) | 0.285 (0.01–6.87) | 0.009 (0.001–0.46) | 0.009 (0.009–0.03) | 0.066 (0.009–6.870) | |
| Hs-TnT ng / l (mediaani) | 63.87 (2.99–7.096) | 5.5 (1.2–481.6) | 11.69 (1.99–66) | 90.4 (2.9–7.096) | |
| NT-proBNP pg / ml (mediaani) | 1.130 (5.46255) | 141 (5-13.302) | 238.5 (16.4–9.164) | 589 (41-46.255) | |
| sydänsähkökäyrä, johon liittyy kipua (70.67%) | |||||
| normaali | 103 (41.1) | 70 (61.4) | 22 (27.5) | 11 (20) | |
| t negatiivinen | 57 (23) | 21 (18.6) | 23 (28.8) | 13 (23.6) | |
| ↓ lä | 60 (24.5) | 9 (8) | 26 (32.6) | 25 (45.4) | |
| oireiden kehitys (min.) (88%) | |||||
| ≤ 3h (%) | 46 | 63 (42) | 43 (44.8) | 41 (55.4) | 0.16 |
| >3h (%) | 57 | 87 (58) | 53 (55) | 33 (44.6) | NS |
| Catheterization | 36.9 | 12 (7) | 64 (62.7) | 53 (68.8) | |
| Angioplasty | 20.9 | 2 (1.2) | 29 (28.4) | 41 (53.2) | |
| Stent | 18.7 | 1 (0.6) | 28 (27.5) | 35 (45.5) | |
| ohitus | 2.2 | 0 | 4 (3.9) | 4 (5.2) | |
| päivystyksen kotiutus | 41.1 | 128 (74.7) | 10 (10.9) | 5 (6.6) | |
| kotiutus sairaalasta | 57.8 | 44 (25.3) | 92 (88.1) | 72 (91) | |
| kuolema | 1.1 | 0 | 1 (1.9) | 3 (3.8) | |
AHT: valtimon hypertensio; AMI: akuutti sydäninfarkti; NS: Ei-merkittävä; nt-proBNP: aivojen natriureettinen peptidi; ACS: akuutti koronaarioireyhtymä; TnT: t-troponiini; hs-TnT: korkea herkkyys troponiini T.
SYDÄNINFARKTIPOTILAISTA 55, 4% saavutti HES: n kolmen ensimmäisen tunnin aikana, kun taas sekä UA: ta sairastavista että niistä, joilla ei ollut ACS: ää, suurempi osuus saapui kolmen tunnin kuluttua. Mitä tulee merkkiaineiden positiivisuuteen lopullisen diagnoosin mukaan, 87%: lla potilaista, joilla oli lopullinen AMI-diagnoosi, todettiin 4 g cTn>0, 035 µg/l tutkimuksen ensimmäisen 12 tunnin aikana. Positiivisuutta kirjattiin 4%: ssa potilaista, joilla ei ollut ACS: ää ja joilla oli UA: ta. Hs-TnT-pitoisuus oli >13ng/l (p99) 26, 7%: lla potilaista, joilla diagnosoitiin ei-ACS ja UA (Kuva. 1). Toisaalta 4G cTn käyttäen p99: ää, jonka Katkaisupiste on 0.01µg / l (tutkimuksen kultakanta) osoittautui positiiviseksi 16 prosentilla potilaista, joilla diagnosoitiin UA ja 11 prosentilla potilaista, joilla ei ollut ACS: ää.
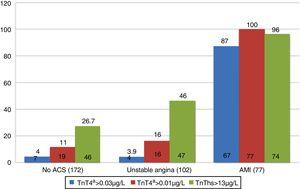
Merkkipositiivisuus lopullisen diagnoosin mukaan. AMI: akuutti sydäninfarkti; ACS: akuutti koronaarioireyhtymä; TnT: troponiini T; hs-TnT: korkea herkkyys troponiini T.
sovellettaessa kinetiikkaa joihinkin neljään määritykseen (Δ-kriteeri) 21, 5%: lla UA-potilaista todettiin hs-TnT: n nousu+Δ (Fig. 2).

merkkiaineiden positiivisuus + Δ lopullisen diagnoosin mukaan. AMI: akuutti sydäninfarkti; ACS: akuutti koronaarioireyhtymä; TnT: troponiini T; hs-TNT: erittäin herkkä troponiini T.
ensimmäisessä mittauksessa (T0) hs-TnT: n diagnostinen herkkyys oli merkitsevästi suurempi kuin 4 g cTn: n (CV) (87, 0%; 83, 0–90, 3% vs. 42, 9%; 37, 6–48, 2%; p
0, 05), jolloin negatiivinen ennustearvo oli 95, 1%. Sen spesifisyys (71, 5%; 66, 5–76, 2% vs. 97, 4%; 95, 2–98, 8%; p0.05) ja positiivinen ennustearvo (46, 2% vs. 82, 5; p0.05) olivat kuitenkin selvästi alhaisemmat kuin 4 g cTn: n (CV). Analysoitaessa ROC-käyrän alaista aluetta hs-TnT: n havaittiin olevan parempi kuin 4G cTn (CV) (0.792; 0.746–0.833 vs. 0.701; 0.650–0.748) (viikunat. 3 ja 4).
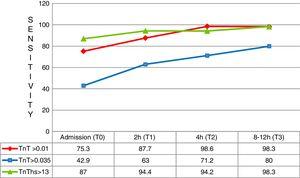
herkkyys eri testiaikoina. TNT: troponiini T; hs-TNT: erittäin herkkä troponiini T.
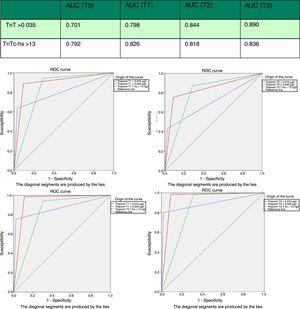
hs-TnT: n ja TnT 4G: n käyrän alle jäävä pinta-ala (AUC) näytteenotto-ja vastaanottimien toimintaominaisuuskäyrissä (Roc). AUC: käyrän alle jäävä pinta-ala; TnT: troponiini T; hs-TnT: erittäin herkkä troponiini T.
kahden tunnin kuluttua potilaan saapumisesta HES-hoitoon (T1) hs–TnT: n diagnostinen herkkyys oli edelleen paljon suurempi kuin 4 g cTn: n (94, 4%; 91, 3–96, 6 vs. 63, 0%; 57, 6-68, 2; p0.05). Hs-TnT: n negatiivinen ennustearvo oli käytännössä absoluuttinen (97, 9%), ja sen diagnostinen tarkkuus oli yleensä parempi kuin 4G cTn: n (ROC 0, 826 vs. 0, 798). HS-TnT: n heikko spesifisyys johti alhaiseen positiiviseen ennustusarvoon (46,5%). Loput näytteenottotulokset osoittautuivat samansuuntaisiksi, joskin ne kuvastivat heikompaa diagnostista suorituskykyä.
ensimmäisten kolmen tunnin aikana oireiden alkamisesta saapui yhteensä 41 potilasta, joilla oli lopullinen AMI-diagnoosi. Näissä tapauksissa hs-TnT: n parempi diagnostinen herkkyys suhteessa 4G cTn: ään (CV) ja myös 4G cTn: ään (p99) oli erityisen merkittävä: herkkyys oli 87, 8% verrattuna 36, 6%: iin ja 73, 2%: iin (Kuva. 5).
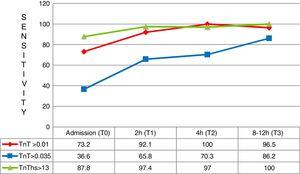
herkkyys eri testiaikoina potilailla, joilla oireet alkavat min. TNT: troponiini T; hs-TNT: erittäin herkkä troponiini T.
potilailla, joilla oli sydäninfarkti, jolla ei ollut St-nousua (n=36) ja joiden kehitysaika oli pitkä (> 3 h), HS-TnT: n diagnostinen tarkkuus oli heikompi (heikomman spesifisyyden vuoksi) kuin potilailla, joilla oireiden alkamisesta oli lyhyempi aika. Kinetiikkaa sovellettaessa havaittiin jälleen spesifisyyden lisääntymistä, jolloin AUC kasvoi. Näin ollen hs-TnT: n tapauksessa aloitimme spesifisyyden 69%: lla ja Δ: n soveltamisessa spesifisyys saavutti 85%, positiivinen ennustearvo 55,3%, mikä paransi yleistä diagnostista suorituskykyä (Taulukko 2).
sydämen eri troponiinien kinetiikka (Δ) potilailla, joiden oireiden alkaminen on >180min.
| herkkyys | spesifisyys | PPV, % | NPV, % | AUC | |
|---|---|---|---|---|---|
| ttnt>0, 01 + Δ | 100% (97.9–100) | 96.4% (92.4–98.6) | 86.8 | 100 | 0.982 |
| ttnt>0, 035 + Δ | 81.8% (75.2–87.2) | 97.9% (94.4–99.4) | 90.0 | 95.8 | 0.898 |
| hs-TnT>13 + Δ | 78.8% (71.9–84.6) | 85.0% (78.8–89.9) | 55.3 | 94.4 | 0.818 |
AUC: käyrän alle jäävä pinta-ala; cTnT: sydämen troponiini T; hs-TnT: korkea herkkyys troponiini T; PPV: positiivinen ennustearvo; NPV: negatiivinen ennustearvo.
lisäksi arvioimme ROC-analyysistä saadut optimaaliset raja-arvot. Optimipisteeksi vahvistettiin 37ng / l (hs-TnT-ROC) (Taulukko 3). Hs-TnT-Rocin arvoksi ilmoitettiin herkkyys 59.7% – huomattavasti alle hs-TnT: n mutta suurempi kuin 4G TnT: n (CV) – ja 95,3%: n spesifisyys ensimmäisessä mittauksessa. Tämä suurempi herkkyys 4G TnT: n (CV) suhteen säilyi myös muissa näytteenotoissa.
hs-TNT ROC: n diagnostisen suorituskyvyn vertailu (> 37).
| T0 | Sensitivity, % | Specificity, % | EFF, % | LR+ | LR− | PV+, % | PV−, % |
|---|---|---|---|---|---|---|---|
| cTnT>0.01 | 75.3 | 91.2 | 87.7 | 8.60 | 0.27 | 70.7 | 92.9 |
| cTnT>0.035 | 42.8 | 97.5 | 85.5 | 16.8 | 0.59 | 82.5 | 85.8 |
| hs-TnT>13 | 87 | 71.5 | 74.9 | 3.1 | 0.18 | 46.2 | 95.1 |
| hs-TnT>37 | 59.7 | 95.3 | 87.5 | 12.6 | 0.42 | 78 | 89.4 |
ttnt: sydämen troponiini T; hs-TnT: korkea herkkyys troponiini T.
ajan säästö diagnoosin saavuttamisessa käytettäessä hs-TnT vs. 4G cTn (CV): tä oli 113min. Säästö puolestaan olisi 147min (p0.001) potilailla, jotka otetaan alle 3h oireiden alkamisesta, ja 63min (P=0, 024) potilailla, jotka otetaan yli kolme tuntia oireiden alkamisesta.
Keskustelu
tässä tutkimuksessa saadut tiedot pystyvät selventämään tiettyjä hs-TnT: n käyttöä päätöksenteossa koskevia kysymyksiä, koska on vahvaa näyttöä sen hyödyllisyydestä diagnosointi-ja ennustusvälineenä ACS: ssä. Hs-TnT: n diagnostinen suorituskyky oli lopulta suurempi kuin 4G cTn: n kullakin näytteenottoajalla. Suorituskyvyn puolestaan nähtiin heikkenevän oireiden alkamista seuraavien tuntien aikana. Tutkimuksessamme käytimme suhteellisia muutoksia kahden näytteen välillä (erityisesti 20%), jotka hienosäätöisesti paransivat positiivista ennustavaa arvoa, joskaan siitä ei ollut käytännön hyötyä. Tässä suhteessa 20%: n Δ voi olla liian pieni, ja kuten jotkut kirjoittajat ehdottivat, olisi voinut olla suositeltavaa nostaa Δ suurempaan prosenttiosuuteen, koska monissa tapauksissa AMI: n havaittiin olevan arvoltaan huomaamattomasti korkeampi kuin yläraja (URL).9,10 muut tutkijat ehdottavat Δ: n suhteellisia muutoksia (30-250%) diagnostisen spesifisyyden lisäämiseksi ja AMI: n diagnoosin parantamiseksi.11-14 Mueller ym.15 julkaistuja tuloksia, jotka selittävät, miksi Δ: n suhteelliset muutokset eivät riitä määritettäessä sydäninfarktia, jossa ei esiinny ST: n nousua. Kun käytetään absoluuttisia Δ-muutoksia, vähintään 9, 2 ng/l: n lisäys tai lasku ACS: ää ja muuta kuin ACS: ää sairastavien potilaiden populaatiossa tai 6, 9 ng/l: n lisäys tai lasku ACS: ää sairastavien potilaiden populaatiossa näyttää riittävän paremmin kuin suhteellinen Δ-muutos AMI: n poissulkemiseen. Näiden spesifisyyden vähenemisen ongelmien lisäksi URL-osoitteissa on eroja käytetyn testin mukaan. Tämä korostaa rodun, sukupuolen, iän tai tutkimukseen osallistuneiden määrän merkitystä,16, ja lisää konsensuksen saavuttamisen vaikeutta päätöksenteossa.
tutkimuksessamme todettiin, että hs-TnT: n herkkyyden paremmuus ei-St-kohonneen sydäninfarktin diagnosoinnissa on suurempi potilailla, joilla on äskettäin alkanut oireita, yhtäpitävästi muiden tekijöiden havaintojen kanssa.17,18 potilaalle, joka raportoi rintakipua alle kolme tuntia, ja toinen negatiivinen määritys kaksi tuntia saapumisen jälkeen, voimme sulkea pois AMI lähes 100% tapauksista. Tämä yhdistettynä kliinisiin ja EKG-löydöksiin voi tunnistaa ennenaikaisen vastuuvapauden ja avohoidon ehdokkaat. Toisaalta potilaat, joilla on diagnosoitu ei-ST-nousu sydäninfarkti ja joilla on pitkä kehitysaika (yli 3 h), osoittavat heikompaa diagnostista tarkkuutta hs-TnT: llä, vaikka tehtäisiin kaksi sarjamääritystä. Näissä tapauksissa meidän olisi arvioitava ROC-analyysistä saatavat optimaaliset raja-arvot. Tutkimuksessamme cut-off-Piste oli 37ng / l, mikä antaisi meille mahdollisuuden ”rule in”, eli potilailla, joiden pistemäärä ylittää tämän cut-off-pisteen, olisi erittäin suuri todennäköisyys esittää AMI. On myös väitetty, että tämä spesifisyyden väheneminen on aliarvioitu kirjallisuudessa ja että se ei heijasta potilaita, joita on havaittu sairaaloissamme, joissa keski-ikä, liitännäissairaudet ja cTn-arvot ovat yleensä korkeita.
diagnosointiin kulunut aika on lyhentynyt huomattavasti (247: stä 71: een.5min).19,20 tutkimuksessamme aikasäästö ei-St-kohonneen sydäninfarktin diagnosointiin oli 147min potilailla, jotka raportoivat alle kolmen tunnin kuluttua oireiden alkamisesta, ja 63min potilailla, jotka raportoivat 3 tunnin kuluttua.
kaksikymmentäkaksi potilaista (21, 5%), joilla oli UA-diagnoosi kotiutushetkellä, oli ei-St-kohonneita sydäninfarkteja kahden hs-TnT: n määrityksen jälkeen, joiden kinetiikka oli yli 20%. Enintään 13.9%: lla potilaista, joilla ei ole ACS-oireyhtymää (n=24), olisi HS-TnT-positiivisuutta tällaisen kinetiikan soveltamisessa, ja se vastaisi muita etenevää sydänvauriota aiheuttavia tautitiloja, kuten sydänlihastulehdusta, keuhkoemboliaa tai takotsubo-oireyhtymää. Erilaiset hs-TnT-analyysit havaitsevat jopa 27% enemmän AMI-tapauksia kuin nykyinen menetelmä potilailla, joilla on rintakipua ja alhainen tai keskitason todennäköisyys ACS: lle.20,21 voidaan jopa spekuloida, että UA: n diagnoosi katoaisi, kuten sabatine et al.22 potilailla, joilla oli positiivinen rasituskoe, joka arvioitiin ultraäänitutkimuksella. Tässä tutkimuksessa hs-TNI oli havaittavissa kaikilla potilailla ennen testejä; pysyi muuttumattomana potilailla, joilla ei ollut iskemiaa; ja kasvoi 24% potilailla, joilla oli lievä iskemia ja 40% potilailla, joilla oli kohtalainen tai vaikea iskemia. Muutoksia ei havaittu 4G cTn: n käytön yhteydessä. Tämän vuoksi tulokset, joihin viitataan ei-St-nousuinfarktin diagnosoinnissa tavanomaisella cTn: llä, ovat huolestuttavia, koska sydänlihasvaurio on rajallinen, eivätkä ctn-arvot aina nouse aikaisin tai niiden lisäykset eivät riitä varhaisen tunnistamisen mahdollistamiseen.
Pikaliuosprotokollat tulisi ottaa käyttöön, jolloin potilaamme, joilla on alhainen iskeeminen riski ja normaali EKG–seuranta, viettäisivät sairaalassa vain 3-4h.23,24 on pohdittu,riittääkö yksi hs-TnT-määritys AMI: n poissulkemiseen, 25 ja muissa tutkimuksissa on arvioitu yhden määrityksen mahdollisuutta, jos hs-TnT-arvo on
ng/l (eli ei havaittavissa).24 Kaikki nämä tilanteet on otettava huomioon tulevaisuudessa.Päätelmät
korkea herkkyys troponiini-T-testi parantaa diagnostista suorituskykyä, lyhentää sydäninfarktin diagnosointiin kuluvaa aikaa ja pystyy tunnistamaan suuremman määrän potilaita, joilla on pienempi infarkti, joka on aiemmin diagnosoitu UA: ksi ja joilla on suuri kuolleisuusriski verrattuna tavanomaiseen infarktiin. Lisäksi se lyhentää tapausten poissulkemisaikaa, koska AMI voitaisiin hävittää 2h: n kuluessa. kaikki tämä edellyttää aikaisempaa hoitoa potilaille, joilla on sydänlihaskuolio ja potilaan oleskelun lyhentäminen HES: ssä. Kuitenkin niillä henkilöillä, jotka raportoivat HES: lle kolmen tunnin oireiden alkamisen jälkeen, hs-TnT ei pystyisi parantamaan 4G-cTn: n diagnostista suorituskykyä, ja päätöksenteon olisi siksi oltava varovaisempaa. Hs-cTn-testit muuttavat ACS: ään viittaavaa rintakipua sairastavien potilaiden hoitoa ja konseptia. Tämän vuoksi hätä-ja kriittisen hoidon lääkäreiden on perehdyttävä rutiinikäyttöön.
eturistiriita
kirjoittajat ilmoittavat, ettei heillä ole eturistiriitoja.