Johdanto
tyypin 5 fosfodiesteraasin (PDE5) entsymaattinen vaikutus on ensisijainen mekanismi cGMP: n inaktivoinnissa, joka on vasodilatoivan aineen typpioksidin (NO) loppupään välittäjä (Lugnier, 2006).
erektiohäiriön (ED) aikana endoteelisten kouruastioiden NO: n heikentynyt tuotanto voidaan farmakologisesti voittaa käyttämällä PDE5-estäjiä (PDE5i) cGMP: n puoliintumisajan pidentämiseksi ja vasodilatoivan jäännöstoiminnan parantamiseksi (Hawksworth and Burnett, 2015). Useita molekyylejä, joilla on PDE5: tä estävä vaikutus, on tämän jälkeen projisoitu ja julkaistu markkinoille, mikä osoittaa vaikutuksen alkavan ja kestävän eri tavalla. Tällä hetkellä PDE5i ovat ensisijaisia lääkkeitä, joita käytetään ED: n hoitoon (Mehrotra et al., 2007).
huolimatta tunnetusta tehosta lähes 80%: lla valitsematta jääneistä ED-potilaista (Eardley ym., 2010; Hatzimouratidis et al., 2010; Porst et al., 2013), merkittävä keskeyttäminen hoidosta pde5i on äskettäin raportoitu. Määrällisesti hoidon on ilmoitettu lopettaneen keskimäärin 4% kuukaudessa, ja vuositasolla hoidon keskeyttäneitä on ollut 50% ( Carvalheira ym., 2012; Corona et al., 2016). Niistä tärkeimmistä syistä, joita potilaat antavat hoidon lopettamisen perustelemiseksi, tehon puutetta ja sivuvaikutuksia kutsutaan yleisimmiksi (Corona et al., 2016). Voidaan erottaa kahdenlaisia sivuvaikutuksia: ne, jotka liittyvät tiukasti PDE5: n estoon, kuten päänsärky, punoitus ja dyspepsia, ja ne, jotka liittyvät muiden PDE: n lääkkeiden jäännösestoaktiivisuuteen, kuten vasodilataatio ja takykardia (PDE1), näköhäiriöt (PDE6) ja selkäkipu (PDE11) (Bischoff, 2004; Gupta et al., 2005). Koska haittavaikutusten esiintyminen lisääntyy sekä seerumitasoilla että aika-altistuksella lääkkeelle (Gupta et al., 2005; Taylor ym., 2009), lääkkeen turvallisuus/teho-profiilia voidaan vaihtoehtoisesti parantaa farmakokineettisellä lähestymistavalla suunnittelemalla uusi lääkemuoto (Mehrotra et al., 2007). Tätä lähestymistapaa on sovellettu menestyksekkäästi PDE5i: hen vardenafiilin tapauksessa. Itse asiassa tämä molekyyli kärsii suhteellisen alhaisesta hyötyosuudesta (∼15%, Center for Drug Evaluation and Research, 2003). Vardenafiilin alkuperäinen lääkemuoto (ODT) lisäsi merkitsevästi lääkkeiden biologista hyötyosuutta suosimalla kielen alle imeytymistä verrattuna kalvopäällysteiseen tablettiin (Heinig et al., 2011).
sildenafiili (Sild) oli ensimmäinen selektiivinen PDE5: n estäjä, joka hyväksyttiin ED: n (Boolell et al., 1996). Se on suhteellisen lipofiilinen molekyyli ja suun kautta annettuna huippupitoisuus plasmassa saavutetaan 0, 5-2 tunnin kuluessa. Sild: n biologinen hyötyosuus suun kautta annettuna on suhteellisen pieni (38-41%), mikä johtuu pääasiassa laajasta suolisto-ja ensikierron metaboliasta (Gupta et al., 2005). Huolimatta pitkästä läsnäolosta markkinoilla huumeiden uusien formulaatioiden kehittäminen on jatkunut heikosti, kunnes äskettäin julkaistiin Italian markkinoilla Uusi formulaatio: oro-dispersible film (ODF). ODF hyväksyttiin FCT: n bioekvivalentiksi muodoksi (Leoni et al., 2013). Suun kautta hajoavat valmisteet voivat kuitenkin edustaa sopivia järjestelmiä suosimaan trans-limakalvoja ja erityisesti sub-lingual-imeytymistä (Kathpalia and Gupte, 2013).
tässä tutkimuksessa arvioimme joko ODF: n tai ODT: n sublinguaaliseen antoon liittyvää Sild: n farmakokinetiikkaa verrattuna FCT: hen alkuperäisenä käyttöjärjestelmäformulaatiota kohti. Tätä tarkoitusta varten selvitimme erilaisten Sild-valmisteiden vapautumis- / permeaatioprofiilia in vitro-järjestelmillä, jotka on erityisesti kehitetty arvioimaan lääkkeiden Trans-limakalvoabsorptiota. Lisäksi määritimme sildin farmakokinetiikan seerumiprofiilit per os FCT: n ja sublingual ODT: n ja ODF: n antamisen jälkeen ED-potilailla.
materiaalit ja menetelmät
kemikaalit ja lääkemuodot
Hank ’ s balance salts solution pH 7.4 (HBSS), HEPES solution, bentsanilide ja Sild citrate ostettiin kaikki Sigma–Aldrichista (Milano, Italia). Jotta markkinoilla olevien vaihtoehtoisten bioekvivalenttien valmisteiden käytöstä ei seuraisi hämmentäviä tuloksia, käytettiin seuraavia tuotteita: Viagra® FCT (Pfizer, Milano, Italia), Viagra ORO® ODT (Pfizer) ja Rabestrom® ODF (IBSA, Lodi, Italia). Lääkkeitä määrättiin potilaille avohoidon arvioinnin aikana heidän yksityiskäyttöönsä. In vitro-testejä ja farmakokinetiikan in vivo-arviointia varten (ks.jäljempänä) tutkimukseen osallistunut henkilöstö osti lääkkeitä erityisesti paikallisista apteekkitiloista ja käsitteli/varastoi ne optimaalisissa olosuhteissa.
Jaottelutesti
in vitro-jaottelutestit tehtiin Euroopan farmakopean (2016) mukaan käyttäen tabletin Hajoamistestiä (Sotax DT 2, täydentävä Kuva S1A) käyttäen vettä upotusnesteenä 37 ± 0, 5°C: ssa.jaottelun ajankohta tarkastettiin annostusmuodon täydellisessä hajoamisessa. Täydellinen hajoaminen määritellään tilaksi, jossa testilaitteen kuvaruudulle jäävä tai levyjen alapintaan kiinnittynyt yksikön jäännös on pehmeää massaa, jolla ei ole selvästi kiinteää ydintä. Testit tehtiin kolmena kappaleena ja tulokset ilmoitettiin keskiarvona ± keskihajonta.
Liuotustesti
in vitro lääkkeen liuotustestit tehtiin Euroopan farmakopean mukaan . Liukenemistesteissä käytettiin melalaitetta, melonnanopeutta 50 rpm ja liukenemistilavuutena käytettiin hbss pH 7,4: ää (900 ml lämpötilassa 37 ± 0,5°C).
vapautumistestien aikana 2 ml liuotusnäytettä, 0, 2, 4, 6, 10, 20, 30, ja 40 min, poistettiin ja suodatettiin 0,45 µm selluloosaesterisuodattimen läpi ja siten laimennettiin. Tämän jälkeen Sild-kvantifiointi suoritettiin korkean erotuskyvyn nestekromatografialla (HPLC) – UV. Poistettu tilavuus korvattiin joka kerta tuoreella väliaineella. Testit tehtiin kolmena kappaleena ja tulokset ilmoitettiin keskiarvona ± keskihajonta. Tiedot formulaation lääkeainepitoisuudesta normalisoitiin.
Trans-limakalvon Läpäisevyystesti
Sild: n Trans-limakalvon läpäisevyysprofiili arvioitiin in vitro erityisellä laitteella delvadia et al-tutkimuksen mukaan. (2012) asianmukaisesti muutettu. Laite koostui lyhyesti vertikaalisesta diffuusiojärjestelmästä, jossa oli luovuttaja-vastaanottaja-kammiot, jotka oli erotettu kertakäyttöisellä selluloosa-asetaattikalvolla (huokos 0,45 µm). Luovuttajasolu sisälsi 1, 5 ml HBSS: ää, kun taas vastaanottokammio oli osa 30 ml: n suljettua kiertokulkua, johon sisältyi letkuston ja säiliön tilavuus. Näytteenotto suoritettiin vastaanottokammion säiliöstä aikavälein 0, 5, 10, 20, 30, ja 40 min ja korvataan vastaavalla määrällä tuoretta HBSS: ää. Näytteistä analysoitiin HPLC-UV-menetelmällä lääkeainepitoisuus (Fejős et al., 2014). Tulokset normalisoitiin puhtaasta Sild-sitraatista havaitulla suurimmalla läpäisevällä sild-pitoisuudella. Testit tehtiin kolmena kappaleena ja tulokset ilmoitettiin keskiarvona ± keskihajonta.
farmakokineettinen tutkimus vapaaehtoisilla Psykogeenisillä ED-potilailla
tutkimus tehtiin Andrologian ja lisääntymis-lääketieteen yksikössä (Padovan yliopistollinen sairaala, Italia) toukokuun ja syyskuun 2017 välisenä aikana, Helsingin julistuksen mukaan Padovan yliopistollisen sairaalan eettisen toimikunnan hyväksynnällä (protokolla nro 3982/AO/16 ja sitä seuraavat muutokset). Sekoittavien tulosten välttämiseksi psykogeenistä ED: ää sairastavat otettiin mukaan, koska orgaanisten derangementtien pienempi esiintyminen liittyy ED: ään (Ludwig and Phillips, 2014).
otoskoko laskettiin siten, että efektikoko oli vähintään 0,5 tilastollisella potenssilla 0,8 ja merkitsevyystaso 0,05 kolmen ryhmän vertailussa (katso power calculator – one-way independent ANOVA).
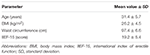
kaksikymmentä potilasta (keski-ikä 31, 4 ± 5, 7 vuotta) otettiin peräkkäin, kun allekirjoitettu tietoon perustuva suostumus julkaistiin. Potilaat osallistuivat avohoitoarviointiin, jossa raportoitiin, että he olivat jatkuvasti kyvyttömiä saamaan ja ylläpitämään erektiota tyydyttävään yhdyntään edellisten 6 kuukauden aikana tai enemmän. Myöhempi kliininen arviointi tehtiin kaikille potilaille sen varmistamiseksi, että ED: ään liittyviä sairauksia, kuten diabetes mellitusta, verenpainetautia, neurologisia häiriöitä ja masennuslääkkeiden käyttöä ei esiinny. Psykogeenisen ED: n diagnoosi vahvistettiin indeksipisteen <26 täyttymisellä kansainvälisen erektiofunktio-15: n (IIEF-15) kyselylomakkeen (Lotti et al., 2016) ja yöllisten spontaanien erektioiden ylläpitoa arvioituna Nocturnal penis Tumescence and Rigidity Monitoring-menetelmällä Rigiscan Plus Rigidity Assessment system (Dacomed, Yhdysvallat) kahtena peräkkäisenä yönä edellä kuvatulla tavalla (Munoz et al., 1993; Caretta ym., 2005). Poissulkukriteereinä olivat maligniteettidiagnoosi, poikkeava hormonin plasmapitoisuus (vastaavasti luteinisoivan hormonin >8 UI/l, testosteronin kokonaispitoisuuden <10, 4 nmol/l, tyreotropiinin >4, 5 mUI/l, prolaktiinin >20 ng/ml) ja intima-median paksuuden lisääntyminen aortan ylärungoissa (>0.9 mm) ja/tai kavernusvaltimot (>0, 3 mm), arvioituna väriDoppler-ultraäänellä edellä kuvatulla tavalla (Caretta et al., 2005, 2009).
potilaat suostuivat kerta-annokseen, kolmiosaiseen crossover-avoimeen tutkimukseen. Lääkkeen annosteluohjelma on esitetty kuvassa 1. Sildin annos valittiin 50 mg: ksi, mikä on sopusoinnussa aiempien psykogeenisen ED: n hoitoa koskevien raporttien kanssa (Banner and Anderson, 2007). Potilaita pyydettiin olemaan ottamatta lääkkeitä tai alkoholia 1 viikon ajan ennen tutkimusta ja sen aikana. Lisäksi potilaita pyydettiin myös nauttimaan lääkkeenantopäivänä rasvaton aamiainen (ei maitoa tai muuta rasvaista ruokaa) vähintään 2 tuntia ennen testiä. FCT, jota pidetään vertailumuotona, annettiin klassisesti per käyttöjärjestelmä nielemällä suun kautta otettava tabletti vesilasillisen kanssa. ODT: n ja ODF: n osalta potilaita neuvottiin pitämään valmistetta kielen alla 15 minuutin ajan ilman veden oletusta, minkä jälkeen potilas nieli valmistetta. Laskimoverinäytteet otettiin standardiputkissa (Vacutainer, Bd Biosciences, Milano, Italia) 0, 5, 10, 15, 30, 60, 90, 120, ja 240 min lääkkeen antamisen jälkeen. Kompensaatiota suoritettiin jatkuvalla steriilillä suolaliuoksella annetulla infuusiolla. Annostelun jälkeen koehenkilöt säilytettiin verinäytteen ottamiseen asti. Kontrollisyistä 24 tunnin kuluttua annostelusta suoritettiin ylimääräinen verenhoito täydellisen lääkepuhdistuman varmistamiseksi. Elimistöstä poistumisjaksoina sallittiin 7 vuorokautta yhden annoksen ja seuraavien annosten välillä. Verenoton jälkeen plasma eristettiin välittömästi ja säilytettiin -80°C: ssa käyttöön asti.
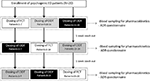
KUVA 1. Annostelu ja farmakokineettisten parametrien arviointi 20 psykogeenistä erektiohäiriötä sairastavalla potilaalla jaoteltiin kolmeen ryhmään (potilaat 1-7, potilaat 8-14 ja potilaat 15-20). Jokaiselle potilasryhmälle annettiin vaihtoehtoisesti yksi käyttöjärjestelmä, kalvopäällysteinen Tabletti (FCT), sublingual oro-dispergoituva tabletti (ODT) tai sublingual oro-dispersible film (ODF), vähintään 1 viikko jokaisen annoksen jälkeen. Kaikki lääkemuodot sisälsivät 50 mg sildenafiilia (Sild).
hoidon aikana potilaita pyydettiin myös kirjaamaan haittavaikutukset erityisessä muodossa, joka on mukautettu Agenzia Italiana del Farmacon (AIFA1) ADR-raportointilomakkeeseen. Kyselylomakkeesta on saatavilla käännetty versio täydentävänä aineistona (KS.Lisätietolomake S1). Potilaita pyydettiin määrittelemään haittavaikutuksen / haittavaikutusten tyyppi, kokonaisintensiteetti (subjektiivisella arviointiasteikolla 1, hyvin heikko, 5, hyvin voimakas), alkamisaika ja kokonaiskesto.
sildenafiilin kvantifiointi ihmisen seerumista
sild-pitoisuuden määrittämiseksi seeruminäytteeseen lisättiin 400 µl 500 µl metanolia täydennettynä sisäisellä standardilla (IS) bentsanilidilla (5 µg/ml). Tämän jälkeen seokseen lisättiin 5 ml etyyliasetaattia, näytteet pyörrettiin neste-neste-uuttoa varten, kaksi faasia erotettiin sentrifugoimalla. Tämän jälkeen orgaaninen osa haihdutettiin tyhjösentrifugissa 40°C: n lämpötilassa. Saatu jäännös liuotettiin uudelleen 200 µl metanolia ja käytettiin lopulta korkean erotuskyvyn nestekromatografia-tandem-massaspektrometrian (HPLC-MS/MS) määritykseen.
korkean erotuskyvyn nestekromatografia-MS/MS-analyysissä käytettiin järjestelmää Agilent-Varian 1260 ja kolmen nelinkertaista detektoria Agilent-Varian 320 MS.kromatografinen erotus suoritettiin kolonnilla Phenomenex C-18 Evo 3 × 100 ja liikkuvassa faasissa, joka koostui asetonitriilistä ja 0,1-prosenttisesta muurahaishaposta vedessä, jonka gradientti on esitetty täydentävässä Kuvassa S2A. IS: n siirtymävaiheeseen 198 > 105 Da sovellettiin positiivista ilmaisutapaa, joka saatiin 40 V: n kapillaarijännityksellä ja 16 V: n törmäysenergialla, kun taas 475 > 100 Da Sild: llä, jonka kapillaarijännitys oli 40 V ja törmäysenergia 22,5 V. IS: n ja Sild: n edustavat kromatogrammit todellisissa näytteissä ilmoitetaan Lisäkuvassa S2B.
tilastollinen analyysi
farmakokineettiset parametrit (PK), kuten seerumin enimmäispitoisuus (Cmax), aika seerumin enimmäispitoisuuteen (Tmax) ja AUC-arvo (AUC) eri ajankohtina, laskettiin GraphPad-ohjelmistolla (La Jolla, CA, Yhdysvallat) tehtyjen sovellusten perusteella. Tietojen tilastollinen analyysi tehtiin SPSS 21.0: lla Windowsille (SPSS, Chicago, IL, Yhdysvallat). Kolmogorov-Smirnov-testiä käytettiin jakautumisen normaaliuden tarkistamiseen. Muuttujat, jotka eivät osoittaneet normaalijakaumaa, log muunnettiin. Potilaiden lähtötilanteen ominaisuuksia, PKs: ää ja in vitro-kokeista saatuja tietoja verrattiin parittomiin opiskelijan t–testeihin Bonferroni-Holm-korjauksella monivertailuissa. Toistuvien mittausten avulla ANOVA testattiin lääkeaineiden vapautumisen ja sild-seerumipitoisuuden eroja. Levenen testillä testattiin ryhmien välisen varianssin homogeenisuutta. Jos varianssioletuksen homogeenisuutta rikottiin, tehtiin Welch-testi ja raportoitiin vastaava P-arvo. ADR: n osuutta verrattiin χ2-eksaktiin testiin. P-arvot < 0.05: tä pidettiin tilastollisesti merkitsevänä.
tulokset
In Vitro-analyysi sildenafiilin vapautumisesta/läpäisevyydestä eri lääkemuodoista
Sild: n vapautumista ja läpäisevyyttä kolmesta lääkemuodosta tutkittiin aiemmin in vitro (kuva 2). FCT: n, ODT: n ja ODF: n jaottelun loppuunsaattamisaikaa arvioitiin Euroopan farmakopean (2016; kuva 2a) standarditestillä. ODF: llä oli korkein jaotteluaika verrattuna sekä FCT: hen että ODT: hen (P = 0,017 ja P = 0,008).
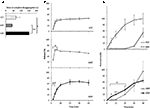
KUVA 2. In vitro evaluation of bio-technological properties of Fcts, ODTs, andODFs containing 50 mg of Sild. Tulokset edustavat kolmea riippumatonta koetta, ja ne ilmoitetaan keskiarvoina ± keskihajonta. (A) jaottelutestin tulokset, ilmoitetaan aika (sekunteina) valmisteen täydelliseen jaotteluun. Merkitsevyys: ∗P < 0, 05 ja ∗ ∗ p < 0, 01 merkittyjen valmisteiden välillä. (B) liukenemistestin tulokset, joissa ilmoitetaan kunkin formulaation vapauttaman Sild: n määrä prosentteina lääkkeen annoksesta. Merkitsevyys: aP < 0, 01 vs. FCT; bP < 0, 001 vs. ODT. C) läpäisevyystestin tulokset (yksityiskohtaiset kohdassa ”materiaalit ja menetelmät”), joissa ilmoitetaan selluloosa-asetaattikalvon läpi läpäisevän Sildin määrä prosentteina suurimmasta arvosta, joka saavutetaan 50 mg: lla puhdasta sild-jauhetta (epäjatkuva viiva yläpaneelissa). Merkitsevyys: ∗P < 0, 05 vs. ODT; ∗ ∗ P < 0, 01 vs. ODT; ap < 0, 01 vs. FCT.
tämän näytön vaikutuksen arvioimiseksi lääkemuodosta vapautuvaan lääkeaineeseen tehtiin tavanomainen liuotustesti (Euroopan farmakopea, 2016; kuva 2b). Verrattuna vertailumuotoon FCT, ODT: ssä lääkeaine vapautui nopeammin, ja maksimaalinen määrä saavutettiin jo 2 minuutin kuluttua testin alusta (P = 0, 006 vs. FCT). Toisaalta ODF: stä vapautuneen lääkkeen prosenttiosuus testin ensimmäisen 4 minuutin aikana oli pienempi kuin FCT: llä ja ODT: llä (P = 0, 004 ja p < 0, 001). Erityisesti ODF: ssä lääkkeen vapautuminen oli progressiivisempaa kuin FCT: ssä, ja maksimimäärä saavutettiin 20 minuutin kuluttua testin alusta.
tällä perusteella Sild: n translumeaatio kustakin formulaatiosta arvioitiin erikseen kehitetyllä laitteella (Kuva 2C). Vertailutarkoituksia varten arvioitiin puhdasta Sild-sitraattia, jota käytettiin 50 mg: n painoisena Sild: tä, ja se diffuusioitui vapaasti ja nopeasti kammioiden välillä. FCT: llä havaittiin lähes vastakkainen profiili, jonka läpäisevyys oli häviävän pieni 30 minuutin ajan testin alusta. ODT: n ja ODF: n läpäisyprofiilit osoittivat keskitason käyttäytymistä verrattuna kahteen edelliseen tilaan. Testin ensimmäisen 20 minuutin aikana ODF: n läpäisyaste oli merkitsevästi suurempi kuin ODT: n (vastaavasti P = 0, 033 5 minuutin kuluttua, P = 0, 003 10 minuutin kuluttua ja P = 0, 041 20 minuutin kuluttua). Toisin kuin FCT: ssä ja ODT: ssä, jotka hajosivat täysin luovuttajakammiossa, selluloosa-asetaattikalvolla säilyi vielä määrityksen päättyessäkin ODF: n pehmeän hyytelömassaa (täydentävä luku S2C).
sildenafiilin differentiaalinen farmakokinetiikka
kaksikymmentä psykogeenisestä DE: stä kärsivää mieshenkilöä, jotka saivat vaihtoehtoisesti FCT: tä, ODT: tä tai ODF: ää, erotettuna viikon huuhtelun jälkeen. Kuten kohdassa ”materiaalit ja menetelmät” kerrotaan, FCT: tä nieltiin klassisesti klassisen os-annostelun mahdollistamiseksi, kun taas ODT: tä ja ODF: ää pidettiin kielen alla 15 minuutin ajan sublinguaalisen reitin edistämiseksi. Potilaiden kliiniset ominaisuudet on ilmoitettu taulukossa 1. Kolmea annostusta vastaavat Sild-pitoisuudet seerumissa on esitetty kuvassa 3. Näiden kolmen lääkemuodon seerumiprofiili vaihteli huomattavasti. FCT: hen verrattuna ODT: ssä sild-pitoisuudet seerumissa nousivat selvästi varhaisessa vaiheessa; tämä suuntaus ei kuitenkaan ollut tilastollisesti merkitsevä. Toisaalta Sild-pitoisuuksien havaittiin hajoavan nopeammin 120 minuutin ja 240 minuutin kuluttua annostelusta ODT-lääkemuodolla (vastaavasti P = 0, 044 ja P = 0, 024 vs. FCT).
TAULUKKO 1. Tutkimukseen osallistuneiden kliiniset ominaisuudet (N = 20).
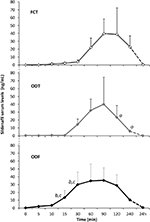
KUVA 3. In vivo sild: n seerumitasojen arviointi 20 psykogeenisestä ED: stä kärsivällä potilaalla, jotka saivat vaihtoehtoisesti joko FCT: n per käyttöjärjestelmä tai sublingual ODT: n tai sublingual ODF: n, kuten on esitetty kohdassa ”materiaalit ja menetelmät.”Tiedot ilmoitetaan keskiarvoina ± keskihajonnan merkitys: aP < 0, 05 vs. FCT; bP < 0, 01 vs. FCT; cP < 0, 05 vs. ODT.
ODF-lääkemuodon lääkeseerumiprofiilissa Sild-pitoisuudet nousivat nopeammin kuin FCT: ssä (P = 0, 001 ja P = 0, 003) ja ODT: ssä (P = 0, 048 ja P = 0, 041) 15 minuutin kuluttua ja 30 minuutin kuluttua annostelusta. Yhdessä hitaan jaotteluajan in vitro (Kuva 2B) kanssa ODF: n keskimääräinen pitoisuus–aikakäyrä in vivo oli tasaisempi kuin FCT: n ja ODT: n (kuva 3).
näiden kolmen formulaation farmakokineettiset parametrit on esitetty taulukossa 2. Vaikka kolmen lääkemuodon välillä ei havaittu merkitsevää eroa Cmax -, tmax-ja AUC0-240 min-arvoissa, ODF-arvo oli pienin Cmax-arvo (38, 2 ± 23, 7 ng/ml) ja lyhin tmax-arvo (70, 0 ± 24, 5 min). Erityisesti ODF: n AUC0-60 min-arvo oli huomattavasti suurempi kuin FCT: n ja ODT: n (P = 0, 005 ja P = 0).043), mikä lisäsi Sild: n suhteellista hyötyosuutta ensimmäisen tunnin aikana ODF: n annostelusta kielen alle.

TAULUKKO 2. Sildenafiiliformulaatioiden farmakokineettiset parametrit.
haittavaikutukset
tulokset, jotka saatiin tutkimukseen osallistuneiden kokemista haittavaikutusten tyypeistä ja ominaisuuksista itse annetulla kyselylomakkeella, on esitetty taulukossa 3. Niistä tunnettu ADR raportoitu Sild (Taylor et al., 2009), useimmin kirjattuja olivat päänsärky, punoitus ja nenän tukkoisuus. Yhdellä potilaalla todettiin FCT-annoksen jälkeen lievää lihaskipua (subjektiivisen arviointiasteikon asteikko 1). Kukaan potilaista ei ilmoittanut näköhäiriöitä, takykardiaa, heikkoutta tai kuulon muutoksia.

TAULUKKO 3. Tutkimukseen osallistuneiden kirjaamat haittavaikutukset (n = 20).
verrattuna vertailumuotona käytettyyn FCT: hen, ODT: ssä todettiin haittavaikutusten esiintyvyys muuttumattomana. Henkilökohtainen käsitys punastumisen voimakkuudesta oli kuitenkin huomattavasti pienempi (P = 0, 031). Toisaalta ODF: n mukaan päänsäryn esiintyvyys oli pienempi kuin FCT: N (P = 0, 043). Lisäksi punastumisen ja nenän tukkoisuuden kestoa ja voimakkuutta havaittiin vähemmän kuin FCT: llä (P = 0, 011 ja P = 0, 015) ja ODT: llä (P = 0, 026 ja P = 0, 037).
Keskustelu
tässä tutkimuksessa esitetään näyttöä siitä, että sild: n kielen alle annon yhteydessä on lisääntynyt lääkkeen alkuaikojen biologinen hyötyosuus ja parantunut siedettävyysprofiili. Tätä näyttöä tukevat sekä in vitro-tutkimukset, jotka osoittavat, että Sild-formulaatiolla on pidempi hajoamisaika, mutta se suosii merkittävästi Trans-limakalvon imeytymistä, että In vivo-todisteet.
fosfodiesteraasin estäjät ovat ensisijainen hoitovaihtoehto ED: n hoidossa; potilaiden kokemat haittavaikutukset ovat kuitenkin yleisin syy hoidon keskeyttämiseen (Corona ym., 2016). Farmakokinetiikan muuttaminen uuden lääkemuodon suunnittelun avulla voi olla houkutteleva strategia itse lääkkeen turvallisuus – / tehoprofiilin parantamiseksi (Mehrotra ym., 2007). Tältä osin Sild-sitraatin patentin voimassaolon päättyminen vuonna 2013 useissa Euroopan maissa antoi mahdollisuuden vapauttaa useita uusia sild-valmisteita. On huomattava, että suurin osa markkinoilla nykyisin saatavilla olevista Sild-formulaatioista on itse asiassa hyväksytty alkuperäisen FCT: n bioekvivalenteiksi muodoiksi (Leoni et al., 2013). Mielenkiintoista on, että suun kautta hajoavia muotoiluja, joissa potilaan suussa esiintyy nopeaa hajoamista ilman tarvetta niellä vedellä, on kehitetty (Goel et al., 2008). Näiden uusien valmisteiden yhdenmukaisuus on parantunut potilailla, joilla on vaikeuksia niellä tavanomaisia kiinteitä annoksia, kuten lapsilla, iäkkäillä potilailla ja dysfagisilla potilailla. Lisäksi tarjoamalla paremman suun kautta otettavien lääkkeiden saatavuuden, suun kautta hajoavat valmisteet voivat edustaa arvostettuja järjestelmiä, joilla suositaan Trans-limakalvoja ja erityisesti sub-lingual-imeytymistä (Kathpalia and Gupte, 2013). Erityisesti Italiassa kaksi suullisesti hajoavaa sild-valmistetta on virallisesti saatavilla apteekkitiloissa: ODTs ja ODFs.
tässä tutkimuksessa pyrittiin arvioimaan mahdollisia farmakokineettisiä muutoksia ja ADR: n vastaavaa mallia, jotka johtuvat Sildin trans-limakalvoabsorption suosimisesta kahden saatavilla olevan oraalisen hajoavan lääkemuodon subkielisen annostelun kautta. Tuloksia verrattiin Sildin alkuperäiseen muotoiluun eli FCTs: ään. Mielenkiintoista on, että löysimme tiukan korrelaation sekä in vitro että in vitro bioteknisten ominaisuuksien ja eri formulaatioiden PKs: n välillä. Huolimatta samansuuruisesta lääkeannoksesta (50 mg) ja lievemmästä lääkeaineen vapautumisnopeudesta liukenemistestissä ODF: lle oli ominaista yhtäältä pidempi hajoamisaika ja suurempi läpäisevyys Trans-limakalvomallissa ja toisaalta parempi lääkkeen biologinen saatavuus ensimmäisen tunnin kuluessa annostelusta. Voisimme sitten olettaa, että pitkäaikainen huumeiden ja limakalvojen välinen kontakti suosii kielen alaista Sild-imeytymistä. Itse asiassa tätä ilmiötä pyritään yleensä suun kautta annettaviin Trans-limakalvolääkkeisiin, joissa suositellaan mukoadhesive-polymeerien käyttöä valmisteen ja suun limakalvon pitkäaikaisen kontaktin varmistamiseksi (Lam et al., 2014), erityisesti niistä lääkkeistä, kuten Sild, vaikuttaa Alhainen vesiliukoisuus (Zayed et al., 2012; Sun ym., 2014). Nämä alustavat tulokset viittaavat myös siihen, että tämän lääkeryhmän kliininen teho saattaa parantua alkuperäisiin lääkemuotoihin verrattuna. Lisätutkimukset ovat tarpeen näiden näkökohtien selventämiseksi.
tämän tutkimuksen silmiinpistävin näyttö on ODF: n alikielisen annostelun haittavaikutusten merkittävä väheneminen verrattuna samalla annoksella annettuihin ODT: hen ja FCT: hen, mikä puolestaan voi johtaa potilaiden yhdenmukaisuuden lisääntymiseen. Tätä näyttöä voidaan tulkita sen periaatteen valossa,että lääkkeen sivuvaikutuksen esiintyvyys lisääntyy seerumin pitoisuutta ja altistusaikaa itse lääkkeelle (Gupta et al., 2005; Taylor ym., 2009). Huolimatta maailmanlaajuisesta biologisesta saatavuudesta verrattuna muihin analysoituihin lääkemuotoihin, ODF: n alikielinen annostelu osoitti alhaisemman Cmax-arvon ja lyhyemmän tmax-arvon, mikä johti merkittävästi suurempaan Sild bio-määrään ensimmäisen tunnin kuluessa annostelusta. Näin ollen voimme spekuloida, että ODF: n alikielisessä annostelussa yhdistyy lääkkeen tehokas imeytyminen keskimääräiseen alhaisempaan sild-pitoisuuteen seerumissa ja siitä johtuvaan pienempään haittavaikutusten riskiin. Tunnustamme kuitenkin, että pieni otoskoko on tutkimuksen suurin haittapuoli. Lisätutkimuksia suuremmilla kohorteilla ja erilaisilla annoksilla tarvitaan tämän ongelman vahvistamiseksi.
yhteenvetona tässä tutkimuksessa raportoimme, että sild ODF: n kielen alle antaminen parantaa lääkkeen siedettävyysprofiilia, koska todennäköisesti mukana on muuntunut farmakokinetiikka verrattuna generaattoreihin FCTs. Vaikka ODF: ää ei alun perin suunniteltu tätä tarkoitusta varten, se on houkutteleva strategia potilaan hoidon mukaisuuden parantamiseksi. Kehitämme lisää vertailevia tutkimuksia kliinisen tehon arvioimiseksi psykogeenisillä ja orgaanisilla ED-potilailla.
tekijän kannanotot
LDT ja CF koordinoivat tutkimuksen ja laativat käsikirjoituksen. MDRP Arvioi ja kirjasi potilaat. EF teki in vitro-analyysin. SDA teki seerumianalyysin. RP suoritti farmakokineettisen vertailun. RP, NR ja AG tarkistivat ja viimeistelivät käsikirjoituksen kriittisesti.
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
kiitokset
Kiitämme Tri Alberto Barossoa, Tri Giuseppe Maggionia ja Tri Dimitri Portalea potilaiden neuvonnasta, Tri Flavia Rosanoa ja Tri Alice Passadorea potilaiden hoidosta sekä Andrologian ja lisääntymisterveyden yksikön koko henkilökuntaa.
lisäaineisto
tämän artikkelin lisäaineisto löytyy verkosta osoitteesta: https://www.frontiersin.org/articles/10.3389/fphar.2018.00059/full#supplementary-material
kuva S1 / edustavat kuvat tabletin Hajoamistestistä (A) ja hajoamistestissä käytetystä Hajoamislaitteesta (B).
kuva S2 |(A) tiedot liikkuvasta faasigradientista, jota käytetään sildenafiilin (Sild) seerumipitoisuuksien korkean suorituskyvyn nestekromatografia-tandem-massaspektrometriassa (HPLC-MS/MS). Molempien Sild: n edustavat kromatogrammit ja massaspektrit ilmoitetaan reaalinäytteissä sisäisessä standardibentsanilidissä (B). C) edustava kuva oro-dispergoituvasta kalvosta (jota korostaa epäjatkuva viiva), joka säilyy läpäisytestin jälkeen laitteessa, jota käytetään selluloosa-asetaattikalvon kautta tapahtuvan Trans-limakalvon imeytymisen in vitro estimointiin.
tietolomake S1 / Haittavaikutuskysely.
alaviite
- ^http://www.aifa.gov.it/en/content/reporting-adverse-reaction
Banner, L. L., and Anderson, R. U. (2007). Integroitu sildenafiili ja kognitiivisen käyttäytymisen sukupuoliterapia psykogeeniselle erektiohäiriölle: pilottitutkimus. J. Seksi. Med. 4, 1117–1125. doi: 10.1111 / j.1743-6109.2007. 00535.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischoff, E. (2004). PDE-eston ei-selektiivisyyden voimakkuus, selektiivisyys ja seuraukset. Int. J. Impot. Res. Suppl. 1, S11-S14. doi: 10.1038 / sj.ijir.3901208
PubMed Abstract | CrossRef Full Text | Google Scholar
Boolell, M., Allen, M. J., Ballard, S. A., Gepi-Attee, S., Muirhead, G. J., Naylor, A. M., et al. (1996). Sildenafiili: oraalisesti aktiivinen tyypin 5 syklinen GMP-spesifinen fosfodiesteraasi-inhibiittori peniksen erektiohäiriön hoitoon. Int. J. Impot. Res. 8, 47-52.
PubMed Abstract / Google Scholar
Caretta, N., Palego, P., Ferlin, A., Garolla, A., Bettella, A., Selice, R., et al. (2005). Spontaanien erektioiden uudelleen aloittaminen tietyillä potilailla, joilla on erektiohäiriöitä ja eriasteisia kaulavaltimon seinämän muutoksia: tadalafiilin rooli. Euro. Urol. 48, 326–331. doi: 10.1016 / j.eururo.2005.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Caretta, N., Palego, P., Schipilliti, M., Ferlin, A., Di Mambro, A., and Foresta, C. (2009). Syvä Valtimo intima-median paksuus: Uusi parametri verisuonten erektiohäiriöiden diagnosoinnissa. J. Seksi. Med. 6, 1117–1126. doi: 10.1111 / j.1743-6109.2008. 01112.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Carvalheira, A. A., Pereira, N. M., Maroco, J., and Forjaz, V. (2012). Dropout in the treatment of erektiohäiriö PDE5: a study on predictors and a kvalitative analysis of reasons for stop. J. Seksi. Med. 9, 2361–2369. doi: 10.1111 / j.1743-6109.2012. 02787.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Center for Drug Evaluation and Research (2003). Nda 021400 Levitra (Vardenafiilihydrokloridi) tabletit: Clinical Pharmaceutics Review. Rockville, Md: Department of Health and Human Services. Silver Spring, MD: Food and Drug Administration.
Google Scholar
Corona, G., Rastrelli, G., Burri, A., Serra, E., Gianfrilli, D., Mannucci, E., et al. (2016). Ensimmäisen sukupolven fosfodiesteraasi tyyppi 5 inhibiittorit dropout: kattava katsaus ja meta-analyysi. Andrologia 4, 1002-1009. doi: 10.1111 / andr.12255
PubMed Abstract | CrossRef Full Text | Google Scholar
Delvadia, P. R., Barr, W. H. ja Karnes, H. T. (2012). A biorelevant in vitro release/permeation system for oral transmucosal dosage forms. Int. J. Pharm. 430, 104–113. doi: 10.1016/j.ijpharm.2012.03.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Eardley, I., Donatucci, C., Corbin, J., El-Meliegy, A., Hatzimouratidis, K., McVary, K., et al. (2010). Pharmacotherapy for erectile dysfunction. J. Sex. Med. 7, 524–540. doi: 10.1111/j.1743-6109.2009.01627.x
PubMed Abstract | CrossRef Full Text | Google Scholar
European Pharmacopoeia (2016). European Directorate for the Quality of Medicines &HealthCare (EDQM), 9th Edn. Strasbourg: Euroopan neuvosto.
Google Scholar
Fejős, I., Neumajer, G., Béni, S., and Jankovics, P. (2014). Lääkeväärennösten ja ravintolisien PDE-5-estäjien kvalitatiivinen ja kvantitatiivinen analyysi HPLC-UV: n avulla sildenafiilin avulla. J. Pharm. Biomed. Anaali. 98, 327–333. doi: 10.1016 / j.jpba.2014.06.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Goel, H., Rai, P., Rana, V. Ja Tiwary, Ak. (2008). Orally disintegrating systems: innovations in formulation and technology. Tuore Pat. Drug Deliv. Kaava. 2, 258–274. doi: 10.2174/187221108786241660
CrossRef kokoteksti / Google Scholar
Gupta, M., Kovar, A., and Meibohm, B. (2005). Fosfodiesteraasi-5: n estäjien kliininen farmakokinetiikka erektiohäiriöiden hoidossa. J. Clin. Pharmacol. 45, 987–1003. doi: 10.1177/0091270005276847
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Hatzimouratidis, K., Amar, E., Eardley, I., Giuliano, F., Hatzichristou, D., Montorsi, F., et al. (2010). European Association of Urology. Miesten seksuaalisen toimintahäiriön ohjeet: erektiohäiriöt ja ennenaikainen siemensyöksy. Euro. Urol. 57, 804–814. doi: 10.1016 / j.eururo.2010.02.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Hawksworth, D. J., and Burnett, A. L. (2015). Erektiohäiriöiden farmakoterapeuttinen hoito. Clin. Pharmacol. Ther. 98, 602–610. doi: 10.1002 / cpt.261
PubMed Abstract | CrossRef Full Text | Google Scholar
Heinig, R., Weimann, B., Dietrich, H., and Böttcher, M. F. (2011). Vardenafiilin uuden suussa hajoavan tabletin farmakokinetiikka: kolmen kliinisen tutkimuksen tulokset. Clin. Huumevirasto. 31, 27–41. doi: 10.2165/11584950-000000000-00000
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Kathpalia, H., and Gupte, A. (2013). Johdatus nopeasti liukenevaan oral thin film drug delivery systems: a review. Kurr. Drug Deliv. 10, 667–684. doi: 10.2174/156720181006131125150249
PubMed Abstrakti / CrossRef kokoteksti | Google Scholar
Lam, J. K., Xu, Y., Worsley, A., and Wong, I. C. (2014). Suun kautta suuonteloon toimitettavat lääkkeet lapsipotilaille. ADV. Drug Deliv. Rev. 73, 50-62. doi: 10.1016 / J.addr.2013.08.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Leoni, L. A., Leite, G. S., Wichi, R. B., and Rodrigues, B. (2013). Sildenafiili: kaksi vuosikymmentä etuja tai riskejä? Ikääntyvä Mies 16, 85-91. doi: 10.3109 / 13685538.2013.801952
PubMed Abstract | CrossRef Full Text | Google Scholar
Lotti, F., Corona, G., Castellini, G., Maseroli, E., Fino, M. G., Cozzolino, M., et al. (2016). Siemennesteen laadun heikkeneminen liittyy seksuaaliseen toimintahäiriöön sen vakavuuden mukaan. Hum. Reprod. 31, 2668–2680. doi: 10.1093 / humrep / dew246
PubMed Abstract / CrossRef Full Text | Google Scholar
Ludwig, W., and Phillips, M. (2014). Orgaaniset erektiohäiriöiden syyt Alle 40-vuotiailla miehillä. Urol. Int. 92, 1–6. doi: 10.1159/000354931
PubMed Abstract | CrossRef Full Text | Google Scholar
Lugnier, C. (2006). Syklinen nukleotidifosfodiesteraasi (PDE) – superperhe: uusi kohde erityisten terapeuttisten aineiden kehittämiselle. Pharmacol. Ther. 109, 366–398. doi: 10.1016 / J.pharmthera.2005.07.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Mehrotra, N., Gupta, M., Kovar, A., and Meibohm, B. (2007). Farmakokinetiikan ja farmakodynamiikan rooli fosfodiesteraasi-5: n estäjähoidossa. Int. J. Impot. Res. 19, 253-264. doi: 10.1038 / sj.ijir.3901522
PubMed Abstract | CrossRef Full Text | Google Scholar
Munoz, M., Bancroft, J., and Marshall, I. (1993). Rigiscanin suorituskyky peniksen kasvamisen ja jäykkyyden mittauksessa. Int. J. Impot. Res. 5, 69-76.
Google Scholar
Porst, H., Burnett, A., Brock, G., Ghanem, H., Giuliano, F., Glina, S., et al. (2013). Issm Standards Committee for Sexual Medicine. SOP konservatiivinen (lääketieteellinen ja mekaaninen) erektiohäiriöiden hoito. J. Seksi. Med. 10, 130–171. doi: 10.1111 / jsm.12023
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, D., Wei, X., Xue, X., Fang, Z., Ren, M., Lou, H., et al. (2014). D-α-tokoferyylipolyetyleeniglykoli-1000-sukkinaattinanomulsioihin perustuvan asetyylipuerariinin oraalinen imeytyminen ja terapeuttinen vaikutus. Int. J. Nanomedicine 9, 3413-3423. doi: 10.2147 / IJN.S63777
PubMed Abstract | CrossRef Full Text / Google Scholar
Taylor, J., Baldo, O. B., Storey, A., Cartledge, J., and Eardley, I. (2009). Erot sivuvaikutusten kestossa ja niihin liittyvissä häiriötasoissa fosfodiesteraasi-tyypin 5 estäjien välillä. BJU Int. 103, 1392–1395. doi: 10.1111 / j.1464-410X.2008. 08328.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Zayed, R., Kamel, A. O., Shukr, M., and El-Shamy, A. H. (2012). In vitro ja In vivo vertaileva tutkimus suoraan pakattujen kiinteiden dispersioiden ja kylmäkuivattujen sildenafiilisitraattisublinguaalitablettien käytöstä pulmonaalihypertension hoidossa. Acta Pharm. 62, 411–432. doi: 10.2478/v10007-012-0027-9
PubMed Abstract | CrossRef Full Text | Google Scholar