En plus du traitement des protéines, l’ER et Golgi s’occupent également de certains types de transport des protéines. Les vésicules (bulles liées à la membrane, essentiellement) se détachent de l’ER, du Golgi et d’autres organites membraneux, emportant avec elles toutes les molécules solubles qui se trouvaient à l’intérieur du fluide qui était enfermé ainsi que toutes les molécules intégrées dans cette section de membrane. Ces vésicules prennent ensuite un tour sur un moteur moléculaire tel que la kinésine ou la myosine, et voyagent le long du cytosquelette jusqu’à ce qu’elles s’amarrent à la destination appropriée et fusionnent avec la membrane ou l’organite cible. En général, les vésicules se déplacent de l’ER au Golgi cis, du Golgi cis au Golgi médial, du Golgi médial au Golgi trans et du Golgi trans à la membrane plasmique ou à d’autres compartiments. Bien que la plupart des mouvements se fassent dans cette direction, il existe également des vésicules qui reculent du Golgi vers l’ER, transportant des protéines qui étaient censées rester dans l’ER (par ex. PDI) et ont été accidentellement ramassés dans une vésicule.
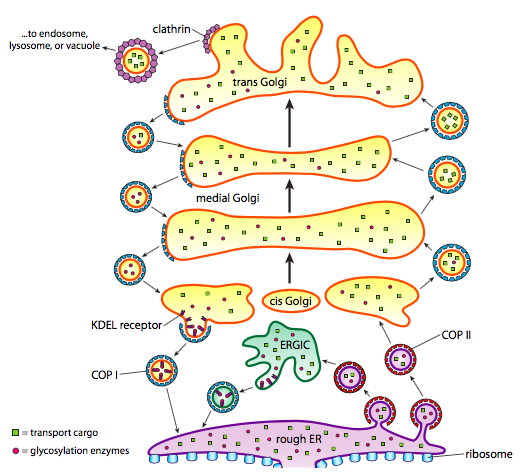
La formation de vésicules dépend des protéines du pelage qui, dans de bonnes conditions, s’auto-assembleront en cages sphériques. Lorsqu’ils sont associés à des protéines transmembranaires, ils peuvent également tirer la membrane attachée vers une forme sphérique. Les principaux types de protéines de pelage utilisées dans la formation de vésicules sont COPII, COPI et clathrine.
Les protéines du manteau COPII forment les vésicules qui se déplacent de ER à Golgi. Les protéines COPI coat sont utilisées entre les parties de l’appareil de Golgi ainsi que pour former des vésicules allant du Golgi vers l’ER. Enfin, la clathrine est utilisée pour former des vésicules quittant le Golgi pour la membrane plasmique ainsi que pour les vésicules formées à partir de la membrane plasmique pour l’endocytose.
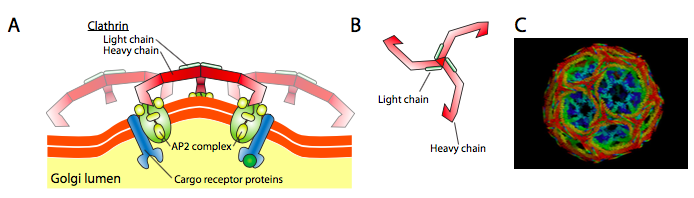
La clathrine (Figure \(\PageIndex{17}\)) est la mieux décrite des trois, et les couches vésiculaires sont constituées d’arrangements de triskelions de clathrine (du grec, signifiant à trois pattes). Chaque triskelion est composé de trois chaînes lourdes réunies à l’extrémité C et de trois chaînes légères, une associée à chaque chaîne lourde. Les chaînes lourdes de différents triskelions interagissent le long de leurs « pattes » de chaîne lourdes pour créer une construction très robuste. Les chaînes légères ne sont pas nécessaires à la formation de vésicules et on pense qu’elles aident à prévenir les interactions accidentelles des molécules de clathrine dans le cytoplasme.
Il existe une similitude significative entre les mécanismes de formation de vésicules utilisant ces différentes protéines de pelage, à commencer par le recrutement d’ARF1 (ARF signifie facteur de ribosylation ADP, qui n’a rien à voir ici avec sa fonction) à la membrane. Cela nécessite l’échange facilité par l’ARNO d’un GTP contre du GDP (ARNO est un ouvre-site de liaison aux nucléotides ARF). Une fois que ARF1 a lié GTP, le changement conformationnel révèle un groupe myristoyle N-terminal qui s’insère dans la membrane. Les vésicules recouvertes de COPI et de clathrine utilisent ARF1 et ARNO, mais COPII utilise des protéines similaires appelées Sar1p et Sec12p.
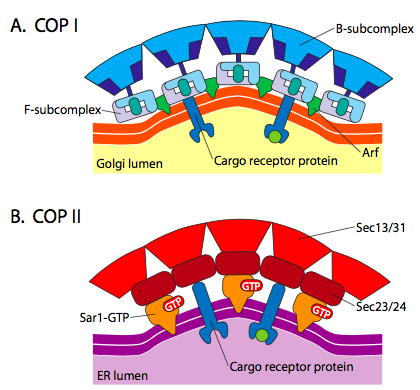
Figure \(\PageIndex {18}\). Vésicules revêtues de COP
L’ARF1 (ou Sar1p) est utilisé pour recruter des protéines adaptatrices qui se lient à l’extrémité « queue » des protéines réceptrices liées à la membrane. L’extrémité commerciale de ces récepteurs se lie aux molécules car-go qui doivent être emballées dans la vésicule. Les protéines adaptatrices agissent comme le lien entre la membrane (à travers les récepteurs) et les protéines du manteau. Pour la clathrine, les protéines adaptatrices sont AP1 pour les vésicules dérivées du trans-Golgi et AP2 pour les vésicules endocytaires. Pour les vésicules COPI, les homologues approximatifs sont les β-, γ-, δ- et ζ-COP tandis que le système COPII utilise Sec23p et Sec24p.
Enfin, les adaptateurs sont liés aux protéines de couche réelles: clathrine, α- ou ε-COP, Sec13p et Sec31p. Ce que ces protéines ont toutes en commun, c’est que spontanément (i.e. sans aucune dépense énergétique), ils s’auto-assemblent en structures sphériques en forme de cage. Au microscope électronique, les vésicules revêtues de clathrine sont plus nettement définies et les formes hexagonales et pentagonales délimitées par les sous-unités de clathrine donnent à la vésicule un aspect de « ballon de football ». Les vésicules recouvertes de coatamère sont beaucoup plus floues en apparence sous EM.
Les trois types de protéines de la couche vésiculaire ont la capacité de s’associer spontanément en une construction sphérique, mais seule la vésicule revêtue de COPI et de COPII « pince » spontanément la membrane pour libérer la vésicule de sa membrane d’origine. Les vésicules revêtues de clathrine nécessitent un mécanisme externe pour libérer la vésicule (Figure\(\PageIndex{19}\)).
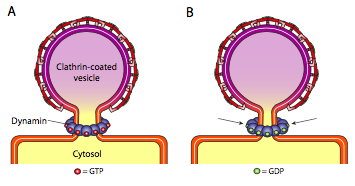
Une fois la vésicule presque terminée, il reste une petite tige ou un col de membrane qui relie la vésicule à la membrane. Autour de cette tige, les molécules dynamiques de GTP s’agrégent dans une construction en anneau/ spirale. Les molécules de dynamine sont des GTPases globulaires qui se contractent lors de l’hydrolyse du GTP. Lorsqu’elles s’associent autour de la tige de la vésicule, chaque protéine dynamine se contracte, avec l’effet combiné de resserrer suffisamment la tige pour que la membrane se pince ensemble, scellant et libérant la vésicule de la membrane d’origine.
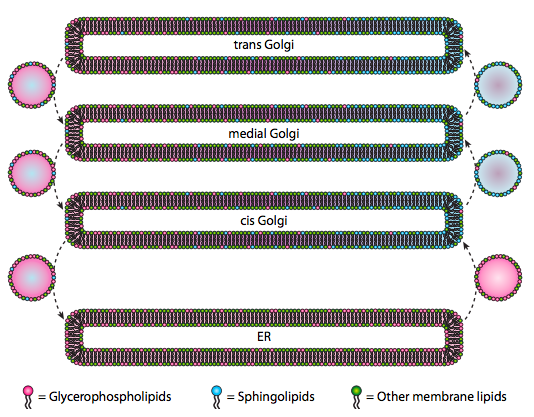
Bien que les lipides et les membranes aient été discutés au chapitre 4, nous avons négligé de discuter de la localisation de leurs synthèses chez les eucaryotes. Comme l’indique la figure \(\PageIndex{20}\), la synthèse de certains types de lipides est séparée et exclusive. Les glycérophospholipides sont principalement formés dans le réticulum endoplasmique, bien qu’ils soient également fabriqués dans les mitochondries et les peroxysomes. En revanche, les sphingolipides ne sont pas fabriqués dans l’ER (bien que leurs précurseurs de céramide soient) chez les mammifères, les enzymes nécessaires se trouvent dans la lumière du Golgi cis et médial. Il existe des preuves d’un trafic vésiculaire antérograde et rétrograde entre les différents compartiments Golgi et ER, ce qui indiquerait théoriquement une redistribution des types de lipides. Cependant, les sphingolipides ont tendance à s’agréger en radeaux lipidiques et semblent être plus concentrés dans des vésicules se déplaçant en antérograde.
Les protéines du pelage se détachent peu après la libération vésiculaire. Pour la clathrine, le processus implique Hsc70, une ATPase. Cependant, pour les vésicules enrobées de COPI ou COPII, l’hydrolyse du GTP sur ARF/Sar1p semble affaiblir l’affinité protéique de la couche pour les adaptateurs et initie le décollement. L’activateur de la GTPase est l’ARF GAP (ou Sec23p) et fait partie intégrante de la couche de COP I (ou II).
Les vésicules portent deux catégories de cargaison: les protéines solubles et les protéines transmembranaires. Parmi les protéines solubles, certaines sont reprises dans la vésicule en raison de leur liaison à un récepteur. D’autres protéines se trouvent juste à proximité et sont récupérées au fur et à mesure que la vésicule se forme. De temps en temps, une protéine qui n’était pas censée l’être est absorbée; par exemple, l’IDP peut être enfermée dans une vésicule se formant à partir de l’URGENCE. Il a peu de fonction dans le Golgi, et est nécessaire dans les urgences, alors que lui arrive-t-il? Heureusement, PDI et de nombreuses autres protéines ER ont une séquence signal C-terminale, KDEL (Lysine – Acide Aspartique – Acide Glutamique – Leucine), qui crie « J’appartiens aux URGENCES. »Cette séquence est reconnue par les récepteurs KDEL à l’intérieur du Golgi, et la liaison des protéines KDEL aux récepteurs déclenche la formation de vésicules pour les renvoyer aux URGENCES.
Les vésicules sécrétoires ont un problème particulier avec la cargaison soluble. Si la vésicule devait s’appuyer simplement sur l’enfermement de protéines en son sein pendant le processus de formation, il serait difficile d’obtenir des concentrations élevées de ces protéines. De nombreuses protéines sécrétées sont nécessaires à l’organisme rapidement et en quantités importantes, il existe donc un mécanisme dans le Golgi trans pour agréger les protéines sécrétoires. Le mécanisme utilise des protéines d’agrégation telles que la sécrétogranine II et la chromogranine B qui rassemblent les protéines cibles en gros granules concentrés. Ces granines fonctionnent mieux dans le milieu trans Golgi de pH faible et de Ca2 + élevé, donc lorsque la vésicule libère son contenu à l’extérieur de la cellule, le pH plus élevé et le Ca2 + inférieur séparent les agrégats pour libérer les protéines individuelles.
Il y a un changement de pH constant pendant la maturation du Golgi, de sorte qu’au fur et à mesure que nous passons de ER à Golgi, chaque compartiment a un pH luménal progressivement plus bas (plus acide).
Enfin, il y a la question du ciblage des vésicules. Les vésicules sont beaucoup moins utiles si elles sont jetées dans un train de marchandises moléculaires et déposées au hasard. Par conséquent, il existe un mécanisme d’amarrage qui nécessite une adaptation de la protéine v-SNARE sur la surface cytoplasmique de la vésicule et de la t-SNARE sur la surface cytoplasmique de la membrane cible. La fusion de la vésicule à la membrane ne se produit que s’il y a correspondance. Sinon, la vésicule ne peut pas fusionner et se fixera à un autre moteur moléculaire pour se diriger vers une autre destination, espérons-le correcte. Ce processus est facilité par des protéines attachantes qui entrent initialement en contact avec une vésicule entrante et la rapprochent suffisamment de la cible pour tester l’interaction des protéines de PIÈGE. D’autres protéines sur la vésicule et les membranes cibles interagissent alors et si les pièges correspondent, peuvent aider à « treuiller » la vésicule dans la membrane cible, après quoi les membranes fusionnent. Une règle empirique importante pour comprendre la fusion vésiculaire et aussi la directionnalité des protéines et des lipides membranaires est que le côté face au cytoplasme d’une membrane va toujours faire face au cytoplasme. Par conséquent, une protéine qui se trouve finalement sur la surface externe de la membrane cellulaire aura été insérée dans la surface luménale de la membrane ER pour commencer.
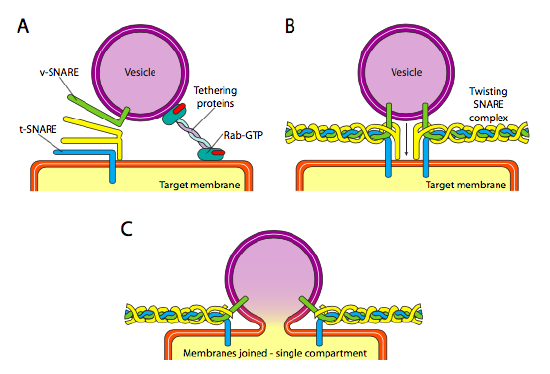
Plus précisément, lorsqu’une vésicule s’approche de la membrane cible, la protéine d’attache Rab-GTP, qui est liée à la membrane cible via une double queue lipidique de géranylgéranyle, s’associe vaguement à la vésicule et la maintient au voisinage de la membrane cible pour donner aux PIÈGES une chance de fonctionner. Les v-SNAREs et les t-SNAREs ont maintenant la possibilité d’interagir et de tester un match. Récemment, les collets ont été renommés R-Collets et Q-Collets, respectivement, à base de résidus d’arginine et de glutamine conservés. En plus de ces deux pièges primaires, au moins un autre PIÈGE est impliqué, formant ensemble un faisceau de quatre hélices α (quatre, pas trois, car au moins dans l’exemple le mieux étudié, l’un des pièges est courbé de sorte que deux de ses domaines alpha-hélicoïdaux participent à l’interaction. Les quatre hélices s’enroulent l’une autour de l’autre et on pense que ce faisant, elles tirent la vésicule et la membrane cible ensemble.
La toxine tétanique, la tétanospasmine, qui est libérée par la bactérie Clostridium tetani, provoque des spasmes en agissant sur les cellules nerveuses et en empêchant la libération de neurotransmetteurs. Le mécanisme pour cela est qu’il clive la synaptobrevine, une protéine PIÈGE, de sorte que les vésicules synaptiques ne peuvent pas fusionner avec la membrane cellulaire. La toxine botulique, de Clostridium botulinum, agit également sur les pièges pour empêcher la fusion des vésicules et la libération de neurotransmetteurs, bien qu’elle cible différents neurones et ait donc l’effet inverse: le tétanos est causé par la prévention de la libération de neurotransmetteurs inhibiteurs, tandis que le botulisme est causé par la prévention de la libération de neurotransmetteurs excitateurs.