Réaction : Hydratation des alcynes
Comme pour les alcènes, l’hydratation (addition d’eau) aux alcynes nécessite un acide fort, généralement de l’acide sulfurique, et est facilitée par le sulfate mercurique. Cependant, contrairement aux additions de doubles liaisons qui donnent des produits alcoolisés, l’addition d’eau aux alcynes donne des produits cétoniques (sauf pour l’acétylène qui donne de l’acétaldéhyde). L’explication de cet écart réside dans la tautomérisation énol-céto, illustrée par l’équation suivante. Le produit initial de l’addition d’eau à un alcyne est un énol (un composé ayant un substituant hydroxyle attaché à une double liaison), qui se réarrange immédiatement en un céto-tautomère plus stable.
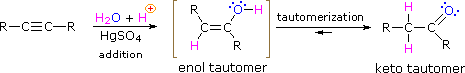
Les tautomères sont définis comme des isomères constitutionnels rapidement interconvertis, généralement distingués par un emplacement de liaison différent pour un atome d’hydrogène labile (coloré en rouge ici) et une double liaison située différemment. L’équilibre entre les tautomères est non seulement rapide dans des conditions normales, mais il favorise souvent fortement l’un des isomères (l’acétone, par exemple, est un tautomère cétonique à 99,999%). Même dans de tels équilibres unilatéraux, la preuve de la présence du tautomère mineur provient du comportement chimique du composé. Les équilibres tautomères sont catalysés par des traces d’acides ou de bases généralement présentes dans la plupart des échantillons chimiques. Les trois exemples ci-dessous illustrent ces réactions pour différentes substitutions de la triple liaison. L’étape de tautomérisation est indiquée par une flèche rouge. Pour les alcynes terminaux, l’addition d’eau suit la règle de Markovnikov, comme dans le deuxième exemple ci-dessous, et le produit final est une méthylcétone (à l’exception de l’acétylène, représenté dans le premier exemple). Pour les alcynes internes (la triple liaison est dans une chaîne plus longue), l’ajout d’eau n’est pas régiosélectif. Si la triple liaison n’est pas située symétriquement (c’est-à-dire si R & R’ dans la troisième équation ne sont pas les mêmes) deux cétones isomères seront formées.
HC≡CH + H2O + HgSO4 & H2SO4 –> –> H3C-CH=O
RC≡CH + H2O + HgSO4 & H2SO4 –> –> RC(=O)CH3
RC≡CR’ + H2O + HgSO4 & H2SO4 –> –> RCH2-C(=O)R’ + RC(=O)-CH2R’
Avec l’ajout de l’eau, des alcynes peut être hydraté pour former enols que spontanément tautomerize à des cétones. La réaction est catalysée par des ions mercure. Suit la règle de Markovnikov: Les alcynes terminaux donnent des méthylcétones
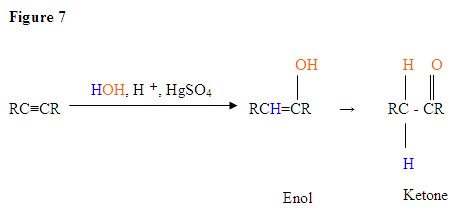
- La première étape est une réaction acide / base où les électrons π de la triple liaison agissent comme une base de Lewis et attaquent le proton, ce qui proteste le carbone avec le plus de substituants d’hydrogène.
- La deuxième étape est l’attaque de la molécule d’eau nucléophile sur le carbocation électrophile, qui crée un ion oxonium.
- Ensuite, vous déprotonez par une base, générant un alcool appelé énol, qui se tautomérise ensuite en cétone.
- Le tautomérisme est un décalage simultané du proton et de la double liaison, qui va de la forme énol à la forme céto-isomère, comme indiqué ci-dessus à la figure 7.
Regardons maintenant quelques réactions d’hydratation.
L’hydratation de l’Alcyne Terminal produit des méthylcétones
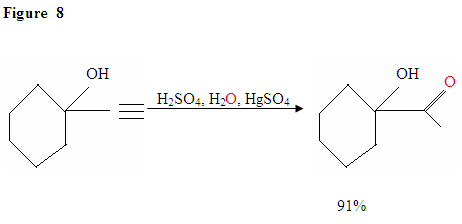
Tout comme décrit dans la figure 7, les électrons π vont attaquer un proton, formant un carbocation, qui est ensuite attaqué par les molécules d’eau nucléophiles. Après déprotination, nous générons un énol, qui se tautomérise ensuite sous la forme cétonique montrée.
Hydratation de l’alcyne
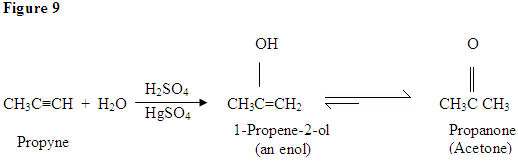
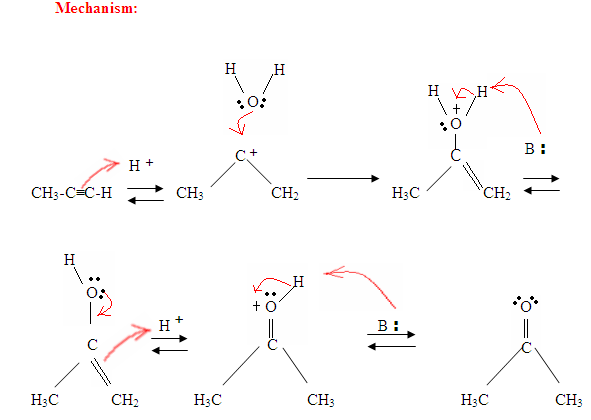
Comme vous pouvez le voir ici, les électrons π de la triple liaison attaquent le proton, qui forme une liaison covalente sur le carbone avec le plus de substituants d’hydrogène. Une fois que l’hydrogène est lié, vous avez un carbocation, qui est attaqué par la molécule d’eau. Maintenant, vous avez une charge positive sur l’oxygène, ce qui entraîne l’entrée d’une base et la déprotection de la molécule. Une fois déprotiné, vous avez un énol, qui est ensuite tautomérisé.
Le tautomérisme est montré ici lorsque le proton est attaqué par les électrons π à double liaison formant une liaison covalente entre le carbone et l’hydrogène sur le carbone moins substitué. Les électrons de l’oxygène finissent par se déplacer vers le carbone, formant une double liaison avec le carbone et se donnant une charge positive, qui est ensuite attaquée par la base. La base déprotinate l’oxygène, ce qui donne le produit final plus stable à l’équilibre, qui est une cétone.
Exercice \(\PageIndex{1}\)
- Dessinez la structure du produit formé lorsque chacune des substances ci-dessous est traitée avec H2O / H2SO4 en présence de HgSO4.
- $\ce{\sf{CH3-CH2-C#C-H}}$
-
- Dessinez la structure de la forme céto du composé illustré ci-dessous. Quelle forme vous attendez-vous à être la plus stable?
Réponse
Réponses:
La forme céto doit être la plus stable.
Questions
Q9.4.1
Par quel alcyne commenceriez-vous pour obtenir les produits suivants, dans une réaction d’oxydation? Gardez à l’esprit la résonance.

Q9.4.2
Proposent un schéma réactionnel pour le composé suivant à partir de l’alcyne et montrant les réactifs et intermédiaires requis.

Solutions
S9.4.1

L9.4.2
