DISCUSSION
Nous avons déterminé ici les tailles de génome de 25 espèces de chironomidés; ces valeurs étaient congruentes avec les tailles de génome des trois espèces précédemment rapportées dans la littérature (Petitpierre, 1996; Schmidt-Ott et al., 2009), qui étaient compris entre 0,13 et 0,21 pg d’ADN. Les résultats de cette étude ont montré que les tailles de génome des chironomidés étaient uniformément très petites (Fig. 3, Tableau 1). La valeur moyenne de C obtenue pour la famille des Chironomidae est de 0,13 +0.ADN 03 pg, qui est clairement plus petit que la taille du génome de D. melanogaster. La plus petite taille de génome parmi les insectes a été enregistrée chez le Strepsiptera Caenocholax fenyesi avec environ 0,11 pg d’ADN (correspondant à environ 108 Mb), bien que la mouche de Hesse Mayetiola destructor ait également suggéré une taille de génome encore plus petite de 0,09 pg (Johnston et al., 2004; Gregory, 2014). Ici, nous signalons au moins trois espèces avec des génomes plus petits que n’importe quel insecte connu: C. tsushimensis, Diamesa japonica et Hydrobaenus tsukubalatus, avec des valeurs de C de 0,07 pg, 0,08 pg et 0,08 pg, respectivement (tableau 1). À notre connaissance, C. tsushimensis (Fig. 1B) peut maintenant être considéré comme ayant la plus petite taille de génome de tout insecte connu, avec une valeur C de 0,07 pg d’ADN, correspondant à peu près à 68 Mb. Cette valeur est congruente avec la taille du génome d’une espèce apparentée, Clunio marinus, qui a été estimée une fois à 95 Mb et plus récemment à 87,2 Mb (Kaiser et Heckel, 2012; Tobias S. Kaiser, communication personnelle).
Récemment, le génome de la cécidomyie antarctique, B. antarctica, a été séquencé (Kelley et al., 2014). Les auteurs ont affirmé que la taille du génome de cette espèce, estimée à 89.5-105 Mb, était le plus petit parmi tous les insectes. Cependant, nous montrons ici que cette taille du génome est comprise dans la plage normale des valeurs des chironomides. Les auteurs ont également suggéré que la petite taille du génome de B. antarctica était une adaptation à un environnement de froid extrême. Nos données peuvent corroborer cette hypothèse, puisque D. japonica, une espèce alpine de la sous-famille des Diamesinae présente également une taille de génome minuscule. Une autre Diamesinae apparentée, la cécidomyie himalayenne Diamesa sp. on a en fait constaté qu’il était actif à des températures aussi basses que -16 °C (Kohshima, 1984). Cependant, Telmatogeton japonicus, qui est également capable de se développer à très basse température (Danks, 1971; Sunose et Fujisawa, 1982), présente une taille de génome relativement importante, comparée à la moyenne de la famille des chironomidés. Une influence phylogénétique sur la taille du génome doit être prise en compte ici, car B. antarctica appartient à la sous-famille des Orthocladiinae, qui présente en moyenne de petites tailles de génome. Les espèces C. tsushimensis et Hydrobaenus tsukubalatus, présentant les plus petites tailles de génome parmi les chironomidés, appartiennent également à la sous-famille des Orthocladiinae. Ainsi, la petite taille du génome de B. l’antarctique peut simplement constituer un trait ancestral et non le résultat d’une adaptation au froid extrême.
P. vanderplanki est la seule espèce d’insecte connue à atteindre l’anhydrobiose à l’état complètement déshydraté (Fig. 1D) et se rétablissent après réhydratation (Hinton, 1951, 1960a; Watanabe, 2006; Cornette et Kikawada, 2011). Notre groupe de recherche a récemment publié une analyse comparative des séquences génomiques du Polypedilum vanderplanki tolérant à la dessiccation et du Polypedilum nubifer congénère sensible à la dessiccation (Gusev et al., 2014). La comparaison a montré que les deux espèces avaient des tailles de génome similaires et que seul un ensemble limité d’amas de gènes dupliqués était lié à l’anhydrobiose chez P. vanderplanki (Gusev et al., 2014). Les tailles de génome déduites de l’assemblage du génome étaient de 104 Mb pour P. vanderplanki et de 107 Mb pour P. nubifer et ces valeurs ne différaient pas nettement des tailles de génome mesurées pour ces espèces dans la présente étude, qui correspondaient à environ 98 Mb. P. vanderplanki et P. les génomes de nubifer ont montré une faible proportion similaire de répétitions d’ADN et seul un petit nombre d’éléments transposables ont été trouvés, par rapport aux autres espèces de diptères. Cette réduction de la proportion d’éléments transposables a également été observée chez la cécidomyie antarctique, B. antarctica (Kelley et al., 2014). La longueur moyenne des introns a également été considérablement réduite chez la cécidomyie antarctique et chez P. vanderplanki et P. nubifer également (Gusev et al., 2014). Depuis la dessiccation sensible et intolérante au gel P. nubifer partage ces caractéristiques avec la cécidomyie antarctique et la cécidomyie anhydrobiotique, une faible proportion d’éléments transposables et une courte longueur d’intron peuvent constituer une caractéristique partagée par tous les chironomidés et ne pas être directement liée à la tolérance aux environnements extrêmes, même si un effet adaptatif ne pouvait être exclu.
Fig. 3.
Phylogénie des diptères montrant des valeurs de C estimées. La famille des chironomidés est représentée en noir. La ligne en tiret indique la taille du génome de D. melanogaster. Le cladogramme phylogénétique est un consensus de différents Chironomidés et diptères (Yeates et Wiegmann, 1999, 2005; Saether, 2000; Cranston et al., 2012). Les barres d’erreurs indiquent l’écart type. Les tailles de génome sans barres d’erreur ont été obtenues à partir d’études antérieures répertoriées dans la Base de données sur la taille du génome animal (Gregory, 2014).
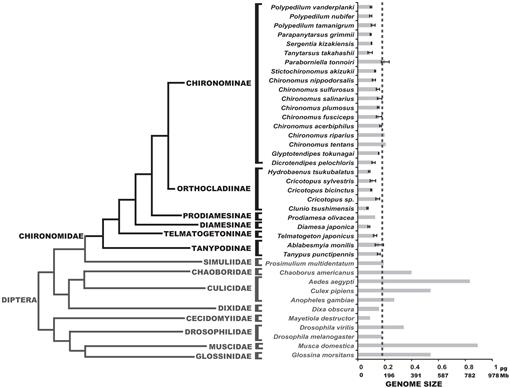
Fig. 4.
Relation entre la taille du corps et la taille du génome parmi les espèces de chironomidés étudiées dans la présente étude. (A) Pour chaque espèce, la longueur totale moyenne du corps est indiquée en millimètres et la valeur moyenne de C est exprimée en ADN pg. Seule une faible corrélation positive (r2 = 0,171, n = 25), matérialisée par une ligne continue, a été observée entre les deux variables. (B) Au niveau du genre, les moyennes des mêmes valeurs ont été transformées par la méthode des contrastes phylogénétiquement indépendants, basée sur la phylogénie de Cranston et al. (2012). La corrélation entre ces contrastes transformés, matérialisés par un trait plein, n’était pas significative (r2 = 0,118, n = 13). L’analyse des données a été effectuée sur Prism 4.0 logiciel pour Macintosh (GraphPad Software, Inc.).

Quels pourraient être les traits adaptatifs potentiellement associés aux minuscules tailles de génome de la famille des Chironomidae? En fait, plusieurs facteurs de développement et écologiques ont été suggérés pour être corrélés à la taille du génome. Premièrement, une corrélation positive entre la taille du génome et la taille du corps a été trouvée chez de nombreux taxons et cette corrélation apparaît comme un phénomène relativement général (Gregory, 2005). Cette corrélation a également été rapportée chez les moustiques (Ferrari et Rai, 1989), mais elle n’est pas toujours claire chez d’autres taxons d’insectes (Gregory et Hebert, 2003; Ardila-Garcia et Gregory, 2009). Chez les chironomidés, nous n’avons trouvé qu’une faible corrélation positive entre la taille du génome et la taille du corps (Fig. 4 BIS). La valeur moyenne de C pour le genre Chironomus (0,15 pg) était supérieure à celle pour le genre Polypedilum (0,10 pg), et cette différence peut être attribuable à la taille corporelle généralement plus grande des espèces de Chironomus. Cependant, la distance phylogénétique entre les deux genres pourrait également expliquer cette différence de taille des génomes. Par conséquent, nous avons corrigé nos données au niveau du genre avec une analyse des contrastes phylogénétiquement indépendante (Garland et Adolph, 1994; Garland et al., 2005) et par conséquent, la corrélation entre la taille du génome et la taille du corps s’est avérée non significative (Fig. 4B). La gamme étroite de tailles du génome des Chironomidés (seulement deux à trois fois) et la petite taille moyenne du corps de ces espèces (la plupart ne dépassent pas quelques millimètres) rendent probablement difficile de trouver une corrélation entre les deux traits au sein de la famille des Chironomidae.
Parmi les insectes, une autre corrélation a été suggérée entre la taille du génome et la complexité du développement. Alors que les insectes hémimétaboles, avec des mues nymphales progressives uniquement, présentent une large gamme de tailles de génome (valeurs C de 0,18 à 16.93 pg), les insectes holométaboles avec leur métamorphose complexe ont des valeurs de C limitées à un seuil putatif de 2 pg, pour la plupart d’entre eux (Gregory, 2002, 2005). L’influence de la complexité du développement sur la taille du génome est ici évidente car les insectes holométaboles subissent un remodelage morphologique intensif pendant le temps limité de la métamorphose et une petite taille du génome présente des avantages pour accomplir des divisions cellulaires à un rythme élevé. Les chironomidés sont des insectes holométaboles et leur métamorphose est extrêmement rapide. Leur stade nymphal peut ne durer qu’un jour, voire quelques heures pour certaines espèces (Cranston, 1995c). Par exemple, C. tsushimensis présente une métamorphose complexe avec un dimorphisme sexuel prononcé (Fig. 1B).
La relation entre la taille du génome et le taux de division cellulaire influence également le taux de développement. Par exemple, il a été suggéré que le cycle de vie rapide des pucerons était lié à la petite taille de leur génome (Ma et al., 1992). Ainsi, les petites tailles de génome devraient constituer un avantage pour les espèces de chironomidés se développant rapidement dans des environnements temporaires. Les chironomidés du genre Clunio peuvent se développer en mares temporaires et montrent également une émergence synchronisée des adultes par rapport au cycle lunaire et pendant la courte fenêtre de la marée basse (Kaiser et Heckel, 2012). Un taux de développement élevé devrait être nécessaire pour y parvenir. Notez que les petites annélides polychètes se développant rapidement dans des environnements interstitiels similaires présentent des tailles de génome plus petites que les espèces macrobenthiques (Gambi et al., 1997). Pour les moucherons de l’Antarctique, tels que B. antarctica ou Eretmoptera murphyi (Lee et al., 2006; Worland, 2010), le développement larvaire dure deux ans, la plupart du temps arrêté à l’état gelé, mais la métamorphose et la reproduction doivent avoir lieu pendant la très courte période estivale. Dans ce cas, un taux de développement élevé est nécessaire et cela peut être facilité par le petit génome de B. antarctica. Ce phénomène a été illustré par une étude sur des plantes angiospermes, montrant que les espèces capables de compléter tout leur cycle de vie pendant le court été antarctique présentaient les plus petites tailles de génome (Bennett et al., 1982). Autre extrême, la cécidomyie anhydrobiotique P. vanderplanki est adaptée aux bassins rocheux éphémères. Là encore, un taux de développement élevé dans un habitat temporaire peut être lié à la petite taille du génome de cette espèce. Cependant, l’espèce australienne P. tonnoiri, qui est également exposée à la dessiccation sur des mares rocheuses similaires (Jones, 1975; Adams, 1985; Frouz et al., 2003), montre une taille de génome relativement importante pour une chironomide (Fig. 3 et Tableau 1).
Les stress abiotiques sont également susceptibles d’influencer l’intégrité de l’ADN et, par conséquent, la taille du génome. Par exemple, les larves de P. les vanderpianki subissent des dommages massifs à l’ADN après une anhydrobiose et une réparation efficace de l’ADN se produit pendant les quelques jours suivant la réhydratation (Gusev et al., 2010). Chez les plantes, une corrélation négative a été trouvée entre la taille du génome et la tolérance aux radiations (Bennett et Leitch, 2005) et le taux de mutation était également plus faible chez les espèces dont la taille du génome était plus petite (Abrahamson et al., 1973). Par conséquent, la petite taille du génome de P. vanderpianki peut représenter un avantage pour éviter l’accumulation de mutations délétères lors des événements de réparation de l’ADN associés aux cycles de dessiccation et de réhydratation. En tant qu’espèce marine, C. tsushimensis est également exposé à un stress de salinité élevé, qui est mortel pour la plupart des espèces d’insectes. Une salinité élevée et d’autres stress abiotiques sont connus pour générer des espèces réactives intracellulaires de l’oxygène (ROS), qui ont été suggérées comme une source principale de dommages à l’ADN (Franca et al., 2007; Gill et Tuteja, 2010). Cela pourrait également être lié à la petite taille du génome. Cependant, d’autres espèces marines tolérantes à la salinité élevée, telles que T. japonicus ou Chironomus salinarius, ne présentent pas de tailles de génome aussi petites que C. tsushimensis. Les espèces tolérantes aux acides, telles que Chironomus sulfurosus, Chironomus acerbiphilus ou Polypedilum tamanigrum (Fig. 1C) peuvent survivre dans des sources chaudes dont le pH est aussi bas que 1,4 (Doi et al., 2004; Takagi et coll., 2005). Là encore, aucune corrélation claire entre la tolérance au stress acide et la petite taille du génome n’a pu être observée et l’influence phylogénétique est apparue plus importante, avec une taille de génome plus petite pour le genre Polypedilum et des tailles de génome plus grandes dans le genre Chironomus.
Pour conclure, les minuscules tailles de génome observées chez les chironomidés sont probablement le résultat d’une réduction ancestrale du nombre d’éléments transposables et de la longueur des introns dans leur structure génomique. Parmi la famille des Chironomidae, les tailles des génomes différaient selon la phylogénie au niveau de la sous-famille et au niveau du genre. Comme on l’a déduit des corrélations chez divers taxons, la petite taille du génome des chironomidés aurait théoriquement pu constituer une préadaptation à des environnements instables et extrêmes grâce à un taux de développement élevé et un faible taux de mutation. Nous espérons que cette étude encouragera de futurs projets sur le génome des chironomidés et que la génomique comparative au sein de ce taxon aidera à comprendre comment les génomes des Chironomidés interagissent avec leur environnement.