Introduction
L’action enzymatique de la phosphodiestérase de type 5 (PDE5) est le principal mécanisme d’inactivation du cGMP, médiateur en aval de l’agent vasodilatateur l’oxyde nitrique (NO) (Lugnier, 2006) .
Au cours de la dysfonction érectile (ED), la production altérée de NO à partir des vaisseaux caverneux endothéliaux peut être surmontée pharmacologiquement par l’utilisation d’inhibiteurs de la PDE5 (PDE5i), afin de prolonger la demi-vie de la GMPc et d’améliorer la fonction vasodilatatrice résiduelle (Hawksworth et Burnett, 2015). Plusieurs molécules ayant une activité inhibitrice sur la PDE5 ont ensuite été projetées et mises sur le marché, montrant un début et une durée d’effet différents. Actuellement, les PDE5i sont les médicaments de premier choix utilisés pour le traitement de la dysfonction érectile (Mehrotra et al., 2007).
Malgré une efficacité reconnue chez près de 80 % des patients DE DE non sélectionnés (Eardley et al., 2010; Hatzimouratidis et al., 2010; Porst et coll., 2013), un abandon remarquable du traitement par PDE5i a été récemment signalé. En termes quantitatifs, un taux d’arrêt moyen de 4 % par mois a été rapporté, avec un abandon global du traitement dans 50 % des cas sur une base annuelle (Carvalheira et al., 2012; Corona et coll., 2016). Parmi les principales raisons invoquées par les patients pour justifier l’abandon du traitement, le manque d’efficacité et les effets secondaires sont considérés comme les plus répandus (Corona et al., 2016). On peut distinguer deux types d’effets secondaires: ceux strictement liés à l’inhibition de la PDE5, tels que maux de tête, bouffées vasomotrices et dyspepsie, et ceux associés à l’activité inhibitrice résiduelle de médicaments sur d’autres PDE, tels que la vasodilatation et la tachycardie (PDE1), troubles visuels (PDE6) et maux de dos (PDE11) (Bischoff, 2004; Gupta et al., 2005). Étant donné que l’apparition d’effets secondaires augmente avec les taux sériques et l’exposition au médicament (Gupta et al., 2005; Taylor et coll., 2009), le profil d’innocuité/efficacité d’un médicament peut également être amélioré par une approche pharmacocinétique par la conception d’une nouvelle formulation de médicament (Mehrotra et al., 2007). Cette approche a été appliquée avec succès à la PDE5i dans le cas du Vardénafil. En effet, cette molécule souffre d’une biodisponibilité relativement faible ( Center15%, Center for Drug Evaluation and Research, 2003). Par rapport au comprimé pelliculé (FCT), la formulation originale pour l’administration per os classique, la formulation de comprimés oro-dispersibles (ODT) pour le Vardénafil a considérablement augmenté la biodisponibilité des médicaments en favorisant l’absorption sublinguale, une voie reconnue pour être moins affectée par le métabolisme de premier passage (Heinig et al., 2011).
Le sildénafil (Sild) a été le premier inhibiteur sélectif de la PDE5 approuvé pour le traitement de la dysfonction érectile (Boolell et al., 1996). Il s’agit d’une molécule relativement lipophile et, après administration orale, la concentration plasmatique maximale est atteinte en un temps variant de 0,5 à 2 h. Le Sild présente une biodisponibilité orale relativement faible (38-41%), principalement due à un métabolisme intestinal étendu et au premier passage (Gupta et al., 2005). Malgré la longue présence sur le marché, le développement de nouvelles formulations de médicaments s’est mal poursuivi, jusqu’à la récente mise sur le marché italien d’une nouvelle formulation: le film oro-dispersible (ODF). En effet, l’ODF a été approuvé comme forme bioéquivalente de FCT (Leoni et al., 2013). Cependant, les formulations à désintégration orale peuvent représenter des systèmes appropriés pour favoriser l’absorption trans-muqueuse, et en particulier sub-linguale (Kathpalia et Gupte, 2013).
Dans cette étude, nous avons évalué la pharmacocinétique du Sild associée à l’administration sublinguale d’ODF ou d’ODT, par rapport au FCT en tant que formulation originale per os. Dans ce but, nous avons étudié le profil de libération / perméation des différentes formulations de Sild par des systèmes in vitro spécifiquement développés pour évaluer l’absorption trans-muqueuse de médicaments. De plus, nous avons quantifié les profils sériques de la pharmacocinétique de la Sild après l’administration de FCT per os, et d’ODT et d’ODF sublinguaux chez les patients atteints de DE.
Matériaux et méthodes
Produits chimiques et Formulations médicamenteuses
Solution de sels d’équilibre de Hank pH 7,4 (HBSS), solution HEPES, benzanilide et citrate de Sild ont tous été achetés auprès de Sigma–Aldrich (Milan, Italie). Afin d’éviter tout résultat confondant résultant de l’utilisation de produits bioéquivalents alternatifs disponibles sur le marché, les produits suivants ont été utilisés: Viagra® FCT (Pfizer, Milan, Italie), Viagra ORO® ODT (Pfizer) et Rabestrom® ODF (IBSA, Lodi, Italie). Des médicaments ont été prescrits aux patients lors d’une évaluation ambulatoire pour leur usage privé. Pour les tests in vitro et l’évaluation in vivo de la pharmacocinétique (voir ci-dessous), les médicaments ont été spécifiquement achetés par le personnel impliqué dans l’étude dans les pharmacies locales, puis manipulés / stockés dans des conditions optimales.
Test de désagrégation
Les tests de désagrégation in vitro ont été effectués selon la Pharmacopée Européenne (2016) à l’aide du Testeur de désintégration des comprimés (Sotax DT 2, Figure supplémentaire S1A), en utilisant de l’eau comme fluide d’immersion à 37 ± 0,5 ° C. Le temps de désagrégation a été vérifié à la désintégration complète de la forme posologique. La désintégration complète est définie comme l’état dans lequel tout résidu de l’unité restant sur l’écran de l’appareil d’essai ou adhérant à la surface inférieure des disques est une masse molle sans noyau palpablement ferme. Les essais ont été effectués en trois exemplaires et les résultats ont été présentés sous la forme d’une valeur moyenne ± écart-type.
Test de dissolution
Des tests de dissolution in vitro des médicaments ont été effectués selon la Pharmacopée européenne. Les essais de dissolution ont été effectués à l’aide d’un appareil à palettes, vitesse de la palette 50 tr / min, et HBSS pH 7,4 a été utilisé comme volume moyen de dissolution (900 ml à 37 ± 0,5 ° C).
Pendant les essais de libération, 2 ml d’échantillon de milieu de dissolution, à 0, 2, 4, 6, 10, 20, 30, et 40 min, a été éliminé et filtré à travers un filtre d’esters de cellulose 0,45 µm et donc dilué. Par la suite, la quantification du Sild a été réalisée par chromatographie liquide à haute performance (HPLC)-UV. Le volume retiré a été remplacé à chaque fois par du milieu frais. Les essais ont été effectués en trois exemplaires et les résultats ont été présentés sous la forme d’une valeur moyenne ± écart-type. Les données ont été normalisées sur la teneur en médicament de la formulation.
Test de perméation trans-muqueuse
Le profil de perméation Trans-muqueuse de Sild a été évalué in vitro en utilisant un dispositif spécifique selon Delvadia et al. (2012) modifié de manière appropriée. Brièvement, le dispositif consistait en un système de diffusion verticale caractérisé par des chambres donneurs–récepteurs séparées par une membrane jetable en acétate de cellulose (pore 0,45 µm). La cellule donneuse contenait 1,5 ml d’HBSS, tandis que la chambre réceptrice faisait partie d’un circuit fermé de recirculation de 30 ml comprenant les volumes de tubulure et de réservoir. L’échantillonnage a été effectué à partir du réservoir de la chambre de réception à des intervalles de temps de 0, 5, 10, 20, 30, et 40 min et remplacé par un volume équivalent d’HBSS frais. Les échantillons ont été analysés par HPLC-UV pour la teneur en médicament (Fejős et al., 2014). Les données ont été normalisées sur la concentration de Sild imprégné la plus élevée observée pour le citrate de Sild pur. Les essais ont été effectués en trois exemplaires et les résultats ont été présentés sous la forme d’une valeur moyenne ± écart-type.
Etude Pharmacocinétique sur des Patients Volontaires atteints de Dysfonction érectile Psychogène
L’étude a été menée dans l’Unité d’Andrologie et de Médecine de la Reproduction (Hôpital Universitaire de Padoue, Italie), entre mai et septembre 2017, conformément à la Déclaration d’Helsinki sous l’approbation du Comité d’Éthique de l’Hôpital Universitaire de Padoue (protocole numéro 3982 / AO / 16 et amendements successifs). Afin d’éviter de confondre les résultats, des sujets atteints de dysfonction érectile psychogène ont été inclus car la fréquence plus faible de dérangements organiques s’associe à la dysfonction érectile (Ludwig et Phillips, 2014).
La taille de l’échantillon a été calculée afin d’atteindre une taille d’effet d’au moins 0,5 avec une puissance statistique de 0,8 et un niveau de signification de 0,05 pour une comparaison à trois groupes (voir calculateur de puissance – ANOVA indépendante unidirectionnelle).
Vingt patients (âge moyen 31,4 ± 5,7 ans) ont été inscrits consécutivement après la publication du consentement éclairé signé. Les patients ont assisté à une évaluation ambulatoire signalant l’incapacité constante d’obtenir et de maintenir une érection pour des rapports sexuels satisfaisants au cours des 6 mois précédents ou plus. Une évaluation clinique ultérieure a été réalisée chez tous les patients afin de vérifier l’absence de maladies liées à la dysfonction érectile, telles que le diabète sucré, l’hypertension, les troubles neurologiques et l’utilisation d’antidépresseurs. Le diagnostic de dysfonction érectile psychogène a été confirmé par la réalisation d’un score d’indice < 26 lors de l’administration du questionnaire International Index of Erectile Function-15 (IIEF-15) (Lotti et al., 2016) et le maintien des érections spontanées nocturnes, évaluées par la Surveillance Nocturne de la Tumescence Pénienne et de la Rigidité via le Système d’évaluation de la rigidité RigiScan Plus (Dacomed, États-Unis) pendant deux nuits consécutives comme décrit précédemment (Munoz et al., 1993; Caretta et coll., 2005). Les critères d’exclusion étaient le diagnostic de tumeurs malignes, des taux plasmatiques hormonaux anormaux (respectivement, hormone lutéinisante > 8 UI / l, testostérone totale < 10,4 nmol / l, thyrotropine > 4,5 mUI / l, prolactine > 20 ng / ml) et une épaisseur accrue de l’intima-milieu au niveau des troncs supra-aortiques (> 0.9 mm) et/ou des artères caverneuses (> 0,3 mm), évaluées par Échographie Doppler couleur comme décrit précédemment (Caretta et al., 2005, 2009).
Les patients ont accepté de suivre une étude ouverte croisée à trois voies à dose unique. Le schéma posologique du médicament est indiqué à la figure 1. La posologie de Sild a été choisie à 50 mg, en accord avec les rapports précédents sur le traitement de la dysfonction érectile psychogène (Banner et Anderson, 2007). Les patients ont été priés de ne pas prendre de drogue ou d’alcool pendant 1 semaine avant et pendant le cours de l’étude. De plus, pendant la journée de dosage du médicament, les patients devaient également prendre un petit-déjeuner non gras (pas de lait ou d’autres aliments gras) au moins 2 h avant le test. Le FCT, considéré comme formulation de référence, a été administré de manière classique per os en avalant le comprimé oral avec un verre d’eau. Pour l’ODT et l’ODF, les patients ont été invités à maintenir la formulation sous la langue pendant 15 min sans l’hypothèse d’eau, suivie d’une déglutition. Des échantillons de sang veineux ont été prélevés dans des tubes standard (Vacutainer, BD Biosciences, Milan, Italie) à 0, 5, 10, 15, 30, 60, 90, 120, et 240 minutes après l’administration du médicament. Une compensation par perfusion continue de solution saline stérile a été effectuée. Après l’administration, les sujets ont été logés jusqu’à la fin du prélèvement sanguin. Un prélèvement sanguin supplémentaire a été effectué à 24 h de l’administration pour des raisons de contrôle afin de vérifier la clairance complète du médicament. Comme périodes de lavage, 7 jours ont été autorisés entre une dose et les suivantes. Après la collecte de sang, le plasma a été immédiatement isolé et stocké à -80 ° C jusqu’à utilisation.
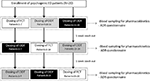
FIGURE 1. Schéma posologique et évaluations pour l’évaluation des paramètres pharmacocinétiques chez 20 patients atteints de dysfonction érectile psychogène (DE), subdivisés en trois groupes (respectivement, Patients de 1 à 7, Patients de 8 à 14 et Patients de 15 à 20). Chaque groupe de patients a alternativement reçu un comprimé pelliculé per os (FCT), un comprimé oro-dispersible sublingual (ODT) ou un film oro-dispersible sublingual (ODF) avec au moins 1 semaine de lavage après chaque administration. Toutes les formulations contenaient 50 mg de sildénafil (Sild).
Pendant le logement, les patients ont également été invités à enregistrer les effets indésirables des médicaments (EIM) sous une forme spécialement conçue, adaptée du formulaire de déclaration des EIM de l’Agenzia Italiana del Farmaco (AIFA1). Une version traduite du questionnaire est disponible en tant que Matériel supplémentaire (voir la Fiche technique supplémentaire S1). Les patients ont été invités à préciser le type d’effet indésirable, l’intensité globale (sur une échelle d’évaluation subjective de 1, très faible, à 5, très intense), le moment de l’apparition et la durée globale.
Quantification du Sildénafil dans le sérum humain
Pour la quantification des taux sériques de Sild, on a ajouté 400 µl d’échantillon sérique de 500 µl de méthanol additionné de l’étalon interne (IS) benzanilide (5 µg/ml). Par la suite, 5 ml d’acétate d’éthyle ont été ajoutés au mélange, les échantillons ont été vortexés pour effectuer une extraction liquide–liquide, les deux phases ont été séparées par centrifugation. La partie organique est ensuite évaporée sous centrifugeuse sous vide à 40°C. Le résidu obtenu a été ré-dissous avec 200 µl de méthanol et finalement utilisé pour l’analyse chromatographie liquide haute performance – spectrométrie de masse en tandem (HPLC-MS/ MS).
Chromatographie liquide haute performance – Analyse MS/MS utilisant un système Agilent-Varian 1260 et le détecteur triple-quadruple Agilent-Varian 320 MS. La séparation chromatographique a été réalisée sur une colonne Phenomenex C-18 Evo 3 × 100 et une phase mobile constituée d’acétonitrile avec 0,1% d’acide formique dans l’eau avec un gradient détaillé sur la Figure supplémentaire S2A. Un mode de détection positif a été appliqué pour la transition 198 > 105 Da de l’IS, obtenue avec une tension capillaire de 40 V et une énergie de collision de 16 V tandis que 475 > 100 Da pour le Sild avec une tension capillaire de 40 V et une énergie de collision de 22,5 V, respectivement. Des chromatogrammes représentatifs de l’IS et de la Sild dans des échantillons réels sont présentés dans la figure supplémentaire S2B.
Analyse statistique
Les paramètres pharmacocinétiques (PK), tels que la concentration sérique maximale (Cmax), le délai jusqu’à la concentration sérique maximale (tmax) et l’aire sous la courbe (ASC) à différents moments, ont été calculés avec des routines spécifiques d’applications avec le logiciel GraphPad (La Jolla, CA, États-Unis). L’analyse statistique des données a été réalisée avec SPSS 21.0 pour Windows (SPSS, Chicago, IL, États-Unis). Le test de Kolmogorov–Smirnov a été utilisé pour vérifier la normalité de la distribution. Les variables n’affichant pas de distribution normale ont été transformées en log. Les caractéristiques de base des patients, les PKs et les données d’expériences in vitro ont été comparées aux tests t de Student non appariés avec correction de Bonferroni-Holm pour des comparaisons multiples. Des mesures répétées d’ANOVA ont été effectuées pour tester les différences de libération du médicament et de concentration sérique de Sild. Le test de Levene a été utilisé pour tester l’homogénéité de la variance entre les groupes. Si l’hypothèse d’homogénéité de la variance a été violée, un test de Welch a été effectué et la valeur P respective a été rapportée. La proportion d’ADR a été comparée au test exact χ2. P- valeurs < 0.05 ont été considérés comme statistiquement significatifs.
Résultats
Analyse in vitro de la Libération/Perméation du Sildénafil à partir des Différentes Formulations médicamenteuses
La dynamique de libération et de perméation du Sild à partir des trois formulations médicamenteuses a été précédemment étudiée in vitro (Figure 2). Le temps nécessaire pour compléter la désagrégation des FCT, ODT et ODF a été évalué au moyen d’un test standard décrit dans la Pharmacopée européenne (2016; Figure 2A). ODF a montré le temps de désagrégation le plus élevé par rapport à FCT et ODT (respectivement, P = 0,017 et P = 0,008).
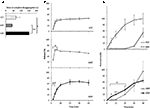
FIGURE 2. Évaluation in vitro des propriétés bio-technologiques des FCT, ODT, ETODFS contenant 50 mg de Sild. Les résultats sont représentatifs de trois expériences indépendantes et rapportés sous forme de valeurs moyennes ± écart type. A) Résultats de l’essai de désagrégation, indiquant le temps (en secondes) nécessaire à la désagrégation complète de la formulation. Signification : ∗P < 0,05 et ∗∗P < 0,01 entre les formulations indiquées. (B) Les résultats du test de dissolution, indiquant la quantité de Sild libérée par chaque formulation en pourcentage de la dose du médicament. Signification: aP < 0,01 vs FCT; bP < 0,001 vs ODT. C) Les résultats de l’essai de perméation (détaillés dans la section « Matériaux et méthodes ») indiquant la quantité de Sild imprégnée à travers une membrane d’acétate de cellulose, en pourcentage de la valeur la plus élevée atteinte par 50 mg de poudre de Sild pur (ligne discontinue dans le panneau supérieur). Signification: ∗P < 0,05 vs. ODT; ∗∗P < 0,01 vs. ODT; aP < 0,01 vs. FCT.
Afin d’évaluer l’influence de ces preuves sur la libération du médicament par la formulation, un test de dissolution standard a été effectué (Pharmacopée européenne, 2016; Figure 2B). Par rapport à la formulation de référence FCT, ODT a montré une libération plus rapide du médicament dont l’étendue maximale a été atteinte même après seulement 2 minutes depuis le début du test (P = 0,006 vs FCT). D’autre part, le pourcentage de médicament libéré par l’ODF au cours des 4 premières minutes de l’essai était inférieur à celui du FCT et de l’ODT (respectivement, P = 0,004 et P < 0,001). En particulier, ODF a montré une libération plus progressive du médicament par rapport au FCT, atteignant la mesure maximale après 20 minutes depuis le début du test.
Sur cette base, la perméation trans-muqueuse du Sild de chaque formulation a été évaluée par un dispositif spécialement développé (figure 2C). A titre de référence, le citrate de Sild pur, utilisé en poids équivalent à 50 mg de Sild, a été évalué pour la perméation trans-muqueuse et a montré une diffusion libre et rapide entre les deux chambres. Un profil presque opposé a été observé pour le FCT, montrant une perméation négligeable jusqu’à 30 min du début de l’essai. Les profils de perméation d’ODT et d’ODF ont montré un comportement intermédiaire par rapport aux deux conditions précédentes. Dans les 20 premières minutes de l’essai, l’ODF a montré un degré de perméation significativement plus élevé par rapport à l’ODT (respectivement, P = 0,033 à 5 minutes, P = 0,003 à 10 minutes et P = 0,041 à 20 minutes). Contrairement au FCT et à l’ODT qui se désagrégent complètement dans la chambre du donneur, une masse résiduelle de gelée molle d’ODF a persisté sur la membrane d’acétate de cellulose même à la fin du test (Figure supplémentaire S2C).
Pharmacocinétique différentielle du sildénafil
Vingt sujets masculins atteints de DE psychogène ont accepté de recevoir alternativement FCT, ODT ou ODF, séparés par une semaine de lavage. Comme détaillé dans la section « Matériaux et méthodes », le FCT a été avalé de manière classique pour permettre l’administration per os classique tandis que l’ODT et l’ODF ont été maintenus sous la langue pendant 15 min pour favoriser la voie sublinguale. Les caractéristiques cliniques des patients sont rapportées dans le tableau 1. Les taux sériques de Sild correspondant aux trois conditions de dosage sont rapportés à la figure 3. Le profil sérique du médicament des trois formulations présentait une variabilité considérable. Par rapport à la FCT, l’ODT a montré une augmentation précoce apparente des taux sériques de Sild; cependant, cette tendance n’était pas statistiquement significative. D’autre part, une décroissance plus rapide des niveaux de Sild à 120 et 240 min après le dosage a été observée pour la formulation ODT (respectivement, P = 0,044 et P = 0,024 vs. FCT).
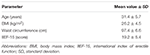
TABLEAU 1. Caractéristiques cliniques des participants à l’étude (N = 20).
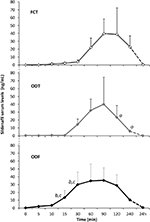
FIGURE 3. Évaluation in vivo des taux sériques de Sild, chez 20 patients atteints de dysfonction érectile psychogène, recevant alternativement le FCT per os, ou l’ODT sublinguale, ou l’ODF sublinguale comme détaillé dans la section « Matériaux et méthodes. »Les données sont déclarées sous forme de valeurs moyennes ± Signification de l’écart-type: aP < 0,05 vs FCT; bP < 0,01 vs FCT; cP < 0,05 vs ODT.
Le profil sérique du médicament de la formulation ODF a montré une augmentation plus rapide des taux de Sild par rapport au FCT (P = 0,001 et P = 0,003) et au ODT (P = 0,048 et P = 0,041), respectivement, à 15 et 30 minutes après l’administration. En accord avec son temps de désagrégation lent in vitro (figure 2B), la courbe concentration–temps moyenne de l’ODF in vivo était plus lisse que celles de la FCT et de l’ODT (figure 3).
Les paramètres pharmacocinétiques des trois formulations, obtenus à partir de l’analyse des taux sériques de Sild, sont résumés dans le tableau 2. Bien qu’aucune différence significative n’ait été observée entre les trois formulations en termes de Cmax, tmax et ASC0-240 min, ODF a montré la valeur la plus faible de Cmax (38,2 ± 23,7 ng / ml) et la tmax la plus courte (70,0 ± 24,5 min). En particulier, ODF a affiché une valeur significativement plus élevée de l’ASC0-60 min par rapport à FCT et ODT (respectivement, P = 0,005 et P = 0.043), entraînant une biodisponibilité relative accrue du Sild dans la première heure suivant le dosage de l’ODF par voie sublinguale.

TABLEAU 2. Paramètres pharmacocinétiques des formulations de sildénafil.
Effets indésirables du médicament
Les résultats obtenus à partir du questionnaire auto-administré sur le type et les caractéristiques des effets indésirables observés par les participants à l’étude sont résumés dans le tableau 3. Parmi les ADR connus rapportés pour Sild (Taylor et al., 2009), les plus fréquemment enregistrés étaient les maux de tête, les bouffées vasomotrices et la congestion nasale. Un patient a signalé une douleur musculaire de bas grade (grade 1 à l’échelle d’évaluation subjective) après l’administration de FCT. Aucun des patients n’a signalé une altération de la vision, une tachycardie, une faiblesse ou une altération de l’audition.

TABLEAU 3. Effets indésirables enregistrés par les participants à l’étude (N = 20).
Par rapport à la FCT comme formulation de référence, l’ODT a montré une prévalence non variable de l’ADR. Cependant, la perception personnelle de l’intensité du rinçage était significativement plus faible (P = 0,031). D’autre part, l’ODF a montré une prévalence réduite de maux de tête par rapport à la FCT (P = 0,043). De plus, la durée et l’intensité des bouffées vasomotrices et de la congestion nasale ont été perçues à des niveaux inférieurs par rapport à la FCT (respectivement, P = 0,011 et P = 0,015) et à l’ODT (respectivement, P = 0,026 et P = 0,037).
Discussion
Dans cette étude, nous apportons la preuve que la voie sublinguale de l’administration de Sild s’associe à une biodisponibilité précoce accrue du médicament et à un profil de tolérance amélioré. Ces preuves sont corroborées par des études in vitro, montrant que la formulation de Sild est caractérisée par un temps de désagrégation plus long mais une absorption trans-muqueuse significativement favorisée, et des preuves in vivo.
Les inhibiteurs de la phosphodiestérase sont l’option thérapeutique de premier choix pour le traitement de la dysfonction érectile; cependant, les effets secondaires ressentis par les patients sont reconnus comme la raison la plus répandue de l’arrêt du traitement (Corona et al., 2016). La modification de la pharmacocinétique par la conception d’une nouvelle formulation de médicament peut représenter une stratégie intéressante pour améliorer le profil d’innocuité/efficacité du médicament lui-même (Mehrotra et al., 2007). À cet égard, l’expiration en 2013 du brevet sur le citrate de Sild dans plusieurs pays européens a permis la sortie d’un certain nombre de nouvelles formulations de Sild. Il convient de noter que la plupart des formulations de Sild disponibles sur le marché aujourd’hui sont en fait approuvées comme formes bioéquivalentes du FCT original (Leoni et al., 2013). Il est intéressant de noter que des formulations à désintégration orale, caractérisées par une désagrégation rapide dans la bouche du patient sans avoir besoin d’avaler avec de l’eau, ont été développées (Goel et al., 2008). Ces nouvelles formulations trouvent une meilleure observance chez les populations de patients ayant des difficultés à avaler des doses solides conventionnelles, telles que les enfants, les patients gériatriques et les patients dysphagiques. De plus, en offrant une plus grande disponibilité de médicaments par voie orale, les formulations à désintégration orale peuvent représenter des systèmes valorisés pour favoriser l’absorption trans-muqueuse, et en particulier sub-linguale (Kathpalia et Gupte, 2013). En particulier en Italie, deux formulations de Sild à désintégration orale sont officiellement disponibles dans les pharmacies: les ODT et les ODF.
Dans cette étude, nous avons cherché à évaluer les variations pharmacocinétiques possibles, et le schéma d’ADR correspondant, dérivant de la faveur de l’absorption trans-muqueuse du Sild par l’administration sous-linguale des deux formulations oralement désintégrantes disponibles du médicament. Les résultats ont été comparés à la formulation originale de Sild, à savoir le FCTS. Fait intéressant, nous avons trouvé une corrélation stricte, in vitro et in vitro, entre les propriétés bio-technologiques et les PKs des différentes formulations. En particulier, malgré une dose de médicament égale (50 mg) et un taux de libération de médicament légèrement réduit dans le test de dissolution, l’ODF a été caractérisé par un temps de désagrégation plus long et un taux de perméation plus élevé dans le modèle trans-muqueux d’une part, et par une biodisponibilité accrue du médicament dans la première heure suivant l’administration, d’autre part. Nous pourrions alors émettre l’hypothèse que l’absorption du Sild sous-lingual est favorisée par un contact prolongé médicament-muqueuse. En effet, ce phénomène est généralement poursuivi pour les médicaments trans-muqueuses oraux, où l’utilisation de polymères muco-adhésifs est recommandée pour assurer une période prolongée de contact entre la formulation et la muqueuse buccale (Lam et al., 2014), en particulier de ces médicaments, comme le Sild, affectés par une faible solubilité dans l’eau (Zayed et al., 2012; Sun et coll., 2014). Ces résultats préliminaires suggèrent également une amélioration possible de l’efficacité clinique de cette classe de médicaments par rapport aux formulations originales. D’autres études sont nécessaires pour clarifier ces aspects.
La preuve la plus frappante de la présente étude est une réduction significative des effets indésirables de l’administration sub-linguale d’ODF, par rapport à l’ODT et au FCT administrés à la même dose, ce qui peut entraîner une augmentation de l’observance chez les patients. Cette preuve peut être interprétée à la lumière du principe selon lequel l’incidence d’un effet secondaire d’un médicament augmente en augmentant les taux sériques et le temps d’exposition au médicament lui-même (Gupta et al., 2005; Taylor et coll., 2009). Malgré une biodisponibilité globale non variable par rapport aux autres formulations analysées, l’administration sub-linguale d’ODF a montré une valeur inférieure de Cmax et une tmax plus courte, ce qui a entraîné une proportion significativement plus élevée de Sild bio-disponible dans la première heure suivant l’administration. Ainsi, nous pourrions supposer que l’administration sub-linguale d’ODF combine une absorption efficace du médicament avec l’atteinte de taux sériques moyens plus faibles de Sild et un risque d’effets indésirables plus faible. Cependant, nous reconnaissons que la faible taille de l’échantillon est le principal inconvénient de l’étude. Une enquête plus approfondie sur des cohortes plus importantes et avec des dosages différents est nécessaire pour confirmer ce problème.
En conclusion, dans cette étude, nous rapportons que l’administration sublinguale de Sild ODF améliore le profil de tolérance du médicament grâce à l’implication probable d’une pharmacocinétique modifiée par rapport aux FCT génératrices. Bien que l’ODF n’ait pas été conçu à l’origine à cette fin, il s’agit d’une stratégie attrayante pour améliorer la conformité du patient au traitement. Nous développons d’autres études comparatives pour évaluer l’efficacité clinique chez les patients atteints de dysfonction érectile psychogène et organique.
Contributions des auteurs
LDT et CF ont coordonné l’étude et rédigé le manuscrit. Le MDRP a évalué et inscrit les patients. EF a effectué une analyse in vitro. SDA a effectué l’analyse sérique. RP a effectué la comparaison pharmacocinétique. RP, NR et AG ont révisé et finalisé le manuscrit de manière critique.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions le Dr Alberto Barosso, le Dr Giuseppe Maggioni et le Dr Dimitri Portale pour le conseil des patients, le Dr Flavia Rosano et le Dr Alice Passadore pour la prise en charge des patients, ainsi que tout le personnel de l’Unité d’Andrologie et de Médecine de la reproduction.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à l’adresse suivante:: https://www.frontiersin.org/articles/10.3389/fphar.2018.00059/full#supplementary-material
FIGURE S1 / Images représentatives du Testeur de désintégration des comprimés (A) et de l’Appareil de dissolution (B) utilisés respectivement pour le test de désagrégation et le test de dissolution.
FIGURE S2/ (A) Détails du gradient de phase mobile utilisé pour l’analyse par chromatographie liquide à haute performance – spectrométrie de masse en tandem (HPLC-MS / MS) des taux sériques de sildénafil (Sild). Des chromatogrammes et des spectres de masse représentatifs des deux Sild au benzanilide étalon interne dans des échantillons réels sont rapportés (B). (C) Image représentative du film orodispersible résiduel (mis en évidence par une ligne discontinue), persistant après le test de perméation dans le dispositif utilisé pour l’estimation in vitro de l’absorption trans-muqueuse à travers une membrane d’acétate de cellulose.
FICHE TECHNIQUE S1 / Questionnaire sur les effets indésirables des médicaments.
Note de bas de page
- ^http://www.aifa.gov.it/en/content/reporting-adverse-reaction
Banner, L. L., et Anderson, R.U. (2007). Sildénafil intégré et thérapie sexuelle cognitivo-comportementale pour la dysfonction érectile psychogène: une étude pilote. J. Le sexe. Med. 4, 1117–1125. doi: 10.1111/j.1743-6109.2007.00535.x
Résumé PubMed / Texte intégral Croisé / Google Scholar
(2004). Puissance, sélectivité et conséquences de la non sélectivité de l’inhibition de la PDE. Int. J. Impot. Rés. Suppl. 1, S11–S14. doi: 10.1038 / sj.ijir.3901208
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Les résultats de cette étude sont les suivants : (1996). Sildénafil: inhibiteur cyclique de la phosphodiestérase spécifique aux BPF de type 5 actif par voie orale pour le traitement de la dysfonction érectile du pénis. Int. J. Impot. Rés. 8, 47 à 52.
Résumé PubMed / Google Scholar
Caretta, N., Palego, P., Ferlin, A., Garolla, A., Bettella, A., Selice, R., et al. (2005). Reprise des érections spontanées chez des patients sélectionnés atteints de dysfonction érectile et de divers degrés d’altération de la paroi carotidienne: rôle du tadalafil. EUR. Urol. 48, 326–331. doi: 10.1016/j. eururo.2005.01.013
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Caretta, N., Palego, P., Schipilliti, M., Ferlin, A., Di Mambro, A. et Foresta, C. (2009). Épaisseur de l’intima-média de l’artère caverneuse: un nouveau paramètre dans le diagnostic de la dysfonction érectile vasculaire. J. Le sexe. Med. 6, 1117–1126. doi: 10.1111/j.1743-6109.2008.01112.x
Résumé PubMed / Texte intégral Croisé / Google Scholar
Carvalheira, A. A., Pereira, N. M., Maroco, J., et Forjaz, V. (2012). Abandon dans le traitement de la dysfonction érectile avec PDE5: une étude sur les prédicteurs et une analyse qualitative des raisons de l’arrêt du traitement. J. Le sexe. Med. 9, 2361–2369. doi: 10.1111 / j.1743-6109.2012.02787.x
Résumé PubMed / Texte intégral Croisé / Google Scholar
Centre d’Évaluation et de recherche sur les médicaments (2003). NDA 021400 Comprimés de Levitra (Chlorhydrate de Vardénafil): Revue de Pharmacologie clinique / Biopharmaceutique. Rockville, Md : Ministère de la Santé et des Services sociaux. Silver Spring, MD: Food and Drug Administration.
Google Scholar
Corona, G., Rastrelli, G., Burri, A., Serra, E., Gianfrilli, D., Mannucci, E., et al. (2016). Abandon des inhibiteurs de la phosphodiestérase de type 5 de première génération: un examen complet et une méta-analyse. Andrologie 4, 1002-1009. doi: 10.1111 / andr.12255
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Delvadia, P. R., Barr, W. H. et Karnes, H. T. (2012). A biorelevant in vitro release/permeation system for oral transmucosal dosage forms. Int. J. Pharm. 430, 104–113. doi: 10.1016/j.ijpharm.2012.03.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Eardley, I., Donatucci, C., Corbin, J., El-Meliegy, A., Hatzimouratidis, K., McVary, K., et al. (2010). Pharmacotherapy for erectile dysfunction. J. Sex. Med. 7, 524–540. doi: 10.1111/j.1743-6109.2009.01627.x
PubMed Abstract | CrossRef Full Text | Google Scholar
European Pharmacopoeia (2016). Direction Européenne de la Qualité des Médicaments & Santé (EDQM), 9e Edn. Strasbourg : Conseil de l’Europe.
Google Scholar
Fejős, I., Neumajer, G., Béni, S. et Jankovics, P. (2014). Analyse qualitative et quantitative des inhibiteurs de la PDE-5 dans les médicaments contrefaits et les compléments alimentaires par HPLC-UV en utilisant le sildénafil comme seule référence. J. Pharm. BIOMED. Anal. 98, 327–333. doi: 10.1016/ j.jpba.2014.06.010
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Goel, H., Rai, P., Rana, V. et Tiwary, A. K. (2008). Systèmes de désintégration orale: innovations dans la formulation et la technologie. Pat récent. Livraison de drogue. Formule. 2, 258–274. doi: 10.2174/187221108786241660
CrossRef Texte intégral / Google Scholar
Gupta, M., Kovar, A. et Meibohm, B. (2005). La pharmacocinétique clinique des inhibiteurs de la phosphodiestérase-5 pour la dysfonction érectile. J. Clin. Pharmacol. 45, 987–1003. doi: 10.1177/0091270005276847
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Hatzimouratidis, K., Amar, E., Eardley, I., Giuliano, F., Hatzichristou, D., Montorsi, F., et al. (2010). Association Européenne d’Urologie. Directives sur la dysfonction sexuelle masculine: dysfonction érectile et éjaculation précoce. EUR. Urol. 57, 804–814. doi: 10.1016/j. eururo.2010.02.020
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Hawksworth, D. J., et Burnett, A.L. (2015). Prise en charge pharmacothérapeutique de la dysfonction érectile. Clin. Pharmacol. Là. 98, 602–610. doi: 10.1002 / cpt.261
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Heinig, R., Weimann, B., Dietrich, H. et Böttcher, M. F. (2011). Pharmacocinétique d’une nouvelle formulation de comprimés orodispersibles de vardénafil: résultats de trois essais cliniques. Clin. Médicament Investig. 31, 27–41. doi: 10.2165/11584950-000000000-00000
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Il s’agit de la première édition de la série. An introduction to fast dissolving oral thin film drug delivery systems: a review. Curr. Livraison de drogue. 10, 667–684. doi: 10.2174/156720181006131125150249
Résumé PubMed / Texte intégral Croisé / Google Scholar
Les résultats de cette étude ont été publiés en 2014. Administration orale de médicaments transmucosaux à usage pédiatrique. Adv. Livraison de médicaments. Rév. 73, 50-62. doi: 10.1016/j.addr.2013.08.011
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Leoni, L. A., Leite, G. S., Wichi, R. B. et Rodrigues, B. (2013). Sildénafil: deux décennies d’avantages ou de risques? Mâle vieillissant 16, 85-91. doi: 10.3109 / 13685538.2013.801952
Résumé PubMed / Texte intégral Croisé / Google Scholar
Lotti, F., Corona, G., Castellini, G., Maseroli, E., Fino, M. G., Cozzolino, M., et al. (2016). La dégradation de la qualité du sperme est associée à un dysfonctionnement sexuel en fonction de sa gravité. Hum. Reprod. 31, 2668–2680. doi: 10.1093/humrep/dew246
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Ludwig, W., et Phillips, M. (2014). Causes organiques de la dysfonction érectile chez les hommes de moins de 40 ans. Urol. Int. 92, 1–6. doi: 10.1159/000354931
Résumé PubMed / Texte intégral Croisé / Google Scholar
Lugnier, C. (2006). Superfamille des nucléotides phosphodiestérases cycliques (PDE) : une nouvelle cible pour le développement d’agents thérapeutiques spécifiques. Pharmacol. Là. 109, 366–398. doi: 10.1016/ j. pharmthera.2005.07.003
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Il s’agit de l’un des principaux facteurs de risque de la maladie. Le rôle de la pharmacocinétique et de la pharmacodynamique dans le traitement par inhibiteur de la phosphodiestérase-5. Int. J. Impot. Rés. 19, 253-264. doi: 10.1038/sj.ijir.3901522
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Munoz, M., Bancroft, J. et Marshall, I. (1993). La performance du Rigiscan dans la mesure de la tumescence et de la rigidité du pénis. Int. J. Impot. Rés. 5, 69 à 76.
Google Scholar
Il s’agit de l’un des principaux facteurs de risque de la maladie de Parkinson. (2013). Le Comité des Normes de l’ISSM pour la Médecine sexuelle. SOP traitement conservateur (médical et mécanique) de la dysfonction érectile. J. Le sexe. Med. 10, 130–171. doi: 10.1111/jsm.12023
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Sun, D., Wei, X., Xue, X., Fang, Z., Ren, M., Lou, H., et al. (2014). Absorption orale améliorée et effet thérapeutique de l’acétylpuérarine à base de nanoémulsions de succinate de D-α-tocophéryl polyéthylène glycol 1000. Int. J. Nanomédecine 9, 3413-3423. doi: 10.2147/IJN.S63777
Résumé PubMed / Texte intégral Croisé / Google Scholar
Taylor, J., Baldo, O. B., Storey, A., Cartledge, J. et Eardley, I. (2009). Différences dans la durée des effets secondaires et les niveaux de gêne associés entre les inhibiteurs de la phosphodiestérase de type 5. BJU Int. 103, 1392–1395. doi: 10.1111/j.1464-410X.2008.08328.x
Résumé PubMed / Texte intégral Croisé / Google Scholar
Zayed, R., Kamel, A. O., Shukr, M., et El-Shamy, A. H. (2012). Une étude comparative in vitro et in vivo de dispersions solides directement compressées et de comprimés sublinguaux de citrate de sildénafil lyophilisé pour la prise en charge de l’hypertension artérielle pulmonaire. Acta Pharm. 62, 411–432. doi: 10.2478/v10007-012-0027-9
PubMed Abstract | CrossRef Full Text | Google Scholar