L’ajout d’une fraction glucidique à une molécule de protéine est appelé glycosylation des protéines. C’est une modification post-traductionnelle courante pour les molécules protéiques impliquées dans la formation de la membrane cellulaire. Au cours de ce processus, la liaison des unités monosaccharidiques aux chaînes d’acides aminés met en place une série de réactions enzymatiques qui conduisent à la formation de glycoprotéines (oligosaccharides liés à n et o qui se retrouvent à une entité protéique). En tout, 16 enzymes connues sont censées médier cette réaction. Une glycoprotéine typique a au moins 41 liaisons qui impliquent 8 acides aminés et 13 unités monosaccharidiques différentes et comprend les liaisons glycophosphatidylinositol (GPI) et phosphoglycosyle. La glycosylation des protéines contribue au repliement correct des protéines, à la stabilité et à l’adhésion de cellule à cellule dont les cellules du système immunitaire ont généralement besoin. Les principaux sites de glycosylation des protéines dans le corps sont ER, le corps de Golgi, le noyau et le liquide cellulaire.
La glycosylation des protéines peut être classée en deux types principaux:
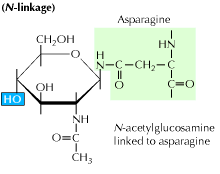 a) glycosylation N-liée: Elle commence par l’addition d’un précurseur de 14 sucres à un acide aminé asparagine. Il contient des molécules de glucose, de mannose et de n-acétylglucosamine. Cette entité est ensuite transférée dans la lumière ER. L’enzyme oligosaccharil transférase attache la chaîne oligosaccharidique à l’asparagine qui se produit dans la séquence tripeptidique, Asn-X-Ser ou Asn-X-Thr. X peut être n’importe quel acide aminé autre que la proline. La séquence protéique attachée à l’oligosaccharide se plie maintenant correctement et est maintenant transférée dans le corps de Golgi où le résidu de mannose est éliminé.
a) glycosylation N-liée: Elle commence par l’addition d’un précurseur de 14 sucres à un acide aminé asparagine. Il contient des molécules de glucose, de mannose et de n-acétylglucosamine. Cette entité est ensuite transférée dans la lumière ER. L’enzyme oligosaccharil transférase attache la chaîne oligosaccharidique à l’asparagine qui se produit dans la séquence tripeptidique, Asn-X-Ser ou Asn-X-Thr. X peut être n’importe quel acide aminé autre que la proline. La séquence protéique attachée à l’oligosaccharide se plie maintenant correctement et est maintenant transférée dans le corps de Golgi où le résidu de mannose est éliminé.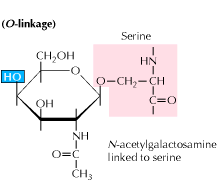
b) glycosylation liée à l’O: La glycosylation commence par une addition enzymatique de N-acétyl-galactosamine suivie d’autres glucides aux résidus de sérine ou de thréonine. Des études révèlent que la glycosylation liée à l’O se produit à un stade ultérieur du traitement des protéines.