Les kystes pancréatiques représentent une entité petite mais de plus en plus détectée d’anomalies pancréatiques. Environ 70% des lésions kystiques pancréatiques sont découvertes incidemment. Les kystes pancréatiques néoplasiques les plus fréquemment rencontrés comprennent le néoplasme mucineux papillaire intracanalaire (IPMN), le cystadénome séreux (SCA), le néoplasme kystique mucineux avec stroma ovarien (MCN) et le néoplasme épithélial pseudopapillaire solide. L’IPMN est en outre subdivisé en conduit de dérivation (BD), conduit principal et formes combinées. Ensemble, ceux-ci constituent 90% des tumeurs pancréatiques prémalignées, principalement kystiques. En revanche, le pseudocyste, le vrai kyste épithélial, le kyste lymphoépithélial et le kyste mucineux non néoplasique n’ont aucun potentiel malin.
La malignité se produit uniquement dans les kystes mucineux. Le SCA est considéré comme une lésion non maligne, et les tumeurs séreuses malignes rapportées dans la littérature ne répondent pas aux critères de l’OMS pour le SCN. L’IPMN peut évoluer de niveaux inférieurs à supérieurs de dysplasie et, en fin de compte, d’adénocarcinome canalaire pancréatique (PDAC). Les IPMN impliquant le canal principal ont un taux de malignité plus élevé que ceux des branches, le risque de malignité étant estimé à 62%; le risque de malignité des MCN est inférieur à 15%. D’autres lésions kystiques plus rares, telles que le néoplasme épithélial pseudopapillaire solide et la tumeur neuroendocrine pancréatique kystique (cPNET), ont tendance à présenter des caractéristiques suggérant un diagnostic spécifique, conduisant généralement à une ablation chirurgicale.
Pour étudier la fréquence des kystes pancréatiques accidentels chez des individus asymptomatiques, Kromrey a effectué un examen de cholangiopancréatographie par résonance magnétique (MRCP) chez 1077 participants inscrits à une étude de cohorte basée sur la population. Du groupe initial, 676 personnes ont subi un nouvel examen 5 ans plus tard. Au moment de l’examen initial, 49% présentaient au moins un kyste ≥2 mm de diamètre. L’incidence de nouveaux kystes au cours de la période de suivi était de 2,6% par an. La présence de kystes était fortement liée à l’âge; à 75 ans, 75% des participants avaient un ou plusieurs kystes. La discrimination entre kystes pancréatiques bénins et prémalignés ou malins est d’une grande importance afin d’éviter des procédures inutiles, telles que des examens de suivi radiologique ou une résection chirurgicale.
Néoplasme kystique mucineux avec stroma ovarien (MCN)
Les MCN sont fréquents chez les femmes d’âge moyen, sont généralement bien définis et se trouvent principalement dans la queue du pancréas (> 90%). Par rapport aux tumeurs kystiques séreuses, les NCM sont plus grandes (> 20 mm de diamètre) et moins nombreuses (généralement < 6). Le comportement biologique des MCN est variable et différents modèles histologiques coexistent fréquemment dans la même tumeur. Les tumeurs peuvent être entièrement bénignes, tout comme les cystadénomes mucineux ou les adénomes mucineux papillaires intracanaux. Certaines tumeurs sont borderline, montrant une dysplasie cellulaire, tandis que d’autres sont franchement malignes. Les cystadénocarcinomes malins et les carcinomes mucineux intramédullaires peuvent être subdivisés en types non invasifs et invasifs.
(Les caractéristiques radiologiques des MCN sont démontrées dans les images ci-dessous.)
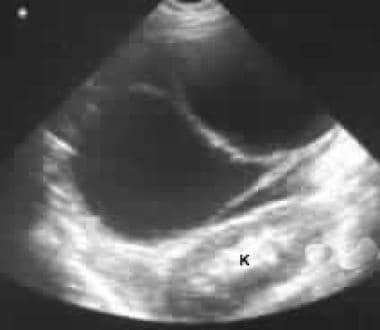 L’échographie à travers l’hypochondre gauche montre une grande masse cloisonnée antérieure au rein (K).
L’échographie à travers l’hypochondre gauche montre une grande masse cloisonnée antérieure au rein (K). 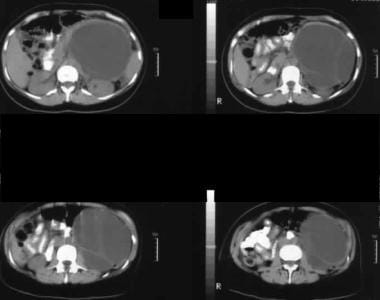 . L’image 1 montre une grande masse cloisonnée dans l’hypochondre gauche. Notez le contour externe lisse typique d’un néoplasme kystique mucineux.
. L’image 1 montre une grande masse cloisonnée dans l’hypochondre gauche. Notez le contour externe lisse typique d’un néoplasme kystique mucineux. Néoplasme mucineux papillaire intracanalaire (IPMN)
Sur la base de l’atteinte du canal pancréatique, les IPMN sont classés comme IPMN du canal principal, IPMN de branche latérale ou IPMN variante mixte impliquant à la fois le canal pancréatique principal et les branches latérales. Les IPMN du canal principal ont souvent un épithélium de type intestinal, et les IPMN des branches latérales ont généralement un épithélium de type gastrique. Bien que toutes les variantes morphologiques de l’IPMN puissent évoluer vers le cancer, l’adénocarcinome invasif provenant d’IPMN de type gastrique est associé à un taux de survie significativement plus faible que celui provenant d’autres types d’IPMN. Cependant, les caractéristiques d’imagerie ne sont pas spécifiques pour différencier les différentes variantes histologiques des IPMN.
Les IPMN à branches latérales sont généralement détectés chez les hommes plus âgés et sont plus fréquemment localisés dans le pancréas proximal (processus de tête et d’uncinate). Une caractéristique de différenciation importante entre MCN et IPMN est la visualisation de la communication canalaire pancréatique. Si un canal de communication clair avec le canal pancréatique est visualisé, le diagnostic d’IPMN à branche latérale est presque certain car les SCAs et les MCN ne communiquent pas avec le système canalaire pancréatique.
Malgré la faible incidence d’agressivité des lésions kystiques mucineuses de 3 cm et moins, l’incidence n’est pas assez faible pour rejeter complètement les lésions, et un examen attentif des caractéristiques d’imagerie est requis. De plus, les patients dont l’état ne convient pas à la prise en charge chirurgicale ont souvent besoin d’évaluations fréquentes de la croissance et du changement des caractéristiques d’imagerie.
(les IPMN sont visibles dans les images ci-dessous.)
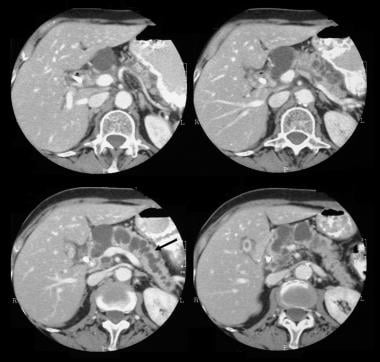 Tumeur mucineuse papillaire intracanale pancréatique (IPMT). Une tomodensitométrie axiale améliorée par contraste dans le pancréas montre une tumeur kystique de 5,5 cm dans la tête pancréatique. Notez la dilatation grossière en amont du canal pancréatique. Le canal pancréatique accessoire est également dilaté.
Tumeur mucineuse papillaire intracanale pancréatique (IPMT). Une tomodensitométrie axiale améliorée par contraste dans le pancréas montre une tumeur kystique de 5,5 cm dans la tête pancréatique. Notez la dilatation grossière en amont du canal pancréatique. Le canal pancréatique accessoire est également dilaté. 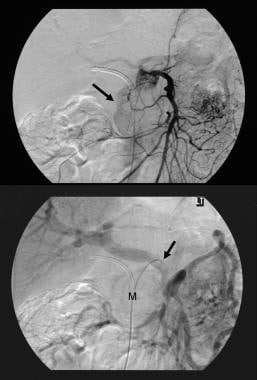 Tumeur mucineuse papillaire intracanale pancréatique (IPMT). (En haut) L’angiographie mésentérique supérieure montre une vascularisation capillaire de la masse dans la tête pancréatique pendant la phase artérielle. (En bas) L’image de la phase veineuse portale montre le déplacement des branches veineuses portales et l’enrobage de la jonction de la veine mésentérique supérieure et de la veine porte. M désigne la masse pancréatique.
Tumeur mucineuse papillaire intracanale pancréatique (IPMT). (En haut) L’angiographie mésentérique supérieure montre une vascularisation capillaire de la masse dans la tête pancréatique pendant la phase artérielle. (En bas) L’image de la phase veineuse portale montre le déplacement des branches veineuses portales et l’enrobage de la jonction de la veine mésentérique supérieure et de la veine porte. M désigne la masse pancréatique. 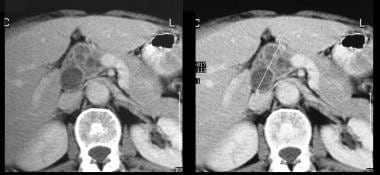 Tumeur mucineuse papillaire intracanale pancréatique (IPMT). Les tomodensitogrammes axiaux à contraste amélioré dans le pancréas montrent une tumeur multiseptate dans la tête du pancréas.
Tumeur mucineuse papillaire intracanale pancréatique (IPMT). Les tomodensitogrammes axiaux à contraste amélioré dans le pancréas montrent une tumeur multiseptate dans la tête du pancréas. 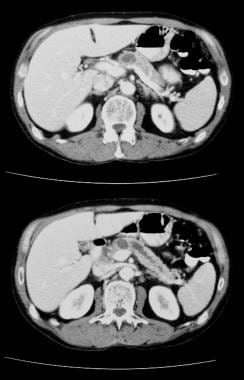 Tumeur mucineuse papillaire intracanale pancréatique (IPMT). Les tomodensitogrammes à contraste amélioré dans le pancréas montrent une dilatation grossière du canal pancréatique. Lors de la chirurgie, l’IPMT a été confirmée.
Tumeur mucineuse papillaire intracanale pancréatique (IPMT). Les tomodensitogrammes à contraste amélioré dans le pancréas montrent une dilatation grossière du canal pancréatique. Lors de la chirurgie, l’IPMT a été confirmée. Cystadénomes séreux
Les cystadénomes séreux (adénomes microcystiques) (voir les images ci-dessous) sont les deuxièmes tumeurs kystiques les plus courantes du pancréas. La présentation clinique des cystadénomes séreux est similaire à celle des tumeurs pancréatiques kystiques mucineuses.
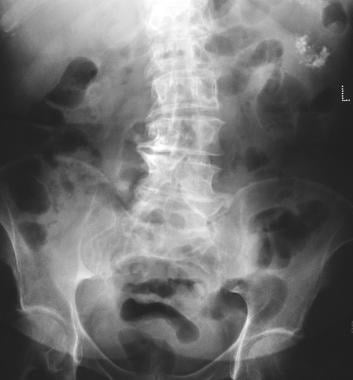 Adénome microcystique pancréatique. La radiographie simple montre une calcification tumorale dans un adénome microcystique (quadrant supérieur gauche). La calcification dans l’adénome microcystique se présente sous la forme d’un amas central disposé en rayon de soleil ou en étoile. La calcification centrale est mieux évaluée avec la tomodensitométrie qu’avec la radiographie.
Adénome microcystique pancréatique. La radiographie simple montre une calcification tumorale dans un adénome microcystique (quadrant supérieur gauche). La calcification dans l’adénome microcystique se présente sous la forme d’un amas central disposé en rayon de soleil ou en étoile. La calcification centrale est mieux évaluée avec la tomodensitométrie qu’avec la radiographie. 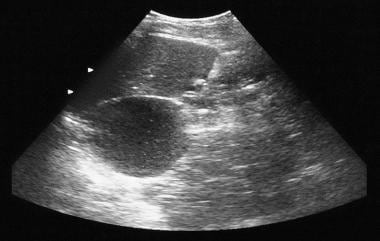 . L’échographie montre une masse kystique dans la région de la queue du pancréas.
. L’échographie montre une masse kystique dans la région de la queue du pancréas. 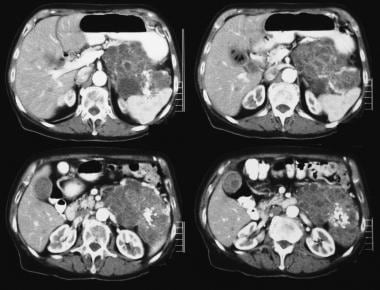 . La tomodensitométrie axiale à contraste amélioré montre une tumeur hypervasculaire dans la queue pancréatique avec calcification par rayons de soleil. Notez l’amélioration du fromage suisse.
. La tomodensitométrie axiale à contraste amélioré montre une tumeur hypervasculaire dans la queue pancréatique avec calcification par rayons de soleil. Notez l’amélioration du fromage suisse. En raison de l’utilisation croissante de l’imagerie en coupe transversale, beaucoup de ces tumeurs sont détectées comme une découverte accidentelle et asymptomatique.
Sur les images en coupe transversale, les cystadénomes séreux apparaissent sous la forme de nombreux kystes minuscules séparés par de délicats septa fibreux, qui leur donnent un aspect en nid d’abeille. Les kystes sont remplis de liquide clair et aqueux et sont souvent disposés autour d’une cicatrice stellaire centrale, qui peut être calcifiée. Lors de la tomodensitométrie, la calcification centrale du rayon de soleil dans une masse spongieuse est pathognomonique de cette tumeur, mais cette découverte ne survient que chez 10% des patients.
L’échographie endoscopique (EUS) permet une meilleure résolution de la structure en nid d’abeille que la tomodensitométrie. Parfois, les kystes peuvent être gros, une caractéristique qui rend difficile la différenciation de ces kystes des MCN.
Une hypervascularité peut être démontrée sur les angiogrammes, et certaines tumeurs se produisent avec une hémorragie intra-abdominale.
Diagnostics différentiels
Collectes de pseudocystes pancréatiques ou de liquides pancréatiques
Les collectes de liquides surviennent dans jusqu’à 50% des cas de pancréatite aiguë. Les pseudocystes sont généralement considérés comme des espaces fluides anéchoïques sur les échographies, mais ils peuvent présenter des échos internes s’ils contiennent du tissu nécrotique ou un caillot.
Les résultats d’imagerie qui suggèrent un diagnostic de pseudocyste plutôt que de néoplasme kystique comprennent les éléments suivants: absence de septae, de loculations, de composants solides ou de calcifications de la paroi du kyste lors de la tomodensitométrie (TDM); hypovascularisation sur les angiogrammes; et communication entre le kyste et les canaux pancréatiques lors de la cholangiopancréatographie rétrograde endoscopique (PCRE). La plupart des pseudocystes sont extrapancréatiques, tandis que les néoplasmes kystiques pancréatiques sont intrapancréatiques.
Abcès pancréatique
L’abcès pancréatique est généralement secondaire à l’infection d’un pseudocyste, mais dans de rares cas, il peut résulter d’une propagation directe d’une infection rénale ou colique. En règle générale, un abcès pancréatique survient 2 à 4 semaines après un épisode de pancréatite aiguë.
Sur les images, ces abcès peuvent ressembler à des pseudocystes. Généralement, l’apparence dépend de leur âge. Dans la phase aiguë, les changements peuvent être subtils, avec seulement une perte du contour pancréatique normal associée à une oblitération du contour pancréatique et des espaces vasculaires péripancréatiques et autres tissus mous. Ces changements peuvent être indiscernables de ceux trouvés dans la pancréatite aiguë sévère. Aux stades subaiguë et chronique, en cas de nécrose centrale, une masse kystique anéchoïque ou complexe est généralement observée. Un niveau de débris peut être observé dans la partie dépendante de l’abcès. Dans la phase subaiguë ou chronique, la transmission est généralement bonne, sauf lorsque du gaz est présent dans l’abcès. En présence de gaz, l’abcès peut devenir échogène et peut faire de l’ombre.
Les parois des abcès pancréatiques subaiguës et chroniques ont des caractéristiques variables. Les parois peuvent être épaisses, irrégulières et bien définies, ou l’abcès peut n’avoir aucune paroi définissable. Les résultats échographiques ne sont pas spécifiques, mais dans le cadre clinique approprié, un diagnostic d’abcès peut être suggéré et confirmé au moyen d’une aspiration percutanée ou d’un SCANNER.
Kystes parasitaires
Des kystes de granulose d’échinocoque et des kystes multiloculaires du pancréas ont été décrits, bien que l’atteinte pancréatique soit exceptionnellement rare. E. les kystes de granulose peuvent être kystiques uniloculaires, multiloculaires ou complexes.
Sur la seule imagerie, la différenciation de ces masses kystiques et d’autres masses kystiques est difficile. Les tests sérologiques peuvent être utiles dans le cadre clinique approprié. Les kystes d’E. multilocularis présentent un schéma infiltrant échogène. Ce diagnostic devrait être entretenu dans les régions endémiques lorsqu’un tel schéma est observé.
Tumeurs pancréatiques épithéliales solides et papillaires
Les tumeurs épithéliales solides et papillaires du pancréas peuvent être solides ou kystiques. Ce sont des tumeurs rares qui sont souvent confondues avec des tumeurs sécrétant de la mucine ou des adénomes non fonctionnels.
Les tumeurs pancréatiques épithéliales solides et papillaires sont le plus souvent situées dans la queue pancréatique. Ce sont de grandes masses bien encapsulées avec des zones d’hémorragie et de nécrose. Sur les échographies, ils apparaissent comme des masses hétérogènes, rondes et solides avec un centre nécrotique kystique et une calcification dystrophique, qui peuvent faire de l’ombre.
Kystes dysontogènes
Les kystes dysontogènes sont des kystes hamartomateux souvent associés à des kystes rénaux, des angiomes cérébelleux et des encéphalocèles. L’imagerie révèle un gros kyste à paroi mince avec une configuration de mûrier.
Pseudoanévrysmes
Les pseudoanévrysmes ne sont généralement pas vraiment intrapancréatiques et peuvent être confondus avec un kyste pancréatique. Ces anévrismes sont une complication de la pancréatite chez 3,5 à 10% des patients. L’échographie Doppler peut montrer un écoulement artériel turbulent dans un pseudoanévrisme, tandis que l’échographie Doppler à flux coloré montre un écoulement bidirectionnel et un tourbillonnement dans la masse anéchoïque. L’imagerie Doppler peut permettre une identification provisoire de l’artère alimentant le pseudoanévrisme.
neurofibrome rétropéritonéal ou schwannome
Ces tumeurs peuvent être des lésions hyperéchogènes ou hypoéchogènes / kystiques avec des échos internes sporadiques. C’est une caractéristique commune dans les tumeurs plus grandes dans lesquelles une dégénérescence kystique et une hémorragie se sont produites. Les tumeurs sont rétropéritonéales mais peuvent imiter des masses pancréatiques.
Sarcome pancréatique
Le sarcome pancréatique est une tumeur rare des structures de support mésenchymateuses du pancréas. C’est une masse relativement sonolucente et peut être confondue avec une collection de fluides ou un pseudocyste. Les résultats échographiques peuvent être normaux, ou les échographies peuvent démontrer une masse rétropéritonéale, qui est relativement sonolucente par rapport aux tissus environnants. Par conséquent, cette lésion peut être confondue avec une masse pancréatique kystique.
Lymphome pancréatique
Le lymphome pancréatique primaire est rare. La présentation clinique n’est pas différente de celle du carcinome pancréatique. L’échographie peut révéler une masse homogène, sonolucente ou complexe. Ces masses sont généralement pauvres en écho et peuvent imiter des lésions kystiques. Comme le pronostic d’un lymphome pancréatique est favorable, sa différenciation d’un carcinome est cruciale. La corrélation des résultats échographiques, tomodensitométriques et angiographiques peut aboutir à un diagnostic correct. Cependant, en cas de doute, une biopsie guidée par échographie peut révéler la véritable nature de la masse.
Carcinome à cellules acineuses pancréatiques
Les carcinomes à cellules pancréatiques (PACC) constituent environ 1% des tumeurs pancréatiques exocrines. PACC est un néoplasme épithélial avec des preuves de différenciation acinaire. Les patients atteints de carcinome à cellules acineuses ont un meilleur pronostic que les patients atteints d’adénocarcinomes de type canalaire, mais un pronostic pire que les patients atteints de tumeurs endocriniennes pancréatiques. Sur CT, PACC a été décrit de diverses manières, y compris comme une masse dense mal définie; comme une masse bien définie avec nécrose centrale; et comme une masse kystique entourée d’une épaisse paroi hypervasculaire.
Examen préféré
L’IRM est la technique préférée pour le diagnostic des tumeurs pancréatiques kystiques. Les IRM sont généralement utiles pour différencier les pseudocystes des néoplasmes kystiques. La cholangiopancréatographie par résonance magnétique (MRCP) peut dépeindre l’anatomie des canaux biliaires et pancréatiques de manière non invasive et aide au diagnostic des tumeurs intracanalaires.
L’échographie est généralement la première technique chez un patient présentant des symptômes épigastriques. C’est une excellente modalité pour le diagnostic des masses pancréatiques kystiques. L’échographie offre également la possibilité d’une intervention guidée, telle que l’aspiration et la biopsie. L’échographie Doppler apporte un avantage supplémentaire dans l’évaluation des tumeurs hypervasculaires et de la thrombose / occlusion vasculaire associée aux tumeurs pancréatiques. L’échographie Doppler à puissance améliorée par écho présente une sensibilité et une spécificité élevées dans le diagnostic différentiel des tumeurs pancréatiques.
Dans les cas équivoques ou dans les cas où la malignité est fortement suspectée, l’EUS-FNA donne le meilleur rendement diagnostique, car il permet l’acquisition d’échantillons cytologiques et de liquide kystique pour l’analyse de divers marqueurs tumoraux.
Parfois, malgré l’évaluation complète d’une masse kystique, le type de kyste peut rester indéterminé. Bien que coûteuse et invasive, l’échographie laparoscopique, la biopsie de la paroi du kyste et l’analyse de l’aspiration kystique contribuent de manière significative au diagnostic différentiel des lésions kystiques pancréatiques.
CT montre une calcification tumorale et constitue une excellente modalité pour la détection des métastases locales et à distance. Bien que la tomodensitométrie et l’IRM ne puissent pas être utilisées pour différencier la teneur en mucine du suc pancréatique, la communication entre la lésion kystique et la MPD dilatée et une papille bombée avec un orifice patuleux sont des caractéristiques de l’IPMT. L’architecture interne des tumeurs mucineuses est affichée au moins aussi bien sur les IRM que sur les tomodensitogrammes, à l’exception de la calcification au sein de la lésion (que l’IRM n’a qu’une capacité limitée à révéler).
La tomodensitométrie en spirale et/ou multisection sont d’excellentes techniques d’imagerie du pancréas, offrant une résolution spatiale et des détails anatomiques superbes. Avec une collimation fine et des phases artérielles et veineuses et des reconstructions multiplanaires et / ou tridimensionnelles (3D), un excellent détail de l’anatomie vasculaire est représenté; la plupart des centres utilisent désormais rarement l’angiographie pour évaluer les tumeurs pancréatiques.
Des radiographies simples sont souvent obtenues pour rechercher une calcification pancréatique. Des études sur le baryum du GI supérieur peuvent être réalisées dans le contexte de douleurs épigastriques. Avec les tumeurs pancréatiques, les études sur le baryum peuvent dépeindre un déplacement extrinsèque de l’estomac et du duodénum.
Limites des techniques
L’IRM n’est pas universellement disponible, est coûteuse et pose un problème pour les patients atteints de claustrophobie. Les lignes directrices de l’ACG recommandent la prudence lors de l’utilisation de l’imagerie pour diagnostiquer le type de kyste ou la malignité concomitante; la précision de l’IRM ou du MRCP pour diagnostiquer le type de kyste est de 40 à 50% et de 55 à 76% pour déterminer les tumeurs bénignes par rapport aux tumeurs malignes.
Le gaz viscéral, l’habitus du patient et la dépendance de l’opérateur limitent la valeur de l’échographie. L’échographie laparoscopique est invasive. L’imagerie EUS ne permet pas de distinguer de manière fiable les IPMN bénins des IPMN malins, et il n’est pas clair si les caractéristiques d’imagerie des lésions mucineuses à potentiel malin accru sont suffisamment prédictives pour influencer la prise en charge clinique. Lorsque l’histologie chirurgicale est utilisée comme étalon de référence, la précision diagnostique de l’imagerie EUS varie de 40 à 96%. Une seule étude prospective a démontré que la sensibilité (56%) et la spécificité (45%) de la seule morphologie de l’EUS pour différencier les kystes mucineux (néoplasmes kystiques mucineux et IPMN) des kystes non mucineux étaient faibles, ce qui entraînait une mauvaise précision globale (51%).
Les radiographies simples et les études sur le baryum du GI supérieur ne sont pas spécifiques et des résultats similaires peuvent être observés dans diverses pathologies. La tomodensitométrie supporte une charge de rayonnement ionisant importante et utilise un produit de contraste iodé avec un risque d’anaphylaxie et de néphrotoxicité.
Les études transversales, y compris l’échographie, la tomodensitométrie et l’IRM, ne peuvent pas être utilisées pour distinguer le cystadénome mucineux du cystadénocarcinome à moins que la tumeur n’ait métastasé ou envahi les organes voisins. L’angiographie est non spécifique et invasive. Il nécessite également un produit de contraste iodé, avec un risque d’anaphylaxie et de néphrotoxicité.
Imagerie de suivi
Les lignes directrices de l’ACG recommandent d’offrir une surveillance des kystes aux candidats présentant des kystes asymptomatiques présumés être des IPMN ou des MCN. Tous les IPMN réséqués chirurgicalement nécessitent une surveillance postopératoire, mais les MCN réséqués sans cancer du pancréas ne le font pas. Le MRCP est la modalité préférée pour la surveillance; L’EUS peut également être le principal outil de surveillance lorsque les IRM sont contre-indiquées. En l’absence de caractéristiques préoccupantes qui justifient une surveillance accrue ou un renvoi pour une évaluation plus approfondie, la taille du kyste guide les intervalles de surveillance pour les IPMN et les MCN présumés.
Lignes directrices
Des lignes directrices pour le diagnostic et la prise en charge des kystes pancréatiques ont été publiées par les organisations suivantes:
-
Collège américain de Gastroentérologie (ACG)
-
Groupe d’Étude Européen sur les Tumeurs Kystiques du Pancréas
-
Collège américain de Radiologie (ACR)
Les lignes directrices 2018 de l’ACG recommandent l’imagerie par résonance magnétique (IRM) ou la cholangiopancréatographie par résonance magnétique (MRCP) comme modalité de diagnostic préférée en raison de leur caractère non invasif, de leur manque de rayonnement et d’une plus grande précision dans l’évaluation de la communication entre le canal pancréatique principal et le kyste (ce qui est une caractéristique des IPMN à branches latérales). La tomodensitométrie du protocole pancréatique (TDM) ou l’échographie endoscopique (EUS) ont été considérées comme « d’excellentes alternatives » si l’IRM est contre-indiquée. L’aspiration à l’aiguille fine (EUS) et l’analyse du liquide kystique doivent être envisagées dans les kystes dont le diagnostic n’est pas clair et dont les résultats sont susceptibles d’altérer la prise en charge.
L’analyse de l’AEC liquide de kyste peut être envisagée pour différencier les IPMN et les MCN des autres types de kystes, mais elle ne peut pas être utilisée pour identifier les IPMN et les MCN atteints de dysplasie de haut grade ou de cancer du pancréas. Les IPMN ou MCN présentant l’une des caractéristiques suivantes doivent subir une EUS avec ou sans FNA et / ou être référés à un groupe multidisciplinaire pour une évaluation plus approfondie :
-
L’un des symptômes ou signes suivants: jaunisse secondaire au kyste, pancréatite aiguë secondaire au kyste, augmentation significative de l’AC sérique 19-9
-
L’un des résultats d’imagerie suivants: la présence d’un nodule mural ou d’un composant solide soit dans le kyste soit dans le parenchyme pancréatique, une dilatation du canal pancréatique principal > 5 mm, une dilatation focale du canal pancréatique qui concerne le canal principal IPMN ou une lésion obstructive, ou des kystes produisant de la mucine mesurant ≥3 cm de diamètre
-
La présence d’une dysplasie de haut grade ou d’un cancer du pancréas en cytologie
Les directives européennes de 2018 recommandent également l’IRM comme méthode privilégiée pour le diagnostic des néoplasmes kystiques pancréatiques (PCN). L’imagerie multimodale doit être envisagée dans les cas où l’identification de la calcification est importante, pour la stadification tumorale ou pour le diagnostic d’une maladie récurrente postopératoire. Cependant, la précision reste relativement faible pour identifier le type spécifique de PCN, pour différencier les petits PCN des kystes non néoplasiques ou non épithéliaux, ou pour la connexion au système canalaire. La tomodensitométrie doit être envisagée dans les situations cliniques suivantes :
-
Pour la détection de la calcification parenchymateuse, murale ou centrale, et notamment lors de la différenciation des pseudocystes associés à une pancréatite chronique des néoplasmes kystiques pancréatiques
-
En cas de suspicion de malignité ou de cancer concomitant du pancréas et lorsqu’une évaluation de l’atteinte vasculaire, de la maladie péritonéale ou de la maladie métastatique est requise.
-
En cas de suspicion de récidive postopératoire du cancer du pancréas.
Les directives européennes estiment que l’EUS est utile pour identifier le PCN avec des caractéristiques qui devraient être prises en compte pour la résection chirurgicale. Semblable à l’IRM et à la tomodensitométrie, l’EUS a une faible précision pour identifier le type exact de PCN. L’EUS-FNA améliore la précision du diagnostic pour différencier le PCN mucineux du PCN non muqueux, ainsi que le PCN malin du PCN bénin, dans les cas où les résultats de la tomodensitométrie ou de l’IRM ne sont pas clairs. Les recommandations supplémentaires pour l’utilisation d’EUS-FNA sont les suivantes:
-
L’EUS-FNA ne doit être réalisée que lorsque les résultats devraient modifier la prise en charge clinique
-
L’EUS-FNA ne doit pas être réalisée si le diagnostic est déjà établi par imagerie transversale ou s’il existe une indication claire de la chirurgie
-
Les contre-indications relatives à l’EUS-FNA dans le PCN sont une distance > 10 mm entre le kyste et le transducteur, la présence d’un risque élevé de saignement dû à un trouble de la coagulation ou l’utilisation de médicaments antiplaquettaires doubles