Introduction
Une interprétation adéquate des marqueurs de nécrose myocardique est essentielle pour le diagnostic, la stratification et le traitement des patients soupçonnés de syndrome coronarien aigu (SCA). Les protocoles sur les marqueurs cardiaques de l’infarctus aigu du myocarde (IAM) sont renvoyés à la troisième définition universelle de l’IAM.
Ce document établit que l’élévation et l’abaissement de la troponine cardiaque (cTn) sont fondamentaux pour établir le diagnostic dans le contexte de symptômes ischémiques, de modifications électrocardiographiques ou d’altérations segmentaires nouvellement manifestées dans une étude d’imagerie.1
Les progrès technologiques dans la détermination du cTn ont amélioré la capacité de détecter et de quantifier les lésions des cellules myocardiques. Les critères d’élévation des valeurs cTn dépendent de l’essai utilisé et doivent être définis sur la base du profil de précision de chaque essai, y compris celui de l’essai à haute sensibilité.2 L’existence de différents tests immunologiques commerciaux avec des concentrations de percentile 99 (p99) différentes; le fait que certains laboratoires utilisent des références différentes aux résultats des tests d’atteinte myocardique (« normaux », « indéterminés » ou « suggestifs »); et l’utilisation aveugle des tests cTn dans de grandes populations avec des probabilités très différentes de présenter un SCA, tendent à générer de la confusion dans le contexte de la prise en charge clinique.
Il existe un nombre important de patients qui, en l’absence d’IAM, présentent néanmoins des concentrations de cTn > p99. Ces patients ont généralement des facteurs de risque cardiovasculaires et la probabilité de complications chez ces personnes est similaire à celle des patients atteints de SCA.3
Les dernières recommandations européennes sur la prise en charge des patients atteints de syndrome coronarien aigu sans élévation de la ST (NSTE-ACS) préconisent l’utilisation de cTn à haute sensibilité (hs-cTn) par rapport aux troponines conventionnelles ou de quatrième génération (4G), et envisagent jusqu’à deux algorithmes (0h / 3h, 0h / 1h) pour la confirmation (règle in) ou l’exclusion (règle out) de l’AMI.4
Les troponines cardiaques sont extrêmement spécifiques des lésions myocardiques. Cependant, les dommages myocardiques ne sont en aucun cas exclusifs de l’ACS. Par conséquent, les guides cliniques soulignent que la concentration de cTn doit être interprétée en fonction des symptômes du patient. À cet égard, des concentrations élevées de cTn chez les patients atteints de septicémie, de crises hypertensives, d’embolie pulmonaire, etc., sont indicatifs de lésions myocardiques, mais pas d’IAM, et ne doivent pas être utilisés pour indiquer des traitements spécifiques pour le SCA.5
Le terme « haute sensibilité » doit être réservé aux immunoessais capables de déterminer p99 avec un coefficient de variation (CV) de 6
Il existe des doutes dans la communauté scientifique quant à savoir si l’utilisation de hs-cTn représente une amélioration clinique significative, et si elle implique davantage de tests et d’interconsultations.7 La présente étude a été réalisée pour évaluer les performances diagnostiques de la troponine T à haute sensibilité (hs-TnT), déterminer si elle raccourcit le délai de diagnostic et analyser les conséquences cliniques de son utilisation.
Méthode
Une étude prospective observationnelle longitudinale a été réalisée dans les services d’urgence hospitaliers (HES) de l’Hôpital Clínico (Valence), de l’Hôpital Clínico (Málaga), de l’Hôpital Severo Ochoa (Leganés), de l’Hôpital Sant Pau (Barcelone) et de l’Hôpital Miguel Servet (Saragosse) (Espagne), impliquant les patients de l’essai TUSCA (Troponina Ultrasensible en el SCA)8 entre juin 2009 et avril 2010. L’étude a été réalisée conformément aux principes de la Déclaration d’Helsinki et a été approuvée par les comités d’éthique locaux des centres participants. Le consentement éclairé écrit a été obtenu de tous les patients. Nous avons inclus consécutivement des patients de plus de 18 ans observés dans l’EES en raison de douleurs thoraciques évocatrices de NSTE-ACS. L’inscription des patients a été faite lors de la prise en charge initiale en HES, après évaluation des critères d’inclusion et d’exclusion. La prise en charge du patient et le traitement appliqué ont suivi des protocoles internes basés sur les guides consensuels de la Société Européenne de Cardiologie, sous les indications des médecins en charge des patients à tout moment, et en toute indépendance de participation à l’étude. Des déterminations cTn 4G en série ont été effectuées pour le diagnostic de l’ACS, conformément à la pratique clinique et immunologique de routine dans chaque centre.
Les caractéristiques du patient ont été saisies dans un formulaire de rapport de cas et comprenaient des données démographiques, le temps référence à l’apparition des symptômes, la présence de facteurs de risque (hypertension artérielle, diabète sucré, maladie pulmonaire obstructive chronique, insuffisance cardiaque et insuffisance rénale). Nous avons également enregistré les caractéristiques de l’ECG avec et sans douleur, ainsi que les informations renvoyées à la prise en charge après les premiers soins d’urgence (cathétérisme, angioplasties, pontage, etc.), le diagnostic final et la destination du patient.
Les patients présentant un SCA d’élévation du segment ST ont été exclus, de même que ceux présentant un bloc de faisceau gauche nouvellement manifesté, une défibrillation ou une cardioversion avant les premières déterminations en laboratoire, une chirurgie cardiaque dans les trois semaines précédant l’admission, les femmes enceintes, les patients présentant une déficience cognitive sévère et les sujets souffrant d’insuffisance rénale chronique soumis à une hémodialyse.
Au cours des 12 premières heures de séjour en HES, Unité de Soins Intensifs (USI) ou service hospitalier, des échantillons sanguins en série ont été obtenus pour la mesure du hs-TnT, sur la base du protocole suivant:
- –
Échantillon T0. Au moment de la première assistance dans la HES.
- –
Échantillon T1. Deux heures après le point de temps d’échantillonnage 0 ou immédiatement avant l’admission dans une unité hospitalière (USI ou service).
- –
Échantillon T2. Entre 4 et 6h après le point de temps d’échantillonnage 0 ou immédiatement avant l’admission dans une unité hospitalière.
- –
Échantillon T3. Entre 8 et 12h après le point de temps de prélèvement 0 si le patient était encore en service, ou immédiatement avant son admission dans une unité hospitalière, ou au moment de la sortie du patient de l’HES.
Une quantité suffisante de sang a été prélevée pour obtenir 5 aliquotes de 0,5 ml de plasma hépariné à partir de chacun des échantillons du patient, en plus de l’échantillon requis pour les tests de routine. Les aliquotes ont été congelées à -80°C, et ont été identifiées avec le code de chaque centre : trois chiffres correspondant au numéro de patient et au point temporel de prélèvement (T0, T1, T2 ou T3), selon l’échantillon concerné. Une moyenne de 3,7 échantillons par patient a été obtenue. Tous les échantillons ont été transférés au laboratoire central (Hôpital Sant Pau, Barcelone) pour l’analyse du cTn 4G et du hs-TnT, avec un délai maximum d’un mois pour chaque collecte. Les hôpitaux ont tous effectué le test de routine 4G cTn utilisé à l’époque (2 centres avec cTnT et 3 avec cTnI). Le diagnostic final du patient a été établi par un expert, sur la base de toutes les informations cliniques fournies par le formulaire de rapport de cas rempli par le chercheur principal dans chaque centre, reflétant les données cliniques et ECG, et la détermination centralisée du cTn 4G effectuée dans le laboratoire principal. L’expert a été aveuglé par les conclusions du HS-cTn.
Un infarctus a été diagnostiqué en présence d’une élévation ou d’une réduction de la concentration de cTnT de > 20% (critère Δ) parmi plusieurs échantillons, avec au moins une valeur supérieure à p99 pour la population de référence (≥ 0,01µg/l). Le diagnostic d’angor instable (UA) a été établi chez des patients présentant des preuves cliniques d’ischémie myocardique sans cTn 4G positif. Les patients atteints d’UA ont présenté des antécédents d’angine de repos, d’aggravation d’angine chronique antérieure, de modifications du segment ST suggérant une ischémie sans variations de biomarqueurs (cinétiques), de tests de détection d’ischémie positifs ou de sténose > 70% d’une artère coronaire, comme en témoigne l’angiographie coronarienne. Les niveaux de cTnT à leur tour ont été mesurés à l’aide d’une technique de haute sensibilité sur un analyseur Cobas e601 (hs-TnT, Roche Diagnostics, Bâle, Suisse). La technique a une limite de détection de 5,0 ng / l, et la référence p99, utilisée comme limite de décision clinique, était de 13,0 ng / l. L’imprécision analytique de ces tests cTn a été évaluée en 20 répétitions de 8 groupes d’échantillons avec des concentrations finales ajustées pour couvrir la plage comprise entre 7 et 928 ng / l, en diluant un échantillon à forte concentration de CTN avec un pool sérique présentant des niveaux indétectables de hs-TnT (
ng / l). Le p99 du test cTnT (10ng/l = 0,01µg/l) a été mesuré avec un coefficient de variation (CV) de 15,2%. La valeur avec CV 10% était de 35ng/l = 0,035µg/l. Le p99 du test hs-TnT (13ng/l) a été mesuré avec un CV de 6,9%.
Les fréquences et les pourcentages ont été calculés pour l’analyse descriptive des variables qualitatives, avec des mesures de tendance centrales dans le cas des variables quantitatives. Les données ont été exprimées comme la moyenne et l’écart type (SD) en présence d’une distribution normale, et comme l’intervalle médian et interquartile (IQR) dans le cas d’une distribution non normale, comme en témoigne le test de Kolmogorov-Smirnov.
La comparaison des variables quantitatives était basée sur le test T de Student ou le test U de Mann-Whitney en présence ou en l’absence d’une distribution de données normale, respectivement. La comparaison des variables qualitatives à son tour était basée sur le test du chi carré ou le test exact de Fisher, selon le cas.
Dans tous les cas, le niveau de signification statistique a été défini comme étant de 5% (α = 0,05%) dans le test à deux queues.
L’étude de discrimination cTn 4G et hs-TnT a été réalisée en calculant l’aire (ASC) sous la courbe de caractéristique de fonctionnement du récepteur (ROC) aux différents points de temps d’échantillonnage, avec l’intervalle de confiance (IC) correspondant à 95%. La signification de ces courbes a été évaluée à partir du calcul de l’IC de l’ASC, définissant comme significatives les valeurs dans la zone avec une limite inférieure supérieure à 0,5%. La comparaison des aires sous la courbe ROC a été faite en étudiant le chevauchement des valeurs d’IC.
Les performances diagnostiques ont été évaluées en calculant la sensibilité, la spécificité et les valeurs prédictives positives et négatives. L’intervalle de confiance de 95% a été calculé pour l’évaluation clinique de l’ampleur de ces mesures – l’intervalle étant considéré comme significatif en l’absence de chevauchement des valeurs.
Résultats
L’étude comprenait un total de 351 patients; 234 étaient des hommes (67,9%) et l’âge moyen était de 65,7 ans. Les principales données démographiques et les facteurs de risque cardiovasculaire sont résumés dans le tableau 1. Un diagnostic final d’AMI a été établi chez 77 patients, avec UA chez 102 patients. Un total de 172 patients ont été diagnostiqués comme n’ayant pas de SCA.
Caractéristiques et facteurs de risque cardiovasculaire de l’échantillon de l’étude.
| Variables | Total | Pas de SCA | Angor instable | AMI | p |
|---|---|---|---|---|---|
| Non. patients n (%) | 351 | 172 (49) | 102 (29.1) | 77 (21.9) | – |
| Âge (médian) | 66 (27-93) | 64.4 (27-93) | 71 (31-90) | 73 (36-88) | |
| Hommes, % | 67.9 | 61.5 | 73.5 | 74 | |
| Antécédents de maladie n (%) | |||||
| AHT | 220 (62) | 101 (58.7) | 73 (71.6) | 46 (59.6) | NS |
| Diabète | 92 (26.2) | 38 (22.1) | 35 (34.3) | 19 (24.7) | NS |
| Insuffisance cardiaque | 52 (14.8) | 20 (11.6) | 20 (19.6) | 12 (15.6) | NS |
| Débit de filtration glomérulaire (ml/min/1,73 m2) | 79.6 | 81.9 | 80.7 | 72.9 | |
| µg/l de TnT (médiane) | 0.285 (0.01–6.87) | 0.009 (0.001–0.46) | 0.009 (0.009–0.03) | 0.066 (0.009–6.870) | |
| Hs-TnT ng/l (médiane) | 63.87 (2.99–7.096) | 5.5 (1.2–481.6) | 11.69 (1.99–66) | 90.4 (2.9–7.096) | |
| NT-proBNP pg/ml (médiane) | 1.130 (5.46255) | 141 (5-13.302) | 238.5 (16.4–9.164) | 589 (41-46.255) | |
| Électrocardiogramme avec douleur (70.67%) | |||||
| Normale | 103 (41.1) | 70 (61.4) | 22 (27.5) | 11 (20) | |
| T neg | 57 (23) | 21 (18.6) | 23 (28.8) | 13 (23.6) | |
| ↓ D | 60 (24.5) | 9 (8) | 26 (32.6) | 25 (45.4) | |
| Évolution des symptômes (min) (88%) | |||||
| ≤ 3h (%) | 46 | 63 (42) | 43 (44.8) | 41 (55.4) | 0.16 |
| >3h (%) | 57 | 87 (58) | 53 (55) | 33 (44.6) | NS |
| Catheterization | 36.9 | 12 (7) | 64 (62.7) | 53 (68.8) | |
| Angioplasty | 20.9 | 2 (1.2) | 29 (28.4) | 41 (53.2) | |
| Stent | 18.7 | 1 (0.6) | 28 (27.5) | 35 (45.5) | |
| Dérivation | 2.2 | 0 | 4 (3.9) | 4 (5.2) | |
| Décharge du service d’urgence | 41.1 | 128 (74.7) | 10 (10.9) | 5 (6.6) | |
| Sortie de l’hôpital | 57.8 | 44 (25.3) | 92 (88.1) | 72 (91) | |
| Mort | 1.1 | 0 | 1 (1.9) | 3 (3.8) | |
AHT: hypertension artérielle; AMI: infarctus aigu du myocarde; NS: non significatif; NT-proBNP: peptide natriurétique cérébral; ACS: syndrome coronarien aigu; TnT: troponine T; hs-TnT: troponine T à haute sensibilité.
Au total, 55,4% des patients atteints d’IAM ont atteint l’EES dans les trois premières heures, tandis qu’un pourcentage plus élevé de ceux atteints d’UA et de ceux sans SCA sont arrivés après trois heures. En ce qui concerne la positivité des marqueurs selon le diagnostic final, 87% des patients ayant un diagnostic final d’AMI ont présenté un cTn 4G > 0,035 µg / l au cours des 12 premières heures de l’étude. Dans le cas des patients non ACS et ceux atteints d’UA, la positivité a été enregistrée dans 4% des cas. La concentration de hs-TnT était > 13ng/l (p99) chez 26,7 % et 46 % des patients ayant reçu un diagnostic de non-ACS et d’UA, respectivement (Fig. 1). D’autre part, 4G cTn utilisant p99 avec un point de coupure de 0.01µg / l (l’étalon-or de l’étude) s’est avéré positif chez 16% des patients diagnostiqués avec UA et chez 11% de ceux sans SCA.
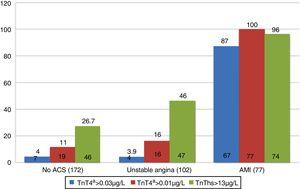
Positivité du marqueur selon le diagnostic final. AMI: infarctus aigu du myocarde; SCA: syndrome coronarien aigu; TnT: troponine T; hs-TnT: troponine T à haute sensibilité.
En appliquant la cinétique parmi certaines des quatre déterminations (critère Δ), 21,5% des patients atteints d’UA ont montré une élévation de hs-TnT + Δ (Fig. 2).

Positivité + Δ des marqueurs selon le diagnostic final. AMI: infarctus aigu du myocarde; SCA: syndrome coronarien aigu; TnT: troponine T; hs-TnT: troponine T à haute sensibilité.
Lors de la première mesure (T0), la sensibilité diagnostique du hs-TnT était significativement supérieure à celle du cTn 4G (CV) (87,0%; 83,0–90,3% contre 42,9%; 37,6–48,2%; p
0,05), ce qui donne une valeur prédictive négative de 95,1%. Cependant, sa spécificité (71,5%; 66,5–76,2% vs 97,4%; 95,2–98,8%; p0.05) et sa valeur prédictive positive (46,2% vs 82,5; p0.05) étaient clairement inférieures à celles du cTn 4G (CV). En analysant l’aire sous la courbe ROC, on a constaté que le hs-TnT était supérieur à 4G cTn (CV) (0,792; 0,746–0,833 vs. 0,701; 0,650–0,748) (Fig. 3 et 4).
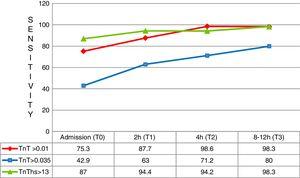
Sensibilité aux différents temps de test. TnT: troponine T; hs-TnT: troponine T à haute sensibilité.
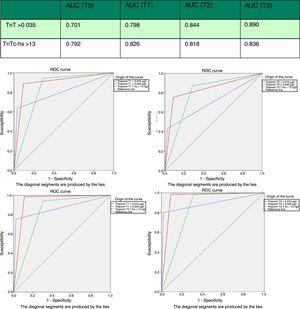
Aire sous la courbe (ASC) de hs-TnT et de TnT 4G dans les courbes d’échantillonnage et de caractéristique de fonctionnement du récepteur (ROC). ASC: aire sous la courbe; TnT: troponine T; hs-TnT: troponine T à haute sensibilité.
Deux heures après l’arrivée du patient dans l’HES (T1), le hs-TnT a continué de montrer une sensibilité diagnostique beaucoup plus élevée que le cTn 4G (94,4%; 91,3–96,6 contre 63,0%; 57,6–68,2; p0,05). La valeur prédictive négative de hs-TnT était pratiquement absolue (97,9%), et sa précision diagnostique avait tendance à être supérieure à celle du cTn 4G (ROC 0,826 contre 0,798). La faible spécificité du hs-TnT a entraîné une faible valeur prédictive positive (46,5%). Les autres résultats d’échantillonnage se sont avérés similaires, bien que reflétant une performance diagnostique moindre.
Au cours des trois premières heures suivant l’apparition des symptômes, un total de 41 patients sont arrivés avec un diagnostic final d’IAM. Dans ces cas, la sensibilité diagnostique supérieure du hs-TnT par rapport au cTn 4G (CV) et au cTn 4G (p99) était particulièrement significative, avec une sensibilité de 87,8% contre 36,6% et 73,2%, respectivement (Fig. 5).
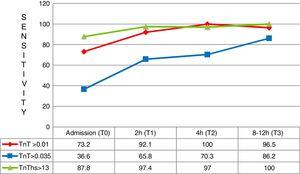
Sensibilité aux différents moments de test pour les patients présentant des symptômes d’apparition min. TnT: troponine T; hs-TnT: troponine T à haute sensibilité.
Les patients diagnostiqués avec un infarctus du myocarde sans élévation de la ST (n = 36) et présentant de longs temps d’évolution (> 3h) ont montré une précision diagnostique moindre avec hs-TnT (en raison de la spécificité plus faible) que les patients avec un temps plus court depuis l’apparition des symptômes. En appliquant la cinétique, on a de nouveau observé un gain de spécificité, avec une augmentation de l’ASC. En conséquence, dans le cas de hs-TnT, nous avons commencé avec une spécificité de 69% et, en appliquant Δ, la spécificité a atteint 85%, avec une valeur prédictive positive de 55,3%, ce qui a amélioré les performances diagnostiques globales (Tableau 2).
Cinétique (Δ) des différentes troponines cardiaques chez les patients présentant des symptômes > 180min.
| Sensibilité | Spécificité | PPV, % | NPV,% | ASC | |
|---|---|---|---|---|---|
| cTnT > 0,01 + Δ | 100% (97.9–100) | 96.4% (92.4–98.6) | 86.8 | 100 | 0.982 |
| cTnT > 0,035 + Δ | 81.8% (75.2–87.2) | 97.9% (94.4–99.4) | 90.0 | 95.8 | 0.898 |
| hs-TnT > 13+Δ | 78.8% (71.9–84.6) | 85.0% (78.8–89.9) | 55.3 | 94.4 | 0.818 |
ASC: aire sous la courbe; cTnT: troponine T cardiaque; hs-TnT: troponine T haute sensibilité; PPV: valeur prédictive positive; VAN: valeur prédictive négative.
De plus, nous avons évalué les points de coupure optimaux dérivés de l’analyse ROC. Le point optimal a été établi à 37ng/l (hs-TnT-ROC) (tableau 3). La valeur pour hs-TnT-ROC présentait une sensibilité de 59.7% – bien inférieur à celui du hs-TnT, mais supérieur à celui du TnT 4G (CV) – et une spécificité de 95,3% lors de la première mesure. Cette plus grande sensibilité par rapport au TnT 4G (CV) a persisté dans le reste des échantillonnages.
Comparaison des performances diagnostiques du ROC hs-TnT (> 37).
| T0 | Sensitivity, % | Specificity, % | EFF, % | LR+ | LR− | PV+, % | PV−, % |
|---|---|---|---|---|---|---|---|
| cTnT>0.01 | 75.3 | 91.2 | 87.7 | 8.60 | 0.27 | 70.7 | 92.9 |
| cTnT>0.035 | 42.8 | 97.5 | 85.5 | 16.8 | 0.59 | 82.5 | 85.8 |
| hs-TnT>13 | 87 | 71.5 | 74.9 | 3.1 | 0.18 | 46.2 | 95.1 |
| hs-TnT>37 | 59.7 | 95.3 | 87.5 | 12.6 | 0.42 | 78 | 89.4 |
cTnT: troponine T cardiaque; hs-TnT: troponine T haute sensibilité.
Le gain de temps pour atteindre un diagnostic lors de l’utilisation de hs-TnT par rapport à 4G cTn (CV) était de 113 minutes. L’économie à son tour serait de 147min (p0,001) dans le cas des patients admis en moins de 3h après l’apparition des symptômes, et de 63min (p = 0,024) dans le cas des patients admis plus de trois heures après l’apparition des symptômes.
Discussion
Les données obtenues dans la présente étude permettent de clarifier certaines questions concernant l’utilisation du hs-TnT dans la prise de décision, compte tenu des preuves solides de son utilité comme outil de diagnostic et de pronostic dans l’ACS. La performance diagnostique de notre hs-TnT a finalement été jugée supérieure à celle du cTn 4G à chacun des différents points temporels d’échantillonnage. La performance à son tour a diminué au cours des heures suivant l’apparition des symptômes. Dans notre étude, nous avons utilisé des changements relatifs entre deux échantillons (en particulier 20%) qui ont discrètement amélioré la valeur prédictive positive, mais sans devenir d’une utilité pratique. À cet égard, un Δ de 20% peut éventuellement être trop petit et, comme proposé par certains auteurs, il aurait pu être souhaitable d’augmenter Δ à un pourcentage plus élevé, car de nombreux cas d’AMI se sont révélés à des valeurs discrètement supérieures à la limite supérieure de référence (URL).9,10 D’autres chercheurs proposent des changements relatifs de Δ (entre 30 et 250%) pour augmenter la spécificité diagnostique et améliorer le diagnostic d’AMI.11-14 Mueller et coll.15 résultats publiés qui expliquent pourquoi les changements relatifs de Δ ne permettent pas de déterminer l’infarctus du myocarde sans élévation de la ST. Avec l’utilisation des changements absolus de Δ, une augmentation ou une diminution d’au moins 9,2 ng / l pour la population de patients atteints de SCA et de non-SCA, ou de 6,9 ng / l pour une population atteinte de SCA, semble être plus adéquate que les changements relatifs de Δ pour exclure l’IAM. En plus de ces problèmes de diminution de la spécificité, il existe des différences d’URL selon le test utilisé. Cela met en évidence l’importance de la race, du sexe, de l’âge ou du nombre de participants à l’étude16, et ajoute une difficulté accrue à parvenir à un consensus dans la prise de décisions.
Dans notre étude, la supériorité de la sensibilité de hs-TnT dans le diagnostic d’un infarctus du myocarde sans élévation de la ST s’est avérée plus grande chez les patients présentant des symptômes récents, en concordance avec les résultats d’autres auteurs.17,18 Pour un patient signalant une douleur thoracique pendant moins de trois heures, et avec une deuxième détermination négative deux heures après l’arrivée, nous pouvons exclure l’AMI dans près de 100% des cas. Ceci, combiné aux résultats cliniques et à l’ECG, peut identifier des candidats à une sortie précoce et à une prise en charge ambulatoire. D’autre part, les patients diagnostiqués avec un infarctus du myocarde sans élévation de la ST et présentant de longs temps d’évolution (plus de 3h) montrent une précision diagnostique moindre avec hs-TnT, même lors de deux déterminations en série. Dans ces cas, nous devrions évaluer les points de coupure optimaux dérivés de l’analyse ROC. Dans notre étude, le point de coupure était de 37ng / l, ce qui nous permettrait de « statuer », c’est-à-dire que les patients avec des scores supérieurs à ce point de coupure auraient une très forte probabilité de présenter une IAM. Il a également été soutenu que cette diminution de la spécificité a été sous-estimée dans la littérature et qu’elle ne reflète pas les patients observés dans les HES de nos hôpitaux, où l’âge moyen, les comorbidités et les élévations cTn ont tendance à être élevés.
Le délai de diagnostic a été considérablement réduit (de 247 à 71.5min).19,20 Dans notre étude, le gain de temps pour le diagnostic d’infarctus du myocarde sans élévation de la ST était de 147 minutes chez les patients signalant moins de trois heures après l’apparition des symptômes et de 63 minutes après 3h.
Vingt-deux des patients (21,5%) avec un diagnostic d’UA à la sortie seraient des cas d’infarctus du myocarde sans élévation de la ST après deux déterminations de hs-TnT avec une cinétique de plus de 20% entre eux. Jusqu’à 13.9% des patients non ACS (n = 24) présenteraient une positivité avec hs-TnT lors de l’application de cette cinétique, et correspondraient à d’autres conditions pathologiques causant des lésions cardiaques progressives, telles que la myocardite, l’embolie pulmonaire ou le syndrome de takotsubo. Différentes analyses hs-TnT détectent jusqu’à 27% plus de cas d’IAM que la méthode actuelle chez les patients souffrant de douleurs thoraciques et d’une probabilité faible ou intermédiaire de SCA.20,21 On pourrait même supposer que le diagnostic d’UA disparaîtrait, comme l’ont souligné Sabatine et al.22 chez les patients avec des tests d’exercice positifs évalués avec des techniques ultrasensibles. Dans cette étude, l’hs-TnI était détectable chez tous les patients avant les tests; restait sans changement chez les patients sans ischémie; et augmentait de 24% chez ceux présentant une ischémie légère et de 40% chez ceux présentant une ischémie modérée à sévère. Aucun changement n’a été observé avec le cTn 4G. Par conséquent, les résultats renvoyés au diagnostic d’infarctus du myocarde sans élévation de la ST à l’aide de cTn classiques sont préoccupants, car les lésions myocardiques ont une mesure limitée et les valeurs de cTn n’augmentent pas toujours tôt, ou leurs incréments ne sont pas suffisants pour permettre une identification précoce.
Des protocoles de solution rapide devraient être introduits, selon lesquels nos patients présentant un faible risque ischémique et un suivi ECG normal ne passeraient que 3 à 4h à l’hôpital.23,24 On s’est demandé si une seule détermination du hs-TnT suffisait pour exclure l’ami25, et d’autres études ont évalué la possibilité d’une seule détermination si la valeur du hs-TnT est
ng/l (c’est-à-dire indétectable).24 Toutes ces situations doivent être prises en compte à l’avenir.Conclusions
Les tests de troponine T à haute sensibilité améliorent les performances diagnostiques, raccourcissent le délai de diagnostic de l’IAM et permettent d’identifier un plus grand nombre de patients présentant des infarctus plus petits, qui étaient auparavant diagnostiqués comme une UA et qui présentent un risque de mortalité élevé, par rapport au cTn conventionnel. De plus, cela raccourcit le délai d’élimination des cas, car l’AMI pourrait être éliminée dans les 2h. Tout cela implique un traitement plus précoce pour les patients atteints de nécrose myocardique et un raccourcissement du séjour du patient dans l’HES. Cependant, chez les personnes qui se présentent au HES après trois heures d’apparition des symptômes, le hs-TnT ne serait pas en mesure d’améliorer les performances diagnostiques du cTn 4G, et la prise de décision devrait donc être plus prudente. Les tests hs-cTn changent la prise en charge et le concept des patients souffrant de douleurs thoraciques suggérant un SCA. Il est donc nécessaire que les médecins d’urgence et de soins intensifs se familiarisent avec leur utilisation courante.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.