 |
|
La plupart des réactions en milieu aqueux impliquent des ions. Cependant, lorsqu’une réaction a lieu, deux types d’ions émergent généralement: (1) les ions « spectateurs » et (2) les ions « joueurs ». Les noms impliquent le caractère des ions par rapport à la réaction. Les ions joueurs sont directement dans la réaction alors que les ions spectateurs remplissent le rôle de spectateurs et leur fonction principale est de maintenir la neutralité électrique dans la solution. Considérez la réaction de précipitation qui se produit lorsque des solutions aqueuses de chlorure de sodium et de nitrate d’argent sont mélangées. Un précipité blanc d’AgCl se forme. L’équation chimique de cette réaction s’écrit comme suit:
Cette équation contient tous les ions dans la solution. Cependant, il est parfois nécessaire d’inclure uniquement les ions qui sont des joueurs et de laisser de côté les spectateurs. Une équation chimique qui ne contient que les ions joueurs est appelée équation ionique nette (nie). Pour obtenir le nie (1), écrivez tous les composés solubles sous forme d’ions et (2) éliminez les ions communs aux réactifs et aux produits. L’équation chimique résultante est alors la nie. Pour l’équation ci-dessus, nous avons: (pour l’étape 2, déplacez la souris sur la réaction)
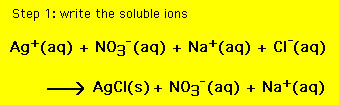
L’équation résultante est l’équation ionique nette,
Bien que la réaction ci-dessus soit particulièrement simple (c’est-à-dire que tous les coefficients stoechiométriques sont égaux à 1), le résultat de nie plus complexe résulte d’une procédure similaire. Par exemple, si le nitrate de fer (III) est mélangé avec du sulfure d’ammonium, il en résulte un précipité jaune de sulfure de fer (III). Le nie pour cette réaction est: