Dernière Mise à jour le 4 février 2021 par Sagar Aryal
Il existe deux voies de synthèse des nucléotides des purines:
- Voie de synthèse de Novo, et voie de récupération
- .
La synthèse de novo de la Purine
La synthèse de novo du nucléotide purine signifie utiliser le phosphoribose, les acides aminés, les unités un carbone et le CO2 comme matières premières pour synthétiser le nucléotide purine dès le début. C’est la principale voie de synthèse des nucléotides.
Localisation
La synthèse des purines se produit dans tous les tissus. Le site principal de la synthèse des purines se trouve dans le foie et, dans une mesure limitée, dans le cerveau.
- Substrats: Ribose-5-phosphate; glycine; glutamine; H2O; ATP; CO2; aspartate.
- Produits: BPF; AMP; glutamate; fumarate; H2O.
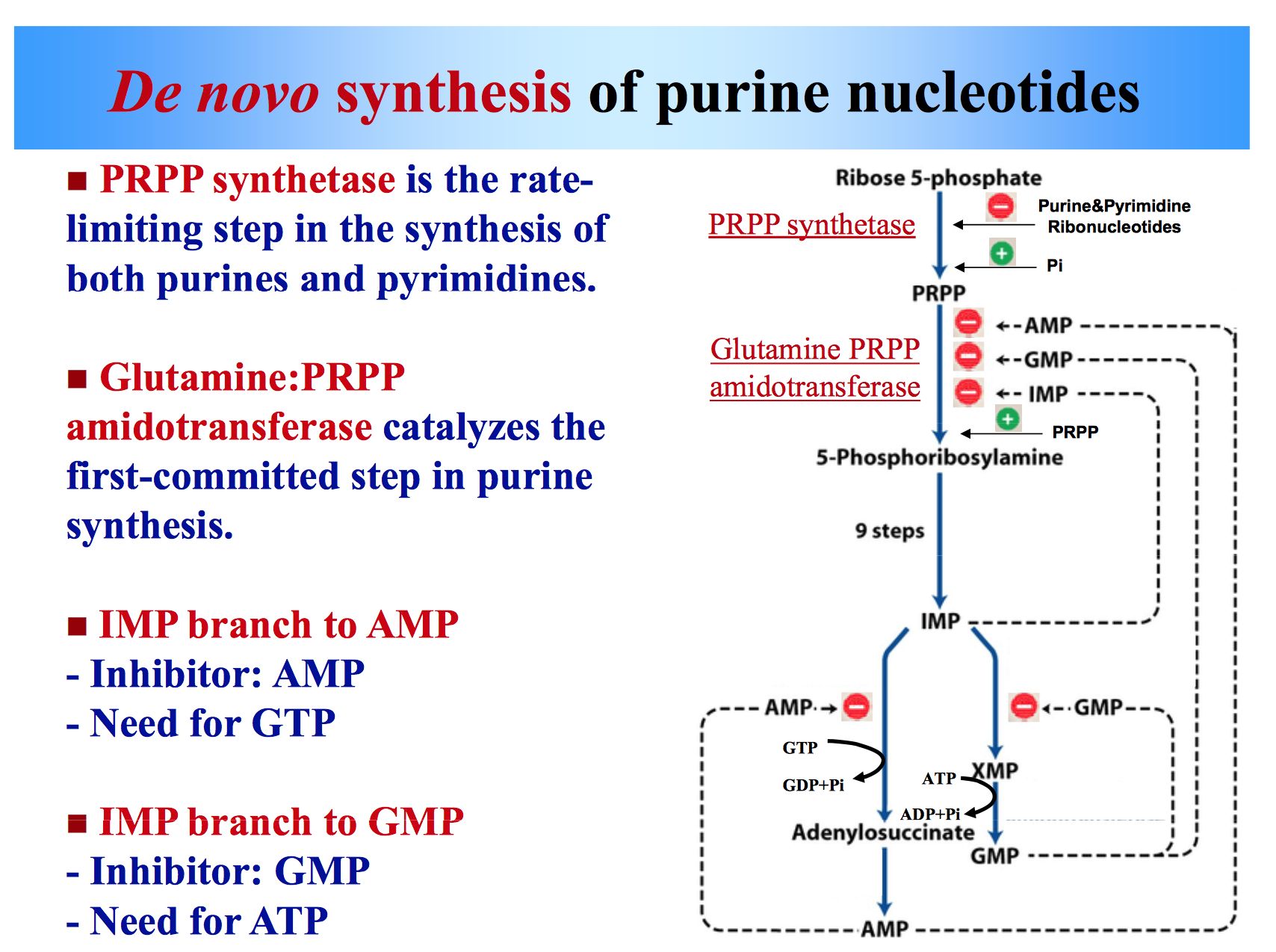
Aperçu du parcours
- Le ribose-5-phosphate (tel que fourni par la voie pentose-phosphate) est converti en PRPP (Phosphoribosyl pyrophosphate) par la PRPP synthétase, dans une étape nécessitant un ATP.
- Dans l’étape engagée du procédé, un groupe α-amino est ensuite ajouté au PRPP à partir de la glutamine pour former la 5-phosphoribosylamine. Cette réaction est catalysée par la glutamine PRPP amidinotransférase.
- Une série de neuf réactions entraîne la formation d’IMP (Inosine 5′-monophosphate).
- L’IMP peut alors être transformé soit en GMP par l’IMP déshydrogénase, soit en AMP par l’adénylosuccinate synthétase.
Réactions de la voie
(1) La base de purine est synthétisée sur la fraction ribose.
(a) le 5′-Phosphoribosyl 1′-pyrophosphate (PRPP), qui fournit le fragment ribose, réagit avec la glutamine pour former la phosphoribosylamine. Cette première étape de la biosynthèse des purines produit du N9 du cycle purine et est inhibée par l’AMP et les BPF.
(b) La molécule de glycine entière est ajoutée au précurseur de purine en croissance. Ensuite, C8 est ajouté par formyl-FH4, N3 par la glutamine, C6 par CO2, N1 par l’aspartate et C2 par formyl-FH4.
(c) IMP, qui contient l’hypoxanthine de base, est généré. IMP est clivé dans le foie. Sa base libre, ou nucléoside, se déplace vers divers tissus où elle est reconvertie en nucléotide.
(2) IMP est le précurseur de l’AMP et des BPF.
(a) Chaque produit, par inhibition de rétroaction, régule sa propre synthèse à partir du point de branchement de l’IMP et inhibe l’étape initiale de la voie.
(b) L’AMP et le GMP peuvent être phosphorylés au niveau du triphosphate.
(c) Les triphosphates nucléotidiques (ATP et GTP) peuvent être utilisés pour des processus nécessitant de l’énergie ou pour la synthèse d’ARN.
(3) La réduction de la fraction ribose en désoxyribose se produit au niveau du diphosphate et est catalysée par la ribonucléotide réductase, qui nécessite la protéine thiorédoxine.
(a) Après phosphorylation des diphosphates, le dATP et le dGTP peuvent être utilisés pour la synthèse de l’ADN.
(4) Les bases purines peuvent être récupérées et converties entre les bases libres, les nucléotides et les nucléosides par une série de réactions.
Enzymes importantes et régulation
- PRPP synthétase: Inhibée par AMP, IMP et GMP.
- amidinotransférase de la glutamine PRPP : Inhibée par l’AMP, l’IMP et les BPF.
- déhydrogénase IMP : Inhibée par les BPF.
- Adénylosuccinate synthétase : Inhibée par l’AMP.
Inhibiteurs pharmacologiques
Bien que non représenté, le tétrahydrofolate est impliqué dans deux réactions de synthèse de la purine de novo. Les analogues de l’acide folique, tels que le méthotrexate, inhibent la formation de tétrahydrofolate et interfèrent ainsi avec la synthèse des purines.
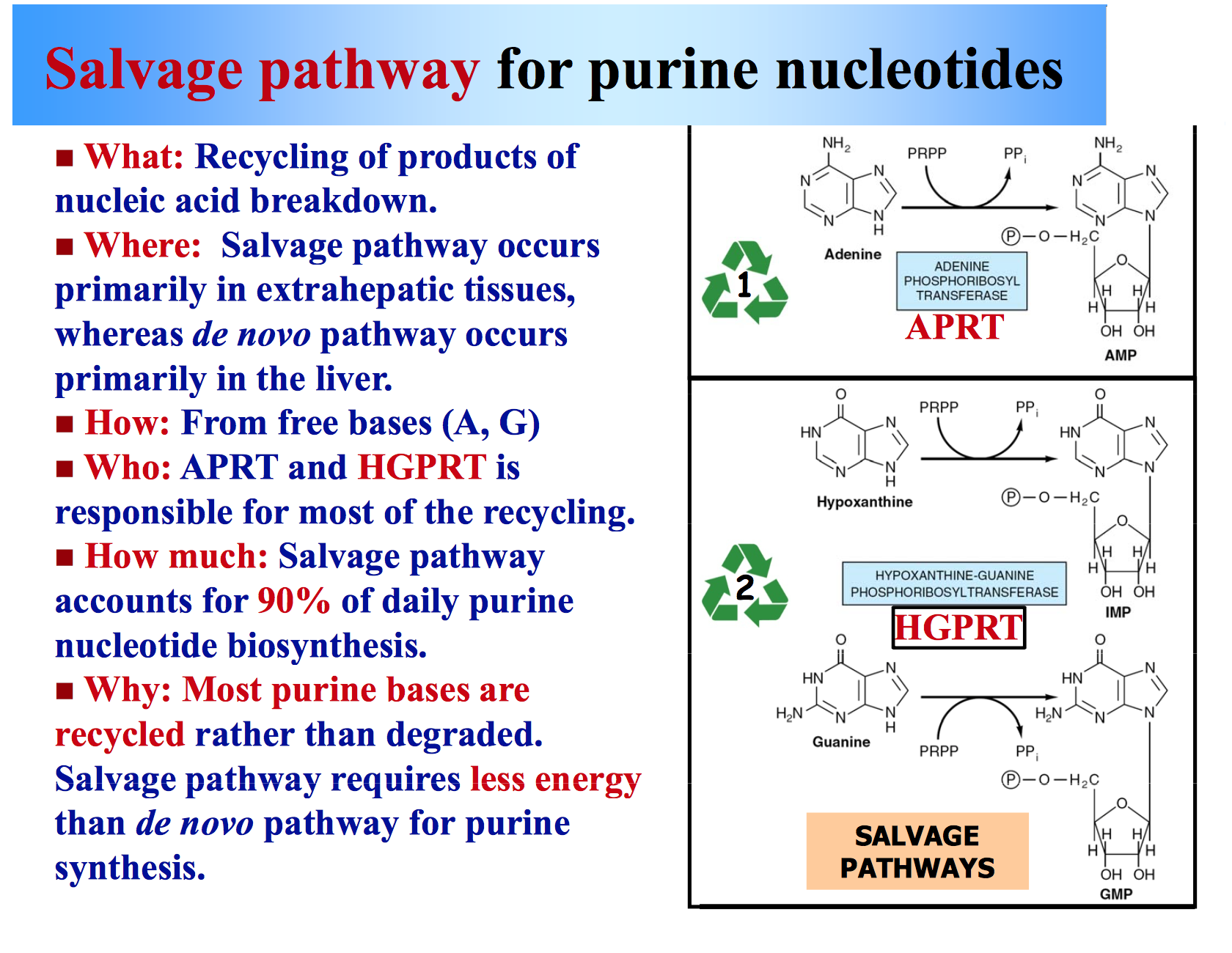
Voie de récupération des purines
Une voie de récupération est une voie dans laquelle des nucléotides sont synthétisés à partir d’intermédiaires dans la voie de dégradation des nucléotides.
Localisation
La synthèse des purines par les voies de récupération se produit dans tous les tissus. Il est particulièrement important dans le cerveau et la moelle osseuse.
- Substrats: Hypoxanthine; PRPP; guanine; adénine.
- Produits: GMP; AMP; IMP.
Aperçu de la voie
- Les bases des acides nucléiques dégradés peuvent être reconverties en nucléotides purines via les voies de récupération.
- L’hypoxanthine peut être associée au PRPP (qui agit comme donneur de phosphate de ribose-5) pour former l’IMP dans une réaction catalysée par l’Hypoxanthine-guanine phosphoribosyltransférase (HGPRT).
- L’IMP peut ensuite être transformé en AMP ou GMP via les dernières étapes de la voie de synthèse de la purine de novo.
- HGPRT catalyse également la réaction qui combine PRPP avec la guanine pour former des BPF.
- L’adénine phosphoribosyltransférase convertit l’adénine et le PRPP en AMP.
Enzymes importantes et régulation
- HGPRT: Inhibée par la PMI et les BPF.
- Adénine phosphoribosyltransférase : Inhibée par l’AMP.
Maladie associée
Une carence en HGPRT conduit au syndrome de Lesch-Nyhan, caractérisé par une auto-mutilation et une détérioration du SNC.
Signification de la synthèse des purines
- Les purines servent de blocs constitutifs des acides nucléiques.
- L’ATP joue un rôle important dans la transformation énergétique.
- L’ATP, l’ADP et l’AMP peuvent fonctionner comme régulateurs allostériques et participer à la régulation de nombreuses voies métaboliques.
- L’ATP implique une modification covalente des enzymes. façon.
- Les cGMP sont des messagers secondaires.
- Les voies de récupération sont utilisées pour récupérer les bases et les nucléosides qui se forment lors de la dégradation de l’ARN et de l’ADN.
- Par rapport à la voie de novo, la voie de récupération est économe en énergie.
- Dans les tissus cérébraux et médullaires, la voie de récupération est la seule voie de synthèse nucléotidique.
- Smith, C. M., Marks, A.D., Lieberman, M. A., Marks, D. B., & Marks, D. B. (2005). Biochimie médicale de base de Marks: Une approche clinique. Philadelphie : Lippincott Williams & Wilkins.
- https://www.slideshare.net/hirapure/de-novo-and-salvage-pathway-of-purines
- Rodwell, V. W., Botham, K. M., Kennelly, P. J., Weil, P.A., & Bender, D.A. (2015). Harper’s illustrated biochemistry (30e éd.). La ville de New York, dans l’État de New York : McGraw-Hill Education LLC.
- John W. Pelley, Edward F. Goljan (2011). Biochimie. Troisième édition. Philadelphie: États-Unis.