INTRODUCTION
Les stents à élution médicamenteuse (DES) sont associés à des taux significativement plus faibles de revascularisation de la lésion cible par rapport aux stents à métal nu (BMS). Cependant, une double thérapie antiplaquettaire à long terme (DAPT) est invariablement nécessaire pour éviter une thrombose tardive du stent liée à un retard de guérison, empêchant l’utilisation fréquente de DES chez les patients à haut risque de saignement. Depuis de nombreuses années, les lignes directrices recommandent une période d’au moins 12 mois de DAPT basée sur les performances des DES de première génération.1 Récemment, les directives européennes ont recommandé 6 mois de DAPT pour les patients stables (niveau de preuve B).2 Les essais et registres des DES de nouvelle génération ont montré des taux de thrombose inférieurs à ceux DES DES de première génération ou même BMS.3-7 Une analyse rétrospective des études de DES de nouvelle génération a révélé que l’arrêt précoce ou l’interruption du DAPT au-delà de 1 à 3 mois après l’implantation ne semblait pas augmenter le risque de risque.8,9
Plusieurs essais ont comparé des durées DAPT distinctes (3-6 mois vs 12-24 mois).10 à 16 Analyses individuelles et groupées de 4 de ces essais ont démontré que les schémas DAPT à plus court terme montrent des taux similaires d’événements ischémiques tout en diminuant simultanément l’incidence des événements hémorragiques.10-17
Néanmoins, certaines mises en garde limitent l’applicabilité généralisée de ces essais, y compris la conception rétrospective des analyses et les biais associés, certains avec des échantillons de petite taille, une adhésion limitée aux protocoles et l’utilisation fréquente de DES obsolètes. Par exemple, la version du stent à élution du zotarolimus utilisée dans ces essais est connue pour présenter un degré relativement élevé de perte de lumière tardive, ce qui lui vaut la réputation d’être un stent dont le comportement se situe quelque part entre un BMS et le DES de nouvelle génération. Ces essais comprenaient également le BMS et le DES de première génération.
Nous présentons un registre prospectif multicentrique visant à évaluer l’innocuité d’une approche DAPT à 6 mois chez les patients recevant un DES non de première génération par rapport aux résultats d’une série appariée de patients recevant 12 mois de DAPT.
MÉTHODES
Le registre ESTROFA-DAPT prospectif multicentrique implique 18 centres dans toute l’Espagne. Cette analyse fait partie du Projet et du Réseau d’études ESTROFA et a été soutenue par le Groupe de Travail Espagnol de Cardiologie Interventionnelle de la Société Espagnole de Cardiologie. Dans chaque centre, les patients ont reçu une DAPT avec de l’acide acétylsalicylique et du clopidogrel pendant 6 mois après l’implantation du DES selon les critères suivants:
- •
Une indication clinique pour une intervention percutanée avec un DES non de première génération dans l’un des contextes cliniques suivants: a) ischémie silencieuse; b) angine stable; c) angor instable sans élévation de la troponine; d) patients présentant un infarctus du myocarde sans élévation du segment ST ou de l’élévation du segment ST sans risque de saignement estimé faible sur une DAPT à long terme mais toujours considérés comme des candidats au traitement par DES (c.-à-d. patients > 75 ans, ceux ayant des antécédents d’ulcère gastro-duodénal sans saignement, insuffisance rénale chronique modérée à sévère ou maladie hépatique modérée, et ceux ayant une chirurgie non cardiac élective > 6 mois).
- •
En ce qui concerne la procédure, les lésions coronaires principales gauches ont été exclues, ainsi que les bifurcations traitées avec 2 stents ou les patients nécessitant plus de 3 stents. Les patients ayant des antécédents de thrombose tardive DES ont également été exclus.
La décision de sélectionner ces critères d’inclusion était basée sur les préoccupations d’innocuité suivantes: a) L’utilisation du DAPT pendant 12 mois après un syndrome coronarien aigu (SCA) est étayée par des preuves et est recommandée dans diverses lignes directrices cliniques et documents de consensus.1,2,18 – 21 Seuls les patients présentant un SCA à faible risque et un certain risque de saignement pourraient être inclus. b) L’étude avait un protocole axé sur la sécurité; ainsi, l’inclusion de patients présentant un risque plus élevé de thrombose du stent (> 3 stents, bifurcations avec des techniques à 2 stents et thrombose tardive antérieure avec DES) et ceux présentant un risque élevé de décès lors d’un événement thrombotique (stents dans l’artère principale gauche) ont été exclus.
En fait, ces sous-groupes (SCA, lésions multiples et lésions complexes) ont montré une tendance à tirer davantage de bénéfices après une période de TDAP plus longue par rapport aux sous-groupes présentant une angine stable ou des lésions uniques dans l’essai PRODIGY.10
Toutes les données cliniques, angiographiques et de procédure de référence ont été rapportées dans une base de données commune spécialement conçue pour cette étude. Des informations sur le suivi clinique ont également été soumises, et ces données ont été régulièrement mises à jour lors des examens du registre et de la base de données des hôpitaux, ainsi que par contact avec les patients. Une vérification du DAPT pour la période ≤ 6 mois du DAPT a été requise et confirmée par contact avec le patient. La décision finale a été prise au centre de coordination (Hospital Universitario Marqués de Valdecilla) par 2 enquêteurs aveugles (Drs. De la Torre et García Camarero).
Pour comparer cette cohorte avec la cohorte DAPT de 12 mois, nous avons examiné la base de données de l’étude ESTROFA-2, déjà publiée en 2010.22 Il s’agissait d’un registre prospectif multicentrique conçu pour évaluer l’incidence de la thrombose après l’implantation de DES de deuxième génération, qui comprenait 4768 patients; parmi ceux-ci, 4354 ont été traités avec 12 mois de DAPT. En utilisant les deux bases de données du registre (ESTROFA-DAPT et ESTROFA-2), une analyse du score de propension a été entreprise pour obtenir 2 cohortes comparables de patients traités avec un DAPT de 6 ou 12 mois.
Ces 2 registres, bien que menés à des périodes différentes, ont été construits en utilisant une méthodologie similaire. L’équipe de pilotage et de coordination était la même et les formulaires de dossier clinique en ligne partageaient le même format; la plupart des centres actifs dans ESTROFA-DAPT ont également recruté des patients dans ESTROFA-2 (13 des 18 centres). Enfin, les principaux enquêteurs impliqués dans l’analyse des deux bases de données du registre étaient les mêmes. L’arbitrage des événements a été mené avec des définitions d’événements préétablies et des renseignements supplémentaires ont été demandés au besoin pour obtenir une décision finale appropriée.
Paramètres et définitions
Le critère principal de l’étude était la survie sans événement sur 12 mois (décès cardiaque, infarctus du myocarde, revascularisation et saignements majeurs) dans les deux groupes de traitement par DAPT. Les paramètres secondaires comprenaient le décès toutes causes confondues, la mort cardiaque, l’infarctus du myocarde non mortel, la revascularisation coronarienne, la thrombose d’endoprothèse définie, la thrombose d’endoprothèse définie ou probable, la thrombose d’endoprothèse définie ou probable dans la période de 6 à 12 mois après l’intervention coronarienne percutanée d’indice et les événements hémorragiques majeurs.
Les définitions spécifiques des événements cardiovasculaires indésirables majeurs étaient les suivantes. L’infarctus du myocarde a été défini comme une augmentation typique et une chute progressive (troponine), ou comme une augmentation et une chute plus rapides (créatine-kinase-MB) de marqueurs biochimiques compatibles avec une nécrose myocardique en association avec au moins 1 des éléments suivants: symptômes ischémiques, développement d’ondes Q pathologiques sur l’électrocardiogramme, modifications de l’électrocardiogramme indiquant une ischémie (élévation du segment ST ou dépression), ou résultats pathologiques compatibles avec un infarctus aigu du myocarde. La revascularisation a été définie comme tout type de revascularisation coronaire percutanée ou chirurgicale cliniquement indiquée. Une thrombose d’endoprothèse certaine ou probable a été envisagée selon les définitions par le Consortium de recherche universitaire.23 événements hémorragiques ont été classés selon les critères du consortium de recherche académique sur les saignements (BARC).24
Analyse statistique
Sur la base des données antérieures d’ESTROFA-2 dans le sous-groupe de ce registre ayant un profil similaire à celui inclus dans ESTROFA-DAPT, un taux d’évaluation primaire de 6,5 % à 7,0 % a été supposé pour les deux groupes. Par conséquent, avec une puissance de 80% et une erreur de type I à 1 face de 5%, une taille d’échantillon de 1200 patients dans chaque groupe démontrerait une non-infériorité entre les 2 groupes pour le point final principal avec une marge fixe de non-infériorité de 2,5%, ce qui est conforme aux marges de non-infériorité utilisées dans les essais contemporains de DES et dans un essai comparant différentes périodes de DAPT.13 Si la limite supérieure de l’intervalle de confiance à 95% de la différence de traitement (DAPT à court et à long terme) était inférieure à 2.5%, l’hypothèse nulle serait rejetée, ce qui signifierait que le groupe à court terme n’était pas inférieur au groupe à long terme en ce qui concerne le critère d’évaluation principal à 12 mois.
Les variables continues sont présentées sous forme de moyenne ± écart-type. Les variables catégorielles sont exprimées en pourcentages. Les variables continues ont été comparées au test t de Student si elles suivaient une distribution normale et aux tests de Wilcoxon lorsqu’elles ne le faisaient pas (évaluation du type de distribution par le test de Kolmogorov-Smirnov). Les variables catégorielles ont été comparées au test du chi carré ou au test exact de Fischer, selon les besoins. Des courbes de Kaplan-Meier pour la survie sans événement ont été obtenues pour chaque groupe ou sous-groupe considéré dans l’analyse et ont été comparées au moyen du test de rang log. Des tests d’interaction ont été menés pour identifier des sous-groupes présentant différents risques de thrombose de l’endoprothèse sous les 2 périodes DAPT différentes.
Deux actions ont été réalisées pour sélectionner des séries comparables de patients dans ces 2 registres. Tout d’abord, nous avons appliqué les critères d’exclusion d’ESTROFA-DAPT à la base de données ESTROFA-2, de sorte que les patients présentant des lésions coronaires principales gauches traitées, des bifurcations traitées avec 2 stents, des patients avec plus de 3 stents implantés et ceux ayant des antécédents de thrombose tardive DES ont été exclus de l’analyse. Deuxièmement, nous avons mené un processus d’appariement des scores de propension. Toutes les variables énumérées dans les tableaux 1 et 2 ont été entrées en tant que covariables pour dériver les scores de propension. Le dialogue personnalisé « psmatching » a été utilisé conjointement avec la version SPSS 19. Le programme « psmatching » effectue toutes les analyses en R via le plugin SPSS R (version 2.10.1). Cette procédure comportait 3 étapes: a) Les scores de propension ont été estimés à l’aide d’une régression logistique dans laquelle la prescription d’un régime DAPT de 6 mois a été utilisée comme variable de résultat et toutes les covariables comme prédicteurs. b) Les patients ont été appariés à l’aide d’une simple correspondance de voisin le plus proche de 1: 1, basée sur un algorithme de correspondance « gourmand » qui a trié les observations dans le groupe DAPT de 6 mois en fonction de leur score de propension estimé. Cet algorithme a ensuite fait correspondre chaque unité séquentiellement à une unité du groupe DAPT de 12 mois avec le score de propension le plus proche. Pour exclure les mauvaises correspondances, nous avons imposé un étrier de 0,2 de l’écart-type du logit du score de propension. Nous n’avons pas tenu compte des unités en dehors de la zone de soutien commun (définie comme la région des distributions des scores de propension estimés dans les groupes DAPT de 6 mois et de 12 mois pour lesquels des unités ont été observées dans les deux groupes). Cela a été fait pour améliorer l’équilibre des covariables. c) Une série de vérifications de l’adéquation du modèle a été effectuée pour vérifier si un équilibre adéquat des covariables a été atteint grâce à la procédure d’appariement. Cela a été fait en calculant la mesure du déséquilibre global et en produisant 5 graphiques de diagnostic: des histogrammes des scores de propension dans les deux groupes avant et après l’appariement, un graphique en points des scores de propension individuels des unités du groupe témoin et du groupe de traitement, appariés ou non, des histogrammes des différences normalisées de tous les termes (covariables, terme quadratique, interactions) avant et après l’appariement, un graphique en points qui affiche l’ampleur des différences normalisées avant et après l’appariement pour chaque covariable, et un graphique linéaire des différences moyennes normalisées avant et après l’appariement. Un test du chi carré du déséquilibre global est fourni. Cette statistique de test, qui est liée à la statistique T2 de la célèbre Hotelling, évalue simultanément si une variable ou une combinaison linéaire de variables est significativement déséquilibrée après l’appariement. Le test a examiné toutes les covariables utilisées pour estimer le score de propension. Les différences normalisées ont été calculées pour toutes les covariables avant et après l’appariement afin d’évaluer l’équilibre après l’appariement. Une différence standardisée
Caractéristiques cliniques dans les groupes Appariés
| 6- mois DAPT (n = 1286) | 12- mois DAPT (n = 1286) | P | TSA (%) | |
|---|---|---|---|---|
| Âge, années | 67.3 ± 11 | 67.1 ± 11 | .6 | 4.4 |
| Femmes | 304 (23.5) | 300 (23.3) | .9 | 1.1 |
| Fumeur | 270 (21.0) | 286 (22.2) | .5 | 4.3 |
| Hypertension | 849 (66) | 836 (65) | .6 | 3.5 |
| Dyslipidémie | 769 (59.8) | 751 (58.4) | .5 | 3.3 |
| Diabète sucré | 526 (40.9) | 502 (39.0) | .3 | 5.7 |
| Insuffisance rénale* | 103 (8.0) | 99 (7.7) | .8 | 1.8 |
| MI Précédent | 279 (21.7) | 270 (20.9) | .7 | 2.6 |
| PCI Précédent | 370 (28.8) | 355 (27.6) | .4 | 5.6 |
| CABG Précédent | 63 (4.9) | 71 (5.5) | .5 | 4.9 |
| FEVG, % | 56 ± 12.5 | 56.2 ± 12.5 | .8 | 2.1 |
| Angine stable | 591 (45.9) | 581 (45.1) | .7 | 2.5 |
| Angor instable | 342 (26.6) | 351 (27.3) | .4 | 5.6 |
| Élévation hors segment ST MI | 140 (10.8) | 150 (11.6) | .3 | 6.7 |
| Élévation du segment ST MI | 54 (4.2) | 59 (4.6) | .5 | 4.2 |
| Ischémie silencieuse | 159 (12.3) | 145 (11.3) | .3 | 6.6 |
TSA, différence normalisée absolue; CABG, pontage aorto-coronarien; DAPT, double thérapie antiplaquettaire; FEVG, fraction d’éjection ventriculaire gauche; IM, infarctus du myocarde; ICP, intervention coronarienne percutanée.
Sauf indication contraire, les données sont exprimées en No. (%) ou moyenne ± écart type.
Une insuffisance rénale a été définie comme une créatinine sérique > 1,5 mg / dL.
Caractéristiques procédurales dans les groupes Appariés
| 6- mois DAPT (n = 1286) | 12- mois DAPT (n = 1286) | P | TSA (%) | |
|---|---|---|---|---|
| Non. de stents implantés | 1.17 ± 0.40 | 1.19 ± 0.40 | .2 | 7.2 |
| Longueur du stent, mm | 21.0 ± 8.0 | 21.2 ± 8.4 | .5 | 4.5 |
| Diamètre du stent, mm | 2.90 ± 0.40 | 2.91 ± 0.40 | .5 | 3.4 |
| In-stent restenosis | 96 (7.4) | 82 (6.3) | .3 | 6.7 |
| Bifurcation | 198 (15.4) | 217 (16.8) | .3 | 7.1 |
| Chronic total occlusions | 90 (7.0) | 72 (5.6) | .2 | 7.7 |
| LAD involvement | 602 (46.8) | 605 (47.0) | .9 | 0.9 |
| IVUS guidance | 71 (5.5) | 78 (6.0) | .6 | 3.5 |
| EES | 688 (53.5) | 646 (50.2) | .1 | 7.8 |
| Acetylsalicylic acid + clopidogrel | 1286 (100) | 1286 (100) | 1 | 0 |
ASD, absolute standardized difference; DAPT, dual antiplatelet therapy; EES, everolimus-eluting stent; IVUS, intravascular ultrasound; LAD, left anterior descending artery.
Sauf indication contraire, les données sont exprimées en No. (%), ou moyenne ± écart type.
Une valeur P
RÉSULTATS
Comme le montre l’organigramme de l’étude (Figure 1), à partir des cohortes ESTROFA-2 et ESTROFA-DAPT d’origine et après avoir effectué l’appariement du score de propension, nous avons obtenu 2 groupes de 1268 patients chacun: les groupes DAPT de 6 mois et DAPT de 12 mois. Les caractéristiques cliniques et procédurales des 2 groupes sont présentées dans les tableaux 1 et 2. Les différences standardisées estimées après appariement pour toutes les covariables sont fournies. Tous étaient
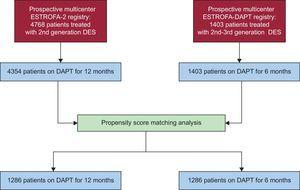
Organigramme de l’étude. DAPT, double thérapie antiplaquettaire; DES, stents à élution médicamenteuse.
En ce qui concerne la distribution DES DES, le DES le plus fréquemment utilisé dans les deux groupes était le stent à élution de l’évérolimus (53,5% dans le groupe DAPT à 6 mois vs 50,2% dans le groupe DAPT à 12 mois; P =.1). Le stent à élution de zotarolimus a été utilisé dans 28.8% du groupe DAPT à 6 mois contre 49,8% dans le groupe à 12 mois; coïncidant avec les marques Resolute® et Endeavor®, respectivement. Le stent à élution de biolimus a été utilisé dans 12,7% du groupe DAPT à 6 mois.
Aucun patient n’a été perdu pour le suivi et les taux d’observance du traitement étaient de 97% et 95% dans les groupes DAPT de 6 et 12 mois, respectivement. Cela signifie que seulement 3% dans le groupe DAPT de 6 mois ont prolongé la bithérapie au-delà de 6 mois et seulement 5% dans le groupe DAPT de 12 mois ont prolongé la bithérapie au-delà de la première année.
Les événements cliniques à 12 mois de suivi sont présentés dans le tableau 3. Aucune différence significative n’a été observée entre les groupes pour le critère d’évaluation principal (rapport de risque = 0,75; intervalle de confiance à 95 %, 0,54-1,05 pour le DAPT à 6 mois vs 12 mois) ou l’un des critères considérés, ce qui donne un P =.001 pour non-infériorité. Non seulement il y avait une incidence similaire d’événements ischémiques dans les groupes DAPT de 6 mois et de 12 mois, mais l’incidence de thrombose définie et définie ou probable était numériquement plus faible dans le groupe de 6 mois (figures 2 et 3). Les événements hémorragiques majeurs étaient numériquement plus fréquents dans le groupe DAPT à 12 mois, mais ne différaient pas significativement par rapport au groupe DAPT à 6 mois. L’incidence des événements cliniques dans la période de 6 à 12 mois est indiquée dans le tableau 4 alors que les patients étaient hors DAPT / sur DAPT dans les groupes DAPT de 6 mois et de 12 mois, respectivement. Aucune différence n’a été observée entre les groupes au cours de cette période.
Résultats à 12 mois de suivi
| 6- mois DAPT (n = 1286) | 12- mois DAPT (n = 1286) | P | |
|---|---|---|---|
| Paramètre principal | |||
| Décès cardiaque, infarctus du myocarde, revascularisation ou saignement BARC ≥ 3 | 65 (5.0) | 85 (6.6) | .09 |
| Paramètres secondaires | |||
| Décès toutes causes confondues | 21 (1.6) | 24 (1.9) | .4 |
| Mort cardiaque | 11 (0.9) | 13 (1.0) | .9 |
| Infarctus du myocarde | 10 (0.85) | 13 (1.00) | .8 |
| Revascularisation | 41 (3.2) | 55 (4.3) | .1 |
| Thrombose définitive | 3 (0.24) | 5 (0.40) | .5 |
| Thrombose définitive et probable | 6 (0.5) | 9 (0.7) | .4 |
| Événements hémorragiques BARC ≥ 3 | 10 (0.8) | 18 (1.4) | .2 |
BARC, Consortium de recherche académique sur les saignements; DAPT, thérapie antiplaquettaire double.
Les données sont exprimées en No. (%).
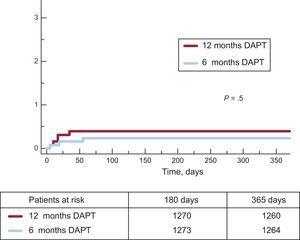
Incidence cumulative de thrombose de stent définie dans les deux groupes. DAPT: thérapie antiplaquettaire double.
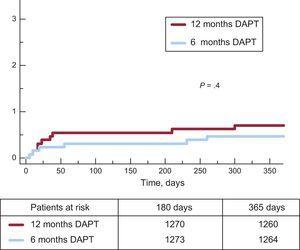
Incidence cumulative de thrombose d’endoprothèse certaine ou probable dans les deux groupes. DAPT, double thérapie antiplaquettaire.
Résultats de 6 à 12 Mois
| 6- mois DAPT (n = 1272)* | 12- mois DAPT (n = 1270)* | D | |
|---|---|---|---|
| Paramètre principal | |||
| Décès cardiaque, infarctus du myocarde, revascularisation ou saignement BARC ≥ 3 | 38 (2.9) | 54 (4.2) | .1 |
| Paramètres secondaires | |||
| Décès toutes causes confondues | 7 (0.55) | 8 (0.60) | .8 |
| Mort cardiaque | 3 (0.23) | 4 (0.31) | .8 |
| Infarctus du myocarde | 3 (0.23) | 5 (0.40) | .8 |
| Revascularisation | 32 (2.5) | 44 (3.5) | .2 |
| Thrombose définitive | 0 (0.0) | 0 (0.0) | |
| Thrombose définitive et probable | 2 (0.15) | 2 (0.15) | .9 |
| Événements hémorragiques BARC ≥ 3 | 2 (0.15) | 5 (0.40) | .5 |
BARC, Consortium de recherche académique sur les saignements; DAPT, thérapie antiplaquettaire double.
Les données sont exprimées en No. (%).
Nombre de patients vivants à 6 mois de suivi.
Les analyses de sous-groupes n’ont révélé aucune interaction significative. Il convient de noter que dans le sous-groupe de patients avec ou sans infarctus du myocarde en élévation du segment ST, qui comprenait 15% des patients du groupe DAPT à 6 mois et 16,2% du groupe DAPT à 12 mois, le critère d’évaluation principal a été atteint dans 7,7% et 8,1%, respectivement (P =.8).
DISCUSSION
Les résultats de cette étude suggèrent que, chez des patients sélectionnés (représentant environ 40% des patients traités par DES), un traitement DAPT de 6 mois semble être aussi sûr qu’un traitement DAPT de 12 mois du point de vue des taux d’événements ischémiques.
L’utilisation de DES réduit considérablement le besoin de revascularisation coronaire répétée. Les DES de nouvelle génération, en particulier les stents à élution de l’évérolimus, sont liés à des réductions des taux de thrombose par rapport aux DES de première génération, voire aux BMS.3-7 Par conséquent, une limitation majeure pour l’utilisation du DES réside dans la nécessité d’un traitement DAPT à plus long terme par opposition au traitement DAPT de 1 mois après l’implantation du SMB. Le DAPT à long terme est associé à un risque de saignement plus élevé et à un coût plus élevé. Ces limitations expliquent pourquoi, dans certains contextes sans restrictions apparentes sur l’utilisation du DES, jusqu’à 15% à 20% des patients semblent ne pas bénéficier du DES, en particulier parmi la population âgée.
Plusieurs essais ont comparé une courte période de 3 à 6 mois à une période plus longue de 12 à 24 mois.10-16 Une analyse groupée des 4 premiers essais a publié des preuves de l’absence de différence significative dans les événements ischémiques entre les périodes plus courtes et les périodes plus longues, mais l’incidence des saignements était plus élevée pendant la période plus longue.17 Trois essais supplémentaires portant sur des périodes DAPT courtes et longues ont été présentés très récemment.14-16 L’essai de sécurité14 a comparé le DAPT à 6 mois et à 12 mois chez 1399 patients à faible risque traités par DES DE deuxième génération dans un angor stable ou instable (l’infarctus comme indication d’intervention coronarienne percutanée a été exclu). Aucune différence n’a été observée pour aucun des critères cliniques à 12 mois. La principale limitation était la taille de l’échantillon, la faible observance du protocole (34% des patients affectés à 6 mois ont poursuivi la DAPT après 6 mois) et l’inclusion de patients anatomiquement à faible risque. Dans l’essai ITALIC, 15 1894 patients présentant une non-résistance démontrée à l’acide acétylsalicylique ont été randomisés en DAPT de 6 mois vs 24 mois après l’implantation d’un Xience®. stent. Aucune différence n’a été trouvée pour aucun des critères cliniques, y compris les complications hémorragiques. Enfin, l’essai ISAR-SAFE, 16 qui n’a pas encore été publié, devait recruter 6000 patients mais a été interrompu après l’inclusion de 4000 patients. Ceux-ci ont été randomisés à 6 mois ou 12 mois après l’implantation de DES (89% de nouvelle génération). Encore une fois, aucune différence n’a été observée dans aucun des critères d’efficacité ou d’innocuité.
Cependant, ces études présentent certaines limites. Étant des essais cliniques, leur représentativité clinique est limitée, le respect du protocole était insuffisant, 10, 14 DES de première génération ont été utilisés, 10, 11, 16 ainsi que le BMS, 10 une résistance à l’acide acétylsalicylique a été pré-testée, 15 et la première version de stents à élution du zotarolimus, avec une perte tardive de lumière proche de celle du BMS, a été largement ou même exclusivement utilisée.10,12,13
Le grand essai DAPT25 a évalué une période de DAPT de plus de 12 mois après l’implantation du DES. Dans cette étude, les patients ayant une période de 12 mois sans incident après une intervention coronarienne percutanée ont été randomisés pour arrêter le DAPT à ce moment-là ou pour une période prolongée de DAPT (jusqu’à 30 mois). Les patients traités avec des DES de première et de deuxième génération ont été inclus. La période DAPT plus longue (30 mois) a entraîné une diminution des effets indésirables cardiaques, mais une augmentation des saignements par rapport à la période de 12 mois. Cependant, le type de DES a atteint l’interaction pour le point final (rapport de risque = 0,52 pour le stent à élution du paclitaxel et rapport de risque = 0.89 pour le stent à élution de l’évérolimus avec P =.048 pour l’interaction).
Les registres cliniques évaluant le risque de thrombose après un retrait précoce du DAPT sont également limités par leur conception rétrospective.8,9 Divers biais sont notables, car l’arrêt du traitement aurait pu être décidé après un examen attentif du risque de thrombose. Il y a un manque de grands registres prospectifs provenant de la pratique réelle évaluant des périodes DAPT plus courtes.
Enfin, une caractéristique importante limitant l’applicabilité d’un régime de DAPT à plus court terme est que les patients dans le cadre d’un événement coronarien instable (la plupart des patients subissant une intervention coronarienne percutanée de nos jours) bénéficient d’une période de DAPT de 12 mois par rapport à une période de traitement de 1 mois.18,19 Cependant, nous ne savons pas si ce bénéfice est maintenu lorsqu’un régime de 12 mois est comparé à un régime de 6 mois. Par conséquent, la discussion reste ouverte et des essais prospectifs et / ou des registres conçus de manière appropriée utilisant des DES de la génération actuelle sont justifiés.
Suite à ces considérations, nous avons cherché à concevoir ce registre ESTROFA-DAPT prospectif multicentrique évaluant un régime DAPT de 6 mois. Les critères d’inclusion ont été sélectionnés pour inclure principalement les patients atteints d’une maladie coronarienne stable. En ce qui concerne les patients instables, nous n’avons inclus que ceux présentant un angor instable et aucune augmentation des marqueurs cardiaques. Nous avons également inclus des patients présentant un infarctus du myocarde en élévation de segment ST ou un infarctus du myocarde en élévation de segment non ST avec un risque de saignement qui n’éliminait pas nécessairement le besoin de DES en faveur d’une option BMS. Plusieurs scores de risque de saignement à l’hôpital sont disponibles pour une utilisation chez les patients atteints d’ACS, mais ces algorithmes n’ont pas été conçus ou normalisés pour prédire le risque de saignement dans le cadre d’un DAPT à long terme. Par conséquent, cette décision a été laissée à la discrétion des enquêteurs pour examiner l’équilibre entre la resténose et le risque de saignement. En ce qui concerne la procédure, les patients avec des endoprothèses pour lésions coronaires principales gauches, ainsi que les bifurcations traitées avec une stratégie à 2 endoprothèses ou les patients nécessitant plus de 3 endoprothèses ont été exclus, étant donné le risque considérablement plus élevé de thrombose du stent dans ces cas10.
Pour pouvoir comparer efficacement les résultats de notre série de cohortes DAPT de 6 mois par rapport à 12 mois, nous avons utilisé la cohorte DAPT de 12 mois de la base de données de l’étude ESTROFA-2.22 Ce registre publié précédemment comprenait 4768 patients inscrits de manière prospective traités par DES DE deuxième génération et, parmi eux, 4354 (91%) traités par un traitement DAPT de 12 mois selon les directives en vigueur à ce moment-là.
Deux étapes ont été suivies pour obtenir des séries comparables de patients à partir de ces registres. Tout d’abord, les patients d’ESTROFA-2 présentant des critères d’exclusion d’ESTROFA-DAPT ont été exclus (en particulier ceux présentant des lésions coronaires principales gauche traitées, des bifurcations traitées avec 2 stents, des patients avec plus de 3 stents implantés et ceux ayant des antécédents de thrombose tardive DES). Deuxièmement, un processus d’appariement des scores de propension a été mené.
Enfin, 2 groupes comparables pour toutes les caractéristiques cliniques et procédurales ont été inclus dans l’analyse des résultats. Seuls les DES non de première génération ont été inclus dans les deux registres avec une proportion similaire pour les stents à élution de l’évérolimus. Cependant, le modèle de stent à élution du zotarolimus différait, Endeavor® étant utilisé dans le DAPT à 12 mois (ESTROFA-2) et Resolute® dans le DAPT à 6 mois (ESTROFA-DAPT). Le stent Endeavor®, la première version du stent à élution du zotarolimus, a montré une perte de lumière tardive proche de celle du BMS (0,6 mm) alors que le stent Resolute® a montré une perte de lumière tardive d’environ 0,15 mm. En fait, les essais de RÉINITIALISATION et d’OPTIMISATION n’ont trouvé aucune différence entre le DAPT de 3 mois et de 12 mois avec l’utilisation du stent Endeavor®.12,13 Par conséquent, ce facteur différentiel aurait pu influencer négativement les résultats dans le groupe DAPT à 6 mois, mais cela ne semble pas avoir été le cas. Par conséquent, cette différence appuie les résultats de l’approche DAPT à 6 mois.
Limites
Une limitation importante de notre étude est l’absence de randomisation. Les registres posent le problème du biais secondaire à des facteurs de confusion connus et inconnus qui ne sont pas toujours pris en compte après un ajustement statistique minutieux avec des analyses appariées telles que le score de propension.
Néanmoins, bien que les essais randomisés soient la conception la plus appropriée pour comparer les traitements, les registres restent une source importante de connaissances et d’informations compte tenu des mises en garde bien reconnues des essais randomisés, telles que la taille des échantillons limitant les coûts, l’inclusion restrictive au-delà des critères d’exclusion, la recherche non indépendante ou l’absence de gestion et de suivi des patients « en pratique réelle ».
Une deuxième limite est la taille relativement petite de l’échantillon de divers sous-groupes, en particulier le sous-groupe ACS, qui ne permet pas de tirer des conclusions fermes concernant la sécurité à court terme du DAPT dans ces contextes. Une autre limitation est la nature de la sélection des patients. Comme décrit dans les « Méthodes », l’étude était principalement axée sur la sécurité. Les sous-groupes présentant un bénéfice démontré après 12 mois de DAPT (patients atteints de SCA sans risque hémorragique élevé)18,19 et ceux présentant un risque plus élevé de thrombose et présentant une tendance au bénéfice sur une DAPT plus longue dans les essais ont été systématiquement exclus.10
Une considération importante est les différentes périodes de recrutement dans les deux registres. Cependant, l’influence potentielle de cet écart de temps aurait pu être atténuée par les facteurs suivants: a) Seuls les DES de nouvelle génération ont été utilisés dans les deux registres; b) Seuls les patients traités par le clopidogrel ont été inclus dans l’analyse. Dans le registre ESTROFA-DAPT plus récent, les patients n’ont pas été traités par de nouveaux agents antiplaquettaires par protocole, sur la base des critères d’inclusion (patients dans des conditions cliniques stables ou après un SCA mais avec un risque de saignement modérément élevé); c) La méthodologie des deux registres était assez similaire, comme mentionné précédemment dans la section » Méthodes « .
CONCLUSIONS
Une période de DAPT de 6 mois suivant l’implantation d’un DES de nouvelle génération semble être non inférieure à un régime de DAPT de 12 mois dans les contextes cliniques et angiographiques évalués dans cette étude multicentrique.
FINANCEMENT
Cette étude a été financée par le Groupe de Travail Espagnol sur la Cardiologie Interventionnelle pour les Formulaires de Déclaration de cas en ligne (CRF) de la Société Espagnole de Cardiologie.
CONFLITS D’INTÉRÊTS
Aucun déclaré.