Oltre al trattamento delle proteine, ER e Golgi si occupano anche di alcuni tipi di trasporto delle proteine. Le vescicole (bolle legate alla membrana, essenzialmente) si staccano dall’ER, dal Golgi e da altri organelli membranosi, portando con sé qualsiasi molecola solubile fosse all’interno del fluido che era racchiuso e qualsiasi molecola incorporata in quella sezione di membrana. Queste vescicole prendono poi un giro su un motore molecolare come la chinesina o la miosina e viaggiano lungo il citoscheletro fino a quando non attraccano alla destinazione appropriata e si fondono con la membrana o l’organello bersaglio. In generale, le vescicole si spostano dall’ER al cis Golgi, dal cis al Golgi mediale, dal mediale al Golgi trans e dal Golgi trans alla membrana plasmatica o ad altri compartimenti. Sebbene la maggior parte del movimento sia in questa direzione, ci sono anche vescicole che si spostano indietro dal Golgi al pronto soccorso, trasportando proteine che avrebbero dovuto rimanere nel pronto soccorso (ad es. PDI) e sono stati accidentalmente raccolti all’interno di una vescicola.
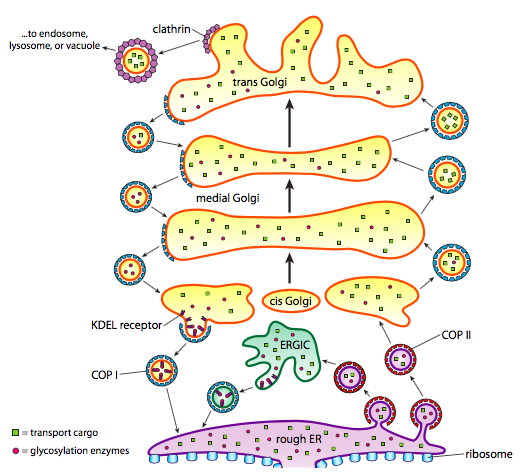
La formazione delle vescicole dipende dalle proteine del mantello che, in condizioni adeguate, si autoassembleranno in gabbie sferiche. Quando associati con proteine transmembrana, possono tirare la membrana allegata lungo in una forma sferica anche. I principali tipi di proteine di rivestimento utilizzati nella formazione delle vescicole sono COPII, COPI e clatrina.
Le proteine COPII coat formano le vescicole che si spostano da ER a Golgi. Le proteine COPI coat vengono utilizzate tra le parti dell’apparato del Golgi e per formare vescicole che vanno dal Golgi al pronto soccorso. Infine, la clatrina viene utilizzata per formare vescicole che lasciano il Golgi per la membrana plasmatica e per le vescicole formate dalla membrana plasmatica per l’endocitosi.
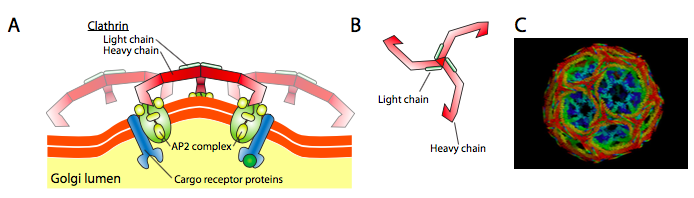
Clathrin (Figura \(\PageIndex{17}\)) è la migliore delle tre, e le mani vescicolari sono fatte da accordi di triskelioni clathrin (dal greco, che significa tre zampe). Ogni triskelion è composto da tre catene pesanti unite insieme al terminale C e tre catene leggere, una associata a ciascuna catena pesante. Le catene pesanti di diversi triskelions interagiscono lungo la lunghezza delle loro pesanti “gambe” a catena per creare un costrutto molto robusto. Le catene leggere non sono necessarie per la formazione di vescicole e si pensa che aiutino a prevenire interazioni accidentali di molecole di clatrina nel citoplasma.
C’è una somiglianza significativa tra i meccanismi di formazione delle vescicole che utilizzano queste diverse proteine del mantello, a cominciare dal reclutamento di ARF1 (ARF sta per fattore di ribosilazione ADP, che non ha nulla a che fare con la sua funzione qui) alla membrana. Ciò richiede lo scambio facilitato da ARNO di un GTP per GDP (ARNO è l’apertura del sito di legame nucleotidico ARF). Una volta che ARF1 ha legato GTP, il cambiamento conformazionale rivela un gruppo miristoil N-terminale che si inserisce nella membrana. Sia COPI che le vescicole rivestite di clatrina utilizzano ARF1 e ARNO, ma COPII utilizza proteine simili chiamate Sar1p e Sec12p.
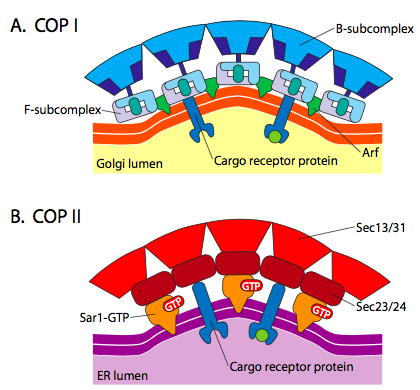
Figura \(\PageIndex{18}\). Vescicole COP-rivestite
L’ARF1 (o Sar1p) è usato per reclutare le proteine dell’adattatore che legano all’estremità “della coda” delle proteine del ricevitore membrana-legate. L’estremità di affari di questi ricevitori lega alle molecole di auto – va che devono essere imballate nella vescicola. Le proteine dell’adattatore fungono da collegamento tra la membrana (attraverso i recettori) e le proteine del mantello. Per la clatrina, le proteine adattatori sono AP1 per vescicole derivate da trans-Golgi e AP2 per vescicole endocitiche. Per le vescicole COPI, gli omologhi approssimativi sono i β-, γ-, δ – e ζ – COP mentre il sistema COPII utilizza Sec23p e Sec24p.
Infine, gli adattatori si collegano alle proteine di rivestimento effettive: clatrina, α – o ε-COP, Sec13p e Sec31p. Ciò che queste proteine hanno tutte in comune è che spontaneamente (cioè senza alcun requisito di dispendio energetico), si autoassemblano in strutture sferiche simili a gabbie. Sotto il microscopio elettronico, le vescicole rivestite di clatrina sono più definite e le forme esagonali e pentagonali delimitate dalle subunità di clatrina conferiscono alla vescicola un aspetto “da calcio”. COP coatamer-vescicole rivestite sono molto più fuzzier in apparenza sotto EM.
Tutti e tre i tipi di proteine del rivestimento vescicolare hanno la capacità di associarsi spontaneamente in un costrutto sferico, ma solo la vescicola rivestita COPI e COPII “pizzica” spontaneamente la membrana per rilasciare la vescicola dalla sua membrana originaria. Le vescicole rivestite di clatrina richiedono un meccanismo esterno per rilasciare la vescicola (Figura \ (\PageIndex{19}\)).
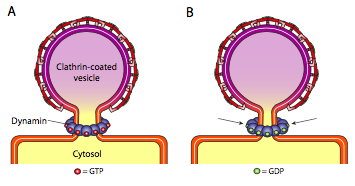
Una volta che la vescicola è quasi completata, c’è ancora un piccolo gambo o collo di membrana che collega la vescicola alla membrana. Intorno a questo gambo, le molecole GTP dinamiche si aggregano in una costruzione ad anello / spirale. Le molecole di dinamina sono GTPASI globulari che si contraggono dopo l’idrolisi del GTP. Quando si associano intorno al gambo della vescicola, ogni proteina dynamin si contrae, con l’effetto combinato di restringere il gambo abbastanza che la membrana pizzica insieme, sigillando e rilasciando la vescicola dalla membrana originaria.
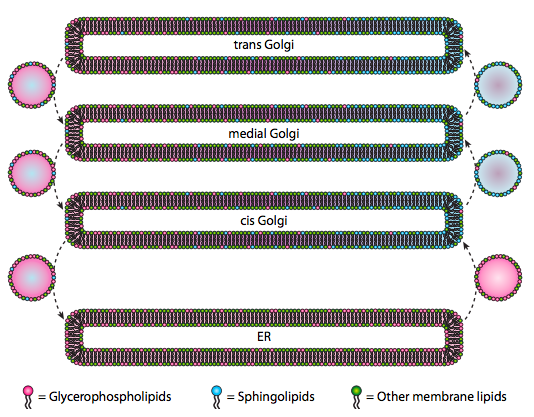
Sebbene i lipidi e le membrane siano stati discussi nel capitolo 4, abbiamo trascurato di discutere la posizione delle loro sintesi negli eucarioti. Come indica la figura \ (\PageIndex{20}\), la sintesi di alcuni tipi di lipidi è segregata ed esclusiva. I glicerofosfolipidi si formano principalmente nel reticolo endoplasmatico, sebbene siano fatti anche nei mitocondri e nei perossisomi. Al contrario, gli sfingolipidi non sono prodotti nell’ER (sebbene i loro precursori di ceramide siano) nei mammiferi, gli enzimi necessari si trovano nel lume del cis e del Golgi mediale. Vi è evidenza di traffico vescicolare anterograda e retrograda tra i vari compartimenti di Golgi e ER, il che indicherebbe teoricamente una ridistribuzione dei tipi lipidici. Tuttavia, gli sfingolipidi tendono ad aggregarsi in zattere lipidiche e sembrano essere più concentrati nelle vescicole in movimento anterograda.
Le proteine del mantello si staccano poco dopo il rilascio vescicolare. Per la clatrina, il processo coinvolge Hsc70, un’ATPasi. Tuttavia, per le vescicole ricoperte COPI o COPII, l’idrolisi del GTP su ARF / Sar1p sembra indebolire l’affinità della proteina del rivestimento per gli adattatori e avvia lo svolgimento. L’attivatore GTPase è ARF GAP (o Sec23p) ed è parte integrante del cappotto COP I (o II).
Le vescicole trasportano due categorie di carico: proteine solubili e proteine transmembrana. Delle proteine solubili, alcune sono assorbite nella vescicola in virtù di essere legate a un recettore. Altre proteine appena capita di essere nelle vicinanze e sono raccolte come le forme della vescicola. Occasionalmente, viene assorbita una proteina che non doveva essere; ad esempio, la PDI può essere racchiusa in una vescicola che si forma dal pronto soccorso. Ha poca funzione nel Golgi, ed è necessario nel pronto soccorso, quindi cosa succede ad esso? Fortunatamente, PDI e molte altre proteine ER hanno una sequenza di segnale C-terminale, KDEL (Acido lisina-aspartico-Acido glutammico-Leucina), che urla “Appartengo al pronto soccorso.”Questa sequenza è riconosciuta dai recettori KDEL all’interno del Golgi, e il legame delle proteine KDEL ai recettori innesca la formazione di vescicole per rimandarle al pronto soccorso.
Le vescicole secretorie hanno un problema speciale con il carico solubile. Se la vescicola dovesse fare affidamento semplicemente sull’inclusione di proteine all’interno di essa durante il processo di formazione, sarebbe difficile ottenere alte concentrazioni di tali proteine. Molte proteine secrete sono necessarie all’organismo rapidamente e in quantità significative, quindi c’è un meccanismo nel trans Golgi per aggregare le proteine secretorie. Il meccanismo utilizza proteine aggreganti come secretogranina II e cromogranina B che riuniscono le proteine bersaglio in grandi granuli concentrati. Queste granine funzionano meglio nell’ambiente trans Golgi di basso pH e alto Ca2+, quindi quando la vescicola rilascia il suo contenuto al di fuori della cellula, il pH più alto e il Ca2+ più basso rompono gli aggregati per rilasciare le singole proteine.
Durante la maturazione del Golgi si verifica un consistente cambiamento di pH, cosicché andando da ER a Golgi, ogni compartimento presenta un pH lumenale progressivamente più basso (più acido).
Infine, c’è la questione del targeting delle vescicole. Le vescicole sono molto meno utili se vengono gettate su un treno merci molecolare e lasciate a caso. Pertanto, esiste un meccanismo di aggancio che richiede una corrispondenza della proteina v-RULLANTE sulla superficie citoplasmatica della vescicola e del t-RULLANTE sulla superficie citoplasmatica della membrana bersaglio. La fusione della vescicola alla membrana procede solo se c’è una corrispondenza. Altrimenti, la vescicola non può fondersi e si attaccherà a un altro motore molecolare per dirigersi verso un’altra destinazione, si spera corretta. Questo processo è aiutato da proteine di tethering che inizialmente entrano in contatto con una vescicola in arrivo e la avvicinano abbastanza al bersaglio per testare l’interazione proteica del RULLANTE. Altre proteine sulla vescicola e sulle membrane bersaglio interagiscono e, se le insidie corrispondono, possono aiutare a “arginare” la vescicola nella membrana bersaglio, dopo di che le membrane si fondono. Un’importante regola empirica per comprendere la fusione vescicolare e anche la direzionalità delle proteine di membrana e dei lipidi, è che il lato rivolto verso il citoplasma di una membrana sarà sempre rivolto verso il citoplasma. Pertanto una proteina che alla fine si trova sulla superficie esterna della membrana cellulare sarà stata inserita nella superficie lumenale della membrana ER per cominciare.
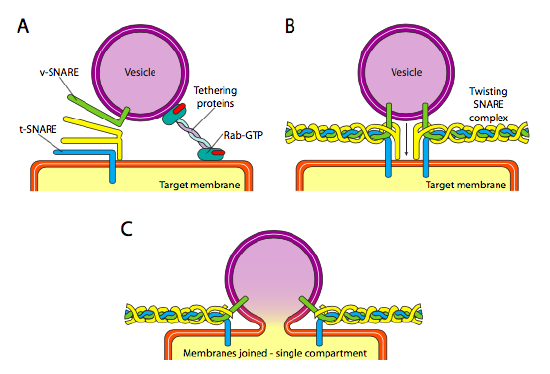
Più specificamente, mentre una vescicola si avvicina alla membrana bersaglio, la proteina tethering Rab-GTP, che è collegata alla membrana bersaglio tramite una doppia coda lipidica geranilgeranil, si associa vagamente alla vescicola e la tiene in prossimità della membrana bersaglio per dare alle INSIDIE la possibilità di funzionare. I v-SNAREs e t-SNAREs ora hanno l’opportunità di interagire e testare per una partita. Recentemente, le insidie sono state rinominate R-SNAREs e Q-SNAREs, rispettivamente, sulla base di residui di arginina e glutammina conservati. Oltre a questi due rullanti primari, almeno un altro RULLANTE è coinvolto, formando insieme un fascio di quattro α-eliche (quattro, non tre, perché almeno nell’esempio meglio studiato, uno dei rullanti è piegato in modo che due dei suoi domini alfa-elicoidali partecipino all’interazione. Le quattro eliche si avvolgono l’una intorno all’altra e si pensa che mentre lo fanno, tirano insieme la vescicola e la membrana bersaglio.
La tossina tetanica, tetanospasmina, che viene rilasciata dai batteri Clostridium tetani, provoca spasmi agendo sulle cellule nervose e prevenendo il rilascio di neurotrasmettitori. Il meccanismo per questo è che scinde la sinaptobrevina, una proteina RULLANTE, in modo che le vescicole sinaptiche non possano fondersi con la membrana cellulare. La tossina botulinica, da Clostridium botulinum, agisce anche sulle insidie per prevenire la fusione delle vescicole e il rilascio dei neurotrasmettitori, sebbene si rivolga a diversi neuroni e quindi abbia l’effetto opposto: il tetano è causato impedendo il rilascio di neurotrasmettitori inibitori, mentre il botulismo è causato impedendo il rilascio di neurotrasmettitori eccitatori.