Obiettivi di Apprendimento
- Definire o descrivere il seguente:
- metabolismo
- catabolico reazione
- anabolizzanti reazione
- enzima
- substrato
- apoenzyme
- haloenzyme
- cofattore (coenzima)
- Stato come gli enzimi sono in grado di accelerare la velocità delle reazioni chimiche.
- Descrivere brevemente una reazione enzima-substrato generalizzata, indicare la funzione del sito attivo di un enzima e descrivere come un enzima è in grado di accelerare le reazioni chimiche.
- Stato quattro caratteristiche degli enzimi.
- Stato come i seguenti influenzano la velocità di una reazione enzimatica.
- concentrazione enzimatica
- concentrazione del substrato
- temperatura
- pH
- concentrazione di sale
- Stato come sostanze chimiche come cloro, iodio, iodofori, mercuriali e ossido di etilene inibiscono o uccidono i batteri.
- Stato come alta temperatura e bassa temperatura esercitano il loro effetto sui batteri.
Per vivere, crescere e riprodursi, i microrganismi subiscono una varietà di cambiamenti chimici. Alterano i nutrienti in modo che possano entrare nella cellula e li cambiano una volta entrati per sintetizzare le parti cellulari e ottenere energia. Il metabolismo si riferisce a tutte le reazioni chimiche organizzate in una cellula. Le reazioni in cui i composti chimici sono ripartiti sono chiamate reazioni cataboliche mentre le reazioni in cui i composti chimici sono sintetizzati sono chiamate reazioni anaboliche. Tutte queste reazioni sono sotto il controllo degli enzimi.

Gli enzimi sono sostanze presenti nella cellula in piccole quantità che funzionano per accelerare o catalizzare reazioni chimiche. Sulla superficie dell’enzima è solitamente una piccola fessura che funziona come un sito attivo o sito catalitico a cui uno o due substrati specifici sono in grado di legarsi. (Tutto ciò che un enzima normalmente combina con è chiamato substrato.) Il legame del substrato con l’enzima fa sì che l’enzima flessibile cambi leggermente la sua forma attraverso un processo chiamato adattamento indotto per formare un intermedio tempore chiamato complesso enzima-substrato (Figura \ (\PageIndex{1}\)).
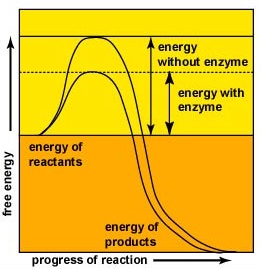
Gli enzimi accelerano la velocità delle reazioni chimiche perché riducono l’energia di attivazione, l’energia che deve essere fornita affinché le molecole reagiscano l’una con l’altra (Figura \(\PageIndex{2}\)). Gli enzimi riducono l’energia di attivazione formando un complesso enzima-substrato che consente di formare e rilasciare i prodotti della reazione enzimatica (Figura \(\PageIndex{3}\)).
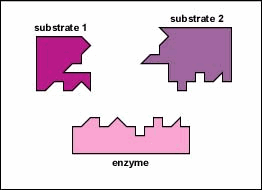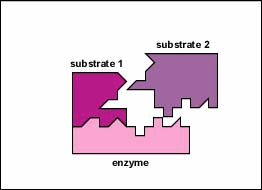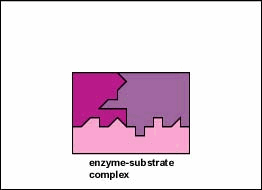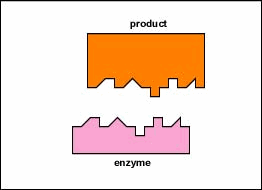
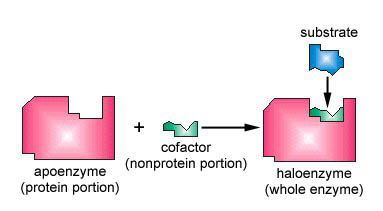
Molti enzimi richiedono un cofattore non proteico per aiutarli nella loro reazione. In questo caso, la porzione proteica dell’enzima, chiamata apoenzima, si combina con il cofattore per formare l’intero enzima o aloenzima (Figura \(\PageIndex{3}\)). Alcuni cofattori sono ioni come Ca++, Mg++ e K+; altri cofattori sono molecole organiche chiamate coenzimi che fungono da vettori per gruppi chimici o elettroni. NAD+, NADP+, FAD e coenzima A (CoA) sono esempi di coenzimi.
Caratteristiche degli enzimi
Chimicamente, gli enzimi sono generalmente proteine globulari. (Alcune molecole di RNA chiamate ribozimi possono anche essere enzimi. Questi si trovano solitamente nella regione nucleare delle cellule e catalizzano la scissione delle molecole di RNA). Gli enzimi sono catalizzatori che scompongono o sintetizzano composti chimici più complessi. Permettono che le reazioni chimiche avvengano abbastanza velocemente sostenere la vita. Gli enzimi accelerano la velocità delle reazioni chimiche perché abbassano l’energia di attivazione, l’energia che deve essere fornita affinché le molecole reagiscano l’una con l’altra. Tutto ciò che un enzima normalmente combina con è chiamato substrato. Gli enzimi sono molto efficienti. Un enzima generalmente può tipicamente catalizzare tra 1 e 10.000 molecole di substrato al secondo. Gli enzimi sono presenti solo in piccole quantità nella cellula poiché non vengono alterati durante le loro reazioni. e sono altamente specifici per il loro substrato. Generalmente c’è un enzima specifico per ogni reazione chimica specifica.
Attività enzimatica
L’attività enzimatica è influenzata da una serie di fattori, tra cui:
- La concentrazione di enzima: Supponendo che sia disponibile una concentrazione sufficiente di substrato, l’aumento della concentrazione enzimatica aumenterà la velocità di reazione enzimatica.
- La concentrazione del substrato: a una concentrazione enzimatica costante e a concentrazioni inferiori di substrati, la concentrazione del substrato è il fattore limitante. All’aumentare della concentrazione del substrato, aumenta la velocità di reazione enzimatica. Tuttavia, a concentrazioni di substrato molto elevate, gli enzimi si saturano di substrato e una maggiore concentrazione di substrato non aumenta la velocità di reazione.
- La temperatura: Ogni enzima ha una temperatura ottimale alla quale funziona meglio. Una temperatura più elevata provoca generalmente un aumento dell’attività enzimatica. All’aumentare della temperatura, aumenta il movimento molecolare con conseguente più collisioni molecolari. Se, tuttavia, la temperatura supera un certo punto, il calore denaturerà l’enzima, facendolo perdere la sua forma funzionale tridimensionale denaturando i suoi legami idrogeno. La temperatura fredda, d’altra parte, rallenta l’attività enzimatica diminuendo il movimento molecolare.
- Il pH: Ogni enzima ha un pH ottimale che aiuta a mantenere la sua forma tridimensionale. I cambiamenti nel pH possono denaturare gli enzimi alterando la carica dell’enzima. Questo altera i legami ionici dell’enzima che contribuiscono alla sua forma funzionale.
- La concentrazione salina: Ogni enzima ha una concentrazione salina ottimale. I cambiamenti nella concentrazione di sale possono anche denaturare gli enzimi.
Alcune relazioni tra enzimi batterici e l’uso di disinfettanti e temperature estreme per controllare i batteri.
- Molti disinfettanti, come cloro, iodio, iodofori, mercuriali, nitrato d’argento, formaldeide e ossido di etilene, inattivano gli enzimi batterici e quindi bloccano il metabolismo.
- Alte temperature, come autoclave, bollitura e pastorizzazione, denatura di proteine ed enzimi.
- Le temperature fredde, come la refrigerazione e il congelamento, rallentano o fermano le reazioni enzimatiche.
Sommario
- Gli enzimi sono sostanze presenti nella cellula in piccole quantità che funzionano per accelerare o catalizzare le reazioni chimiche in modo che si verifichino abbastanza velocemente per sostenere la vita.
- Sulla superficie dell’enzima è tipicamente una piccola fessura che funziona come un sito attivo o sito catalitico a cui uno o due substrati specifici sono in grado di legarsi.
- Tutto ciò con cui un enzima normalmente si combina è chiamato substrato.
- Il legame del substrato con l’enzima fa sì che l’enzima flessibile cambi leggermente la sua forma attraverso un processo chiamato adattamento indotto per formare un intermedio temporaneo chiamato complesso enzima-substrato.
- Gli enzimi accelerano la velocità delle reazioni chimiche perché abbassano l’energia di attivazione, l’energia che deve essere fornita affinché le molecole reagiscano l’una con l’altra.
- Molti enzimi richiedono un cofattore non proteico per aiutarli nella loro reazione. In questo caso, la porzione proteica dell’enzima, chiamata apoenzima, si combina con il cofattore per formare l’intero enzima o aloenzima.
- Alcuni cofattori sono ioni come Ca++, Mg++ e K+; altri cofattori sono molecole organiche chiamate coenzimi che fungono da vettori per gruppi chimici o elettroni. NAD+, NADP+, FAD e coenzima A (CoA) sono esempi di coenzimi.
- Chimicamente, gli enzimi sono generalmente proteine globulari. Alcune molecole di RNA chiamate ribozimi possono anche essere enzimi, di solito funzionanti per fendere le molecole di RNA.
- Gli enzimi sono presenti solo in piccole quantità nella cellula poiché non vengono alterati durante le loro reazioni e sono altamente specifici per il loro substrato.
- L’attività enzimatica è influenzata da una serie di fattori tra cui la concentrazione dell’enzima, la concentrazione del substrato, la temperatura, il pH e la concentrazione di sale.
Collaboratori e attribuzioni
-
Il nostro sito utilizza cookie tecnici e di terze parti .)