DISCUSSIONE
Abbiamo determinato qui le dimensioni del genoma di 25 specie di chironomidi; questi valori erano congruenti con le dimensioni del genoma delle tre specie precedentemente segnalate in letteratura (Petitpierre, 1996; Schmidt-Ott et al., 2009), che erano compresi tra 0,13 e 0,21 pg DNA. I risultati di questo studio hanno mostrato che le dimensioni del genoma dei chironomidi erano uniformemente molto piccole (Fig. 3, Tabella 1). Il valore C medio ottenuto per la famiglia Chironomidae è 0,13 + 0.03 DNA pg, che è chiaramente più piccolo di D. melanogaster dimensione del genoma. La dimensione del genoma più piccola tra gli insetti è stata registrata nella Strepsiptera Caenocholax fenyesi con circa 0,11 pg DNA (corrispondente approssimativamente a 108 Mb), anche se la mosca di Iuta Mayetiola destructor è stata anche suggerita per avere una dimensione del genoma ancora più piccola di 0,09 pg (Johnston et al., 2004; Gregory, 2014). Qui riportiamo almeno tre specie con genomi più piccoli di qualsiasi insetto conosciuto: C. tsushimensis, Diamesa japonica e Hydrobaenus tsukubalatus, con valori C di 0,07 pg, 0,08 pg e 0,08 pg, rispettivamente (Tabella 1). A nostra conoscenza, C. tsushimensis (Fig. 1B) può ora essere considerato come avere la dimensione del genoma più piccola di qualsiasi insetto conosciuto, con un valore C di 0,07 pg DNA, corrispondente approssimativamente a 68 Mb. Questo valore è congruente con la dimensione del genoma di una specie affine, Clunio marinus, che è stata stimata una volta a 95 Mb e più recentemente a 87,2 Mb (Kaiser e Heckel, 2012; Tobias S. Kaiser, comunicazione personale).
Recentemente, il genoma del moscerino antartico, B. antarctica, è stato sequenziato (Kelley et al., 2014). Gli autori hanno affermato che la dimensione del genoma di questa specie, stimata a 89.5-105 Mb, era il più piccolo tra tutti gli insetti. Tuttavia, mostriamo qui che questa dimensione del genoma è compresa nell’intervallo normale dei valori dei chironomidi. Gli autori hanno anche suggerito che la piccola dimensione del genoma di B. Antartide era un adattamento all’ambiente freddo estremo. I nostri dati possono corroborare questa ipotesi, dal momento che D. japonica, una specie alpina della sottofamiglia Diamesinae presenta anche una piccola dimensione del genoma. Un altro Diamesinae correlato, il moscerino himalayano Diamesa sp. è stato effettivamente trovato attivo a temperature fino a -16°C (Kohshima, 1984). Tuttavia, Telmatogeton japonicus, che è anche in grado di svilupparsi a temperature molto basse (Danks, 1971; Sunose e Fujisawa, 1982), mostra una dimensione del genoma relativamente grande, rispetto alla media della famiglia dei chironomidi. Un’influenza filogenetica sulla dimensione del genoma dovrebbe essere presa in considerazione qui, poiché B. antarctica appartiene alla sottofamiglia Orthocladiinae, che presenta in media piccole dimensioni del genoma. Le specie C. tsushimensis e Hydrobaenus tsukubalatus, che mostrano le dimensioni del genoma più piccole tra i chironomidi, appartengono anche alla sottofamiglia Orthocladiinae. Così, la piccola dimensione del genoma di B. l’Antartide può semplicemente costituire un tratto ancestrale, non il risultato di un estremo adattamento al freddo.
P. vanderplanki è l’unica specie di insetti nota per raggiungere l’anidrobiosi in uno stato completamente disidratato (Fig. 1D) e recuperare dopo la reidratazione (Hinton, 1951, 1960a; Watanabe, 2006; Cornette e Kikawada, 2011). Il nostro gruppo di ricerca ha recentemente pubblicato un’analisi comparativa delle sequenze genomiche del Polypedilum vanderplanki tollerante all’essiccazione e del Polypedilum nubifer congenerico sensibile all’essiccazione (Gusev et al., 2014). Il confronto ha mostrato che entrambe le specie avevano dimensioni del genoma simili e che solo un insieme limitato di cluster di geni duplicati era correlato all’anidrobiosi in P. vanderplanki (Gusev et al., 2014). Le dimensioni del genoma dedotte dall’assemblaggio del genoma erano 104 Mb per P. vanderplanki e 107 Mb per P. nubifer e questi valori non differivano notevolmente dalle dimensioni del genoma misurate per queste specie nel presente studio, che corrispondevano a circa 98 Mb. P. vanderplanki e P. genomi nubifer hanno mostrato una simile bassa percentuale di ripetizioni di DNA e solo un piccolo numero di elementi trasponibili sono stati trovati, rispetto ad altre specie dipteran. Questa riduzione della proporzione di elementi trasponibili è stata osservata anche nel moscerino antartico, B. antarctica (Kelley et al., 2014). La lunghezza media dell’introne è stata notevolmente ridotta anche nel moscerino antartico e sia in P. vanderplanki che in P. nubifer (Gusev et al., 2014). Dal momento che l’essiccazione sensibile e congelare intollerante P. nubifer condivide queste caratteristiche con il moscerino antartico e il moscerino anidrobiotico, una bassa percentuale di elementi trasponibili e una breve lunghezza dell’introne possono costituire una caratteristica condivisa da tutti i chironomidi e possono non essere direttamente correlati alla tolleranza agli ambienti estremi, anche se non si può escludere un effetto adattativo.
Fig. 3.
Filogenesi dei ditteri che mostrano valori C stimati. La famiglia dei Chironomidi è mostrata in nero. La linea dash mostra la dimensione del genoma di D. melanogaster. Il cladogramma filogenetico è un consenso da diversi chironomidi e dipterani alberi (Yeates e Wiegmann, 1999, 2005; Saether, 2000; Cranston et al., 2012). Errori barre mostrano deviazione standard. Le dimensioni del genoma senza barre di errore sono state ottenute da studi precedenti elencati nel database delle dimensioni del genoma animale (Gregory, 2014).
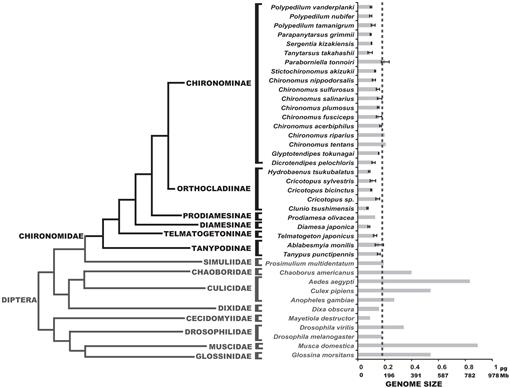
Fig. 4.
Relazione tra dimensione corporea e dimensione del genoma tra le specie di chironomidi studiate nel presente studio. A) Per ciascuna specie, la lunghezza totale media del corpo è espressa in millimetri e il valore C medio è espresso in DNA pg. Solo una debole correlazione positiva (r2 = 0,171, n = 25), materializzata da una linea continua, è stata osservata tra le due variabili. (B) A livello di genere, i mezzi degli stessi valori sono stati trasformati dal metodo dei contrasti filogeneticamente indipendenti, basato sulla filogenesi di Cranston et al. (2012). La correlazione tra questi contrasti trasformati, materializzati da una linea continua, non era significativa (r2 = 0,118, n = 13). L’analisi dei dati è stata eseguita su Prism 4.0 software per Macintosh (GraphPad Software, Inc.).

Quali potrebbero essere i tratti adattivi potenzialmente associati alle minuscole dimensioni del genoma tra la famiglia Chironomidae? Infatti, diversi fattori di sviluppo ed ecologici sono stati suggeriti per correlare alle dimensioni del genoma. Innanzitutto, una correlazione positiva tra dimensione del genoma e dimensione corporea è stata trovata in molti taxa e questa correlazione appare come un fenomeno relativamente generale (Gregory, 2005). Questa correlazione è stata riportata anche nelle zanzare (Ferrari e Rai, 1989), ma non è sempre chiara in altri taxa di insetti (Gregory e Hebert, 2003; Ardila-Garcia e Gregory, 2009). All’interno dei chironomidi, abbiamo trovato solo una debole correlazione positiva tra le dimensioni del genoma e le dimensioni del corpo (Fig. 4 BIS). Il valore C medio per il genere Chironomus (0,15 pg) era superiore a quello per il genere Polypedilum (0,10 pg), e questa differenza può essere attribuibile alle dimensioni corporee generalmente più grandi delle specie Chironomus. Tuttavia, la distanza filogenetica tra entrambi i generi potrebbe anche spiegare questa differenza di dimensioni del genoma. Di conseguenza, abbiamo corretto i nostri dati a livello di genere con analisi di contrasti filogeneticamente indipendenti (Garland e Adolph, 1994; Garland et al., 2005) e di conseguenza, la correlazione tra dimensione del genoma e dimensione corporea si è rivelata non significativa (Fig. 4 TER). La ristretta gamma di dimensioni del genoma dei chironomidi (solo due—tre volte) e la media delle piccole dimensioni corporee di queste specie (la maggior parte non supera i pochi millimetri) probabilmente rendono difficile trovare alcuna correlazione tra entrambi i tratti all’interno della famiglia Chironomidae.
Tra gli insetti, è stata suggerita un’altra correlazione tra la dimensione del genoma e la complessità dello sviluppo. Mentre gli insetti emimetabolici, con solo mute ninfali graduali, mostrano una vasta gamma di dimensioni del genoma (valori C da 0,18 a 16.93 pg), gli insetti olometabolici con la loro complessa metamorfosi hanno valori C limitati entro una soglia ipotativa di 2 pg, per la maggior parte di essi (Gregory, 2002, 2005). L’influenza della complessità dello sviluppo sulla dimensione del genoma è qui evidente perché gli insetti olometabolici subiscono un intenso rimodellamento morfologico durante il tempo limitato della metamorfosi e una piccola dimensione del genoma presenta vantaggi per realizzare divisioni cellulari ad un ritmo elevato. I chironomidi sono insetti olometabolici e la loro metamorfosi è estremamente rapida. Il loro stadio pupale può durare solo un giorno, o anche solo poche ore per alcune specie (Cranston, 1995c). Ad esempio, C. tsushimensis mostra una metamorfosi complessa con dimorfismo sessuale pronunciato (Fig. 1 TER).
La relazione tra la dimensione del genoma e il tasso di divisione cellulare influenza anche il tasso di sviluppo. Ad esempio, il rapido ciclo di vita degli afidi è stato suggerito per essere correlato alle loro piccole dimensioni del genoma (Ma et al., 1992). Pertanto, le piccole dimensioni del genoma dovrebbero costituire un vantaggio per le specie di chironomidi che si sviluppano rapidamente in ambienti temporanei. I chironomidi del genere Clunio possono svilupparsi in pozze di marea temporanee e mostrano anche l’emergere sincronizzato degli adulti in relazione al ciclo lunare e durante la breve finestra della bassa marea (Kaiser e Heckel, 2012). A tal fine dovrebbe essere necessario un alto tasso di sviluppo. Si noti che i piccoli anellidi policheti che si sviluppano rapidamente in ambienti interstiziali simili mostrano dimensioni del genoma più piccole rispetto alle specie macrobentiche (Gambi et al., 1997). Per i moscerini antartici, come B. antarctica o Eretmoptera murphyi (Lee et al., 2006; Worland, 2010), lo sviluppo larvale dura due anni, per lo più arrestato in uno stato congelato, ma la metamorfosi e la riproduzione devono avvenire durante il brevissimo periodo estivo. In questo caso, è necessario un alto tasso di sviluppo e questo può essere facilitato dal piccolo genoma di B. antarctica. Questo fenomeno è stato illustrato da uno studio sulle piante angiosperme, mostrando che le specie in grado di completare il loro intero ciclo di vita durante la breve estate antartica presentavano le dimensioni del genoma più piccole (Bennett et al., 1982). Un altro estremo, il moscerino anidrobiotico P. vanderplanki è adattato alle effimere piscine rocciose. Anche in questo caso, un alto tasso di sviluppo in un habitat temporaneo può essere collegato alle piccole dimensioni del genoma di questa specie. Tuttavia, la specie australiana P. tonnoiri, che è anche esposta all’essiccamento su piscine rocciose simili (Jones, 1975; Adams, 1985; Frouz et al., 2003), mostra una dimensione del genoma relativamente grande per un chironomide (Fig. 3 e Tabella 1).
È anche probabile che gli stress abiotici influenzino l’integrità del DNA e, di conseguenza, la dimensione del genoma. Ad esempio, larve di P. vanderpianki sperimenta un massiccio danno al DNA dopo l’anidrobiosi e un’efficiente riparazione del DNA si verifica durante i pochi giorni successivi alla reidratazione (Gusev et al., 2010). Nelle piante, è stata trovata una correlazione negativa tra la dimensione del genoma e la tolleranza alle radiazioni (Bennett e Leitch, 2005) e il tasso di mutazione era anche più basso nelle specie con dimensioni del genoma più piccole (Abrahamson et al., 1973). Di conseguenza, la piccola dimensione del genoma di P. vanderpianki può rappresentare un vantaggio per evitare l’accumulo di mutazioni deleterie durante gli eventi di riparazione del DNA associati a cicli di essiccazione e reidratazione. Come specie marina, C. tsushimensis è anche esposto ad alto stress di salinità, che è letale per la maggior parte delle specie di insetti. L’alta salinità e altri stress abiotici sono noti per generare specie reattive dell’ossigeno intracellulare( ROS), che sono state suggerite come fonte principale di danno al DNA (Franca et al., 2007; Gill e Tuteja, 2010). Questo potrebbe anche essere correlato alle piccole dimensioni del genoma. Tuttavia, altre specie marine e ad alta salinità tolleranti, come T. japonicus o Chironomus salinarius non mostrano dimensioni del genoma piccole come C. tsushimensis. Specie tolleranti all’acido, come Chironomus sulfurosus, Chironomus acerbiphilus o Polypedilum tamanigrum (Fig. 1C) può sopravvivere in sorgenti calde con un pH basso come 1.4 (Doi et al., 2004; Takagi et al., 2005). Anche in questo caso, non è stata osservata una chiara correlazione tra tolleranza allo stress acido e piccole dimensioni del genoma e l’influenza filogenetica è apparsa più importante, con dimensioni del genoma più piccole per il genere Polypedilum e dimensioni del genoma più grandi nel genere Chironomus.
Per concludere, le minuscole dimensioni del genoma osservate nei chironomidi sono probabilmente il risultato di una riduzione ancestrale del numero di elementi trasponibili e della lunghezza degli introni nella loro struttura del genoma. Tra la famiglia Chironomidae, le dimensioni del genoma differivano in base alla filogenesi a livello di sottofamiglia e a livello di genere. Come dedotto dalle correlazioni in vari taxa, la piccola dimensione del genoma dei chironomidi teoricamente avrebbe potuto costituire un preadattamento ad ambienti instabili ed estremi attraverso un alto tasso di sviluppo e un basso tasso di mutazione. Speriamo che questo studio incoraggi i futuri progetti sul genoma dei chironomidi e che la genomica comparativa all’interno di questo taxon aiuti a capire come i genomi dei chironomidi interagiscono con il loro ambiente.