Introduzione
azione enzimatica della fosfodiesterasi di tipo 5 (PDE5), è il principale meccanismo di inattivazione di cGMP, il mediatore a valle del vasodilatatori agente di ossido nitrico (NO) (Lugnier, 2006).
In corso di disfunzione erettile (DE), la ridotta produzione di NO dai vasi cavernosi endoteliali può essere superata farmacologicamente con l’uso di inibitori PDE5 (PDE5i), al fine di prolungare l’emivita cGMP e migliorare la funzione vasodilatatrice residua (Hawksworth e Burnett, 2015). Diverse molecole con attività inibitoria sulla PDE5 sono state quindi proiettate e rilasciate sul mercato, mostrando diversa insorgenza e durata dell’effetto. Attualmente, PDE5i sono i farmaci di prima scelta utilizzati per il trattamento di ED (Mehrotra et al., 2007).
Nonostante un’efficacia riconosciuta in quasi l ‘ 80% dei pazienti con ED non selezionati (Eardley et al., 2010; Hatzimouratidis et al., 2010; Porst et al., 2013), è stato recentemente riportato un notevole abbandono dal trattamento con PDE5i. In termini quantitativi, è stato riportato un tasso medio di interruzione del 4% al mese, con un abbandono complessivo della terapia nel 50% dei casi su base annua (Carvalheira et al., 2012; Corona et al., 2016). Tra le principali ragioni addotte dai pazienti per giustificare l’abbandono della terapia, la mancanza di efficacia e gli effetti collaterali sono indicati come i più diffusi (Corona et al., 2016). Si possono distinguere due tipi di effetti collaterali: quelli strettamente correlati all’inibizione della PDE5, come mal di testa, vampate di calore e dispepsia, e quelli associati all’attività inibitoria residua di farmaci su altre PDE, come vasodilatazione e tachicardia (PDE1), disturbi visivi (PDE6) e mal di schiena (PDE11) (Bischoff, 2004; Gupta et al., 2005). Poiché il verificarsi di effetti collaterali aumenta sia con i livelli sierici che con il tempo di esposizione al farmaco (Gupta et al., 2005; Taylor et al., 2009), il profilo di sicurezza/efficacia di un farmaco può essere alternativamente migliorato attraverso un approccio farmacocinetico mediante la progettazione di una nuova formulazione farmacologica (Mehrotra et al., 2007). Questo approccio è stato applicato con successo alla PDE5i nel caso del Vardenafil. In effetti, questa molecola soffre di una biodisponibilità relativamente bassa (∼15%, Center for Drug Evaluation and Research, 2003). Rispetto alla compressa rivestita con film (FCT), l’originale formulazione classica per os amministrazione, la formulazione di oro dispersibile tablet (ODT) per Vardenafil aumentato significativamente la biodisponibilità di farmaci, favorendo l’assorbimento sublinguale, un itinerario riconosciuto per essere meno influenzata dal metabolismo di primo passaggio (Heinig et al., 2011).
Il Sildenafil (Sild) è stato il primo inibitore selettivo della PDE5 approvato per il trattamento della disfunzione erettile (Boolell et al., 1996). È una molecola relativamente lipofila e, dopo somministrazione orale, la concentrazione plasmatica di picco viene raggiunta in un tempo variabile da 0,5 a 2 h. Sild mostra una biodisponibilità orale relativamente bassa (38-41%), principalmente a causa di un esteso metabolismo intestinale e di primo passaggio (Gupta et al., 2005). Nonostante la lunga presenza sul mercato, lo sviluppo di nuove formulazioni di farmaci è stato poco perseguito, fino alla recente uscita sul mercato italiano di una nuova formulazione: la pellicola oro-dispersibile (ODF). In effetti, l’ODF è stato approvato come forma bioequivalente di FCT (Leoni et al., 2013). Tuttavia, le formulazioni che si disintegrano per via orale possono rappresentare sistemi adatti a favorire l’assorbimento trans-mucoso, e in particolare sub-linguale (Kathpalia e Gupte, 2013).
In questo studio, abbiamo valutato la farmacocinetica Sild associata alla somministrazione sublinguale di ODF o ODT, rispetto alla FCT come formulazione originale per os. A tal fine, abbiamo studiato il profilo di rilascio/permeazione delle diverse formulazioni Sild mediante sistemi in vitro appositamente sviluppati per valutare l’assorbimento trans-mucoso dei farmaci. Inoltre, abbiamo quantificato i profili sierici della farmacocinetica Sild dopo la somministrazione di FCT per os e ODT sublinguale e ODF in pazienti con ED.
Materiali e metodi
Prodotti chimici e formulazioni di farmaci
La soluzione di sali di equilibrio di Hank pH 7.4 (HBSS), soluzione di HEPES, benzanilide e citrato di Sild sono stati tutti acquistati da Sigma–Aldrich (Milano, Italia). Al fine di evitare qualsiasi risultato confondente derivante dall’uso di prodotti bioequivalenti alternativi disponibili sul mercato, sono stati utilizzati i seguenti prodotti: Viagra ® FCT (Pfizer, Milano, Italia), Viagra ORO® ODT (Pfizer) e Rabestrom® ODF (IBSA, Lodi, Italia). I farmaci sono stati prescritti ai pazienti durante la valutazione ambulatoriale per il loro uso privato. Per i test in vitro e la valutazione in vivo della farmacocinetica (vedi sotto), i farmaci sono stati acquistati specificamente dal personale coinvolto nello studio presso le strutture della farmacia locale e quindi manipolati/conservati in condizioni ottimali.
Test di disaggregazione
I test di disaggregazione in vitro sono stati eseguiti secondo la Farmacopea europea (2016) utilizzando il Tablet Disintegration Tester (Sotax DT 2, Figura supplementare S1A), utilizzando acqua come fluido di immersione a 37 ± 0,5°C. Il tempo di disaggregazione è stato controllato alla completa disintegrazione della forma di dosaggio. La disintegrazione completa è definita come lo stato in cui qualsiasi residuo dell’unità che rimane sullo schermo dell’apparecchio di prova o aderisce alla superficie inferiore dei dischi è una massa morbida senza nucleo palpabilmente solido. I test sono stati eseguiti in triplice copia e i risultati sono stati riportati come valore medio ± deviazione standard.
Test di dissoluzione
I test di dissoluzione del farmaco in vitro sono stati eseguiti secondo la Farmacopea europea . I test di dissoluzione sono stati eseguiti utilizzando un apparecchio paddle, velocità paddle 50 rpm, e HBSS pH 7.4 è stato utilizzato come volume medio di dissoluzione (900 ml a 37 ± 0.5°C).
Durante le prove di rilascio, 2 ml di campione di mezzo di dissoluzione, a 0, 2, 4, 6, 10, 20, 30, e 40 min, è stato rimosso e filtrato attraverso il filtro da esteri di cellulosa 0.45 µm e quindi diluito. Successivamente, la quantificazione del Sild è stata eseguita mediante cromatografia liquida ad alte prestazioni (HPLC) – UV. Il volume rimosso è stato sostituito ogni volta con mezzo fresco. I test sono stati eseguiti in triplice copia e i risultati sono stati riportati come valore medio ± deviazione standard. I dati sono stati normalizzati sul contenuto di droga della formulazione.
Trans-mucosal Permeation Test
Trans-mucosal permeation profile of Sild was assessed in vitro by using a specific device according to Delvadia et al. (2012) opportunamente modificato. In breve, il dispositivo consisteva in un sistema di diffusione verticale caratterizzato da camere donatore–ricevente separate da una membrana monouso in acetato di cellulosa (poro 0,45 µm). La cellula donatrice conteneva 1,5 ml di HBSS, mentre la camera ricevente faceva parte di un circuito chiuso di ricircolo di 30 ml, inclusi i volumi di tubazione e serbatoio. Il campionamento è stato eseguito dal serbatoio della camera del ricevitore a intervalli di tempo di 0, 5, 10, 20, 30, e 40 min e sostituito da un volume equivalente di HBSS fresco. I campioni sono stati analizzati da HPLC-UV per il contenuto di droga (Fejős et al., 2014). I dati sono stati normalizzati sulla più alta concentrazione di Sild permeato osservata per il citrato di Sild puro. I test sono stati eseguiti in triplice copia e i risultati sono stati riportati come valore medio ± deviazione standard.
Studio di Farmacocinetica su Volontari Psicogena ED i Pazienti
Lo studio è stato condotto nell’Unità di Andrologia e Medicina della riproduzione (Ospedale Universitario di Padova, Italia), tra Maggio e settembre 2017, secondo la Dichiarazione di Helsinki, con l’approvazione del Comitato Etico dell’Università di Padova Ospedale (numero di protocollo 3982/AO/16 e successive modifiche). Al fine di evitare risultati confusi, i soggetti con ED psicogeno sono stati arruolati perché la minore presenza di disturbi organici associati a ED (Ludwig e Phillips, 2014).
La dimensione del campione è stata calcolata per ottenere una dimensione dell’effetto di almeno 0,5 con una potenza statistica di 0,8 e un livello di significatività di 0,05 per un confronto a tre gruppi (vedi power calculator – ANOVA indipendente a senso unico).
Venti pazienti (età media 31,4 ± 5,7 anni) sono stati arruolati consecutivamente con il rilascio del consenso informato firmato. I pazienti hanno partecipato a una valutazione ambulatoriale che riportava la costante incapacità di ottenere e mantenere un’erezione per un rapporto sessuale soddisfacente durante i precedenti 6 mesi o più. La successiva valutazione clinica è stata eseguita in tutti i pazienti al fine di accertare l’assenza di malattie correlate alla disfunzione erettile, come diabete mellito, ipertensione, disturbi neurologici e uso di antidepressivi. La diagnosi di ED psicogena è stata confermata dall’adempimento di un punteggio indice <26 alla somministrazione del questionario International Index of Erectile Function-15 (IIEF-15) (Lotti et al., 2016) e il mantenimento delle erezioni spontanee notturne, valutate mediante il monitoraggio notturno della tumescenza del pene e della rigidità attraverso il RigiScan Plus Rigidity Assessment System (Dacomed, Stati Uniti) per due notti consecutive come precedentemente descritto (Munoz et al., 1993; Caretta et al., 2005). I criteri di esclusione erano la diagnosi di tumori maligni, livelli plasmatici ormonali anormali (rispettivamente, ormone luteinizzante >8 UI/l, testosterone totale <10,4 nmol/l, tireotropina >4,5 mUI/l, prolattina >20 ng/ml) e aumento dello spessore intima-media a tronchi supra-aortici (>0.9 mm) e/o arterie cavernose (> 0,3 mm), valutate mediante Color Doppler-Ultrasuoni come precedentemente descritto (Caretta et al., 2005, 2009).
I pazienti hanno accettato di aderire ad uno studio crossover in aperto a dose singola, a tre vie. Schema di dosaggio del farmaco è riportato in Figura 1. Il dosaggio di Sild è stato scelto come 50 mg, in accordo con precedenti rapporti sul trattamento dell’ED psicogena (Banner e Anderson, 2007). Ai pazienti è stato chiesto di non assumere droghe o alcol per 1 settimana prima e durante il corso dello studio. Inoltre, durante il giorno di dosaggio del farmaco, ai pazienti è stato anche richiesto di fare una colazione senza grassi (senza latte o altri alimenti grassi) almeno 2 h prima del test. La FCT, considerata come formulazione di riferimento, è stata somministrata classicamente per os ingerendo la compressa orale con un bicchiere d’acqua. Per ODT e ODF, i pazienti sono stati istruiti a tenere la formulazione sotto la lingua per 15 min senza l’assunzione di acqua, seguita dalla deglutizione. Campioni di sangue venoso sono stati raccolti in provette standard (Vacutainer, BD Biosciences, Milano, Italia) presso 0, 5, 10, 15, 30, 60, 90, 120, e 240 min dopo la somministrazione del farmaco. È stata eseguita la compensazione mediante infusione continua di soluzione salina sterile. Dopo la somministrazione, i soggetti sono stati ospitati fino al completamento del prelievo di sangue. Un ulteriore prelievo di sangue è stato eseguito a 24 h dalla somministrazione per motivi di controllo per accertare la completa eliminazione del farmaco. Come periodi di washout, sono stati consentiti 7 giorni tra una somministrazione e la successiva. Dopo la raccolta del sangue, il plasma è stato immediatamente isolato e conservato a -80°C fino all’uso.
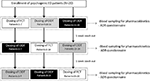
FIGURA 1. Schema di dosaggio e valutazioni per la valutazione dei parametri farmacocinetici in 20 pazienti con disfunzione erettile psicogena (ED), suddivisi in tre gruppi (rispettivamente, Pazienti 1-7; Pazienti 8-14; e Pazienti 15-20). Ciascun gruppo di pazienti ha ricevuto alternativamente per os compressa rivestita con film (FCT), compressa oro-dispersibile sublinguale (ODT) o pellicola oro-dispersibile sublinguale (ODF) con almeno 1 settimana di lavaggio da ciascuna dose. Tutte le formulazioni contenevano 50 mg di sildenafil (Sild).
Durante l’alloggiamento, ai pazienti è stato anche richiesto di registrare le reazioni avverse al farmaco (ADR) in una forma appositamente concepita, adattata dal modulo di segnalazione ADR dell’Agenzia Italiana del Farmaco (AIFA1). Una versione tradotta del questionario è disponibile come materiale supplementare (vedi Scheda tecnica supplementare S1). Ai pazienti è stato chiesto di specificare il tipo di reazione avversa/i, l’intensità complessiva (in una scala di valutazione soggettiva da 1, molto debole, a 5, molto intensa), il tempo di insorgenza e la durata complessiva.
Quantificazione del Sildenafil nel siero umano
Per quantificare i livelli sierici di Sild, sono stati aggiunti 400 µl di campione di siero di 500 µl di metanolo integrato dallo standard interno (IS) benzanilide (5 µg/ml). Successivamente, 5 ml di acetato di etile sono stati aggiunti alla miscela, i campioni sono stati vortexati per eseguire l’estrazione liquido–liquido, le due fasi sono state separate per centrifugazione. La porzione organica è stata poi evaporata sotto vuoto-centrifuga a 40°C. Il residuo ottenuto è stato nuovamente disciolto con 200 µl di metanolo e infine utilizzato per l’analisi di cromatografia liquida ad alte prestazioni-spettrometria di massa tandem (HPLC-MS/MS).
Cromatografia liquida ad alte prestazioni-analisi MS/MS ha utilizzato un sistema Agilent-Varian 1260 e il rivelatore triplo-quadruplo Agilent-Varian 320 MS. La separazione cromatografica è stata eseguita su una colonna Phenomenex C-18 Evo 3 × 100 e una fase mobile costituita da acetonitrile con acido formico allo 0,1% in acqua con un gradiente dettagliato nella figura supplementare S2A. È stata applicata una modalità di rilevamento positiva per la transizione 198 > 105 Da dell’IS, ottenuta con una tensione capillare di 40 V e un’energia di collisione di 16 V mentre 475 > 100 Da per Sild con tensione capillare di 40 V e un’energia di collisione di 22,5 V, rispettivamente. I cromatogrammi rappresentativi dell’IS e del Sild nei campioni reali sono riportati nella figura supplementare S2B.
Analisi statistica
I parametri farmacocinetici (PK), come la massima concentrazione sierica (Cmax), il tempo alla massima concentrazione sierica (tmax) e l’area sotto la curva (AUC) in diversi punti temporali, sono stati calcolati con routine specifiche di applicazioni con il software GraphPad (La Jolla, CA, Stati Uniti). L’analisi statistica dei dati è stata eseguita con SPSS 21.0 per Windows (SPSS, Chicago, IL, Stati Uniti). Il test Kolmogorov-Smirnov è stato utilizzato per verificare la normalità della distribuzione. Le variabili che non mostravano una distribuzione normale sono state trasformate nel registro. Le caratteristiche basali dei pazienti, la PKs e i dati degli esperimenti in vitro sono stati confrontati con i t-test di Student non accoppiati con la correzione Bonferroni–Holm per confronti multipli. Misure ripetute ANOVA è stata eseguita per testare le differenze nel rilascio del farmaco e nella concentrazione sierica di Sild. Il test di Levene è stato utilizzato per testare l’omogeneità della varianza tra i gruppi. Se è stata violata l’omogeneità dell’ipotesi di varianza, è stato eseguito il test Welch e è stato riportato il rispettivo valore P. La percentuale di ADR è stata confrontata con la prova esatta χ2. P-valori < 0.05 sono stati considerati statisticamente significativi.
Risultati
Analisi in vitro del rilascio/permeazione del Sildenafil dalle diverse formulazioni del farmaco
La dinamica del rilascio e della permeazione del Sild dalle tre formulazioni del farmaco è stata precedentemente studiata in vitro (Figura 2). Il tempo per completare la disaggregazione per FCT, ODT e ODF è stato valutato attraverso un test standard descritto nella Farmacopea europea (2016; Figura 2A). L’ODF ha mostrato il più alto tempo di disaggregazione rispetto a FCT e ODT (rispettivamente, P = 0,017 e P = 0,008).
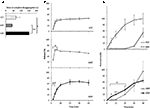
FIGURA 2. Valutazione in vitro delle proprietà bio-tecnologiche di FCT, ODT e ODF contenenti 50 mg di Sild. I risultati sono rappresentativi di tre esperimenti indipendenti e riportati come valori medi ± deviazione standard. A) I risultati della prova di disaggregazione, indicando il tempo (in secondi) per la disaggregazione completa della formulazione. Significato: ∗P < 0,05 e P P < 0,01 tra le formulazioni indicate. (B) Risultati del test di dissoluzione, riportando la quantità di Sild rilasciata da ciascuna formulazione come percentuale del dosaggio del farmaco. Significato: aP < 0.01 vs. FCT; bP < 0.001 vs. ODT. C) I risultati della prova di permeazione (dettagliati nella sezione “Materiali e metodi”) che riportano la quantità di Sild permeato attraverso una membrana di acetato di cellulosa, come percentuale del valore più alto raggiunto da 50 mg di polvere di Sild puro (linea discontinua nel pannello superiore). Significato 😛 P < 0.05 vs. ODT; P P < 0.01 vs. ODT; aP < 0.01 vs. FCT.
Al fine di valutare l’influenza di questa evidenza sul rilascio del farmaco dalla formulazione, è stato eseguito un test di dissoluzione standard (Farmacopea europea, 2016; Figura 2B). Rispetto alla formulazione di riferimento FCT, ODT ha mostrato un rilascio più rapido del farmaco la cui estensione massima è stata raggiunta anche dopo soli 2 minuti dall’inizio del test (P = 0,006 vs. FCT). D’altra parte, la percentuale del farmaco rilasciato da ODF entro i primi 4 minuti del test era inferiore rispetto a FCT e ODT (rispettivamente, P = 0,004 e P < 0,001). In particolare, ODF ha mostrato un rilascio più progressivo del farmaco rispetto a FCT, raggiungendo l’estensione massima dopo 20 minuti dall’inizio del test.
Su questa base, la permeazione trans-mucosa del Sild di ciascuna formulazione è stata valutata da un dispositivo specificamente sviluppato (Figura 2C). A fini di riferimento, il citrato di Sild puro, utilizzato in un peso equivalente a 50 mg di Sild, è stato valutato per la permeazione trans-mucosa e ha mostrato una diffusione libera e veloce tra le due camere. Un profilo quasi opposto è stato osservato per FCT, mostrando una permeazione trascurabile fino a 30 min dall’inizio del test. I profili di permeazione di ODT e ODF hanno mostrato un comportamento intermedio rispetto alle due condizioni precedenti. Entro i primi 20 minuti del test, l’ODF ha mostrato un grado di permeazione significativamente più elevato rispetto all’ODT (rispettivamente, P = 0,033 a 5 min, P = 0,003 a 10 min e P = 0,041 a 20 min). A differenza di FCT e ODT che si disaggregavano completamente nella camera donatrice, una massa residua di gelatina molle di ODF persisteva sulla membrana di acetato di cellulosa anche alla fine del test (Figura supplementare S2C).
Farmacocinetica differenziale di Sildenafil
Venti soggetti maschi affetti da DE psicogena hanno accettato di ricevere alternativamente FCT, ODT o ODF, separati da una settimana di lavaggio. Come dettagliato nella sezione “Materiali e metodi”, FCT è stato ingerito classicamente per consentire la somministrazione classica per os mentre ODT e ODF sono stati mantenuti sotto la lingua per 15 min per promuovere la via sublinguale. Le caratteristiche cliniche dei pazienti sono riportate nella Tabella 1. I livelli sierici di Sild corrispondenti alle tre condizioni di dosaggio sono riportati nella Figura 3. Una notevole variabilità ha caratterizzato il profilo del siero del farmaco delle tre formulazioni. Rispetto alla FCT, l’ODT ha mostrato un apparente aumento precoce dei livelli sierici di Sild; tuttavia, questa tendenza non era statisticamente significativa. D’altra parte, un decadimento più rapido dei livelli di Sild a 120 e 240 min dal dosaggio è stato osservato per la formulazione ODT (rispettivamente, P = 0,044 e P = 0,024 vs. FCT).
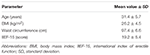
TABELLA 1. Caratteristiche cliniche dei partecipanti allo studio (N = 20).
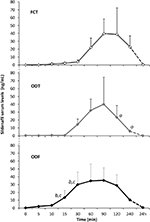
FIGURA 3. Valutazione in vivo dei livelli sierici di Sild, in 20 pazienti affetti da ED psicogena, che ricevono alternativamente l’FCT per os, o l’ODT sublinguale, o l’ODF sublinguale come dettagliato nella sezione ” Materiali e metodi.”I dati sono riportati come valori medi ± deviazione standard Significatività: aP < 0,05 vs. FCT; bP < 0,01 vs. FCT; cP < 0,05 vs. ODT.
Il profilo del siero del farmaco della formulazione ODF ha mostrato un aumento più rapido dei livelli di Sild rispetto a FCT (P = 0,001 e P = 0,003) e ODT (P = 0,048 e P = 0,041), rispettivamente, a 15 e 30 minuti dal dosaggio. In accordo con il suo lento tempo di disaggregazione in vitro (Figura 2B), la curva concentrazione–tempo media di ODF in vivo era più liscia di quelle di FCT e ODT (Figura 3).
I parametri farmacocinetici delle tre formulazioni, ottenuti dall’analisi dei livelli sierici di Sild, sono riassunti nella Tabella 2. Nonostante non sia stata osservata alcuna differenza significativa tra le tre formulazioni in termini di Cmax, tmax e AUC0-240 min, ODF ha mostrato il valore più basso di Cmax (38,2 ± 23,7 ng/ml) e il più breve tmax (70,0 ± 24,5 min). In particolare, ODF ha mostrato un valore significativo più alto dell’AUC0-60 min rispetto a FCT e ODT (rispettivamente, P = 0,005 e P = 0.043), con conseguente aumento della biodisponibilità relativa di Sild entro la prima ora dalla somministrazione di ODF attraverso la via sublinguale.

TABELLA 2. Parametri farmacocinetici delle formulazioni di sildenafil.
Reazioni avverse al farmaco
I risultati ottenuti dal questionario auto-somministrato sul tipo e le caratteristiche di ADR sperimentate dai partecipanti allo studio sono riassunti nella Tabella 3. Tra i noti ADR riportati per Sild (Taylor et al., 2009), i più frequentemente registrati erano mal di testa, vampate di calore e congestione nasale. Un paziente ha riportato dolore muscolare di basso grado (grado 1 alla scala di valutazione soggettiva) dopo la somministrazione di FCT. Nessuno dei pazienti ha riportato alterazioni della vista, tachicardia, debolezza o alterazione dell’udito.

TABELLA 3. Reazioni avverse al farmaco registrate dai partecipanti allo studio (N = 20).
Rispetto alla FCT come formulazione di riferimento, l’ODT ha mostrato una prevalenza invariata di ADR. Tuttavia, la percezione personale dell’intensità del lavaggio era significativamente inferiore (P = 0,031). D’altra parte, ODF ha mostrato una ridotta prevalenza di mal di testa rispetto a FCT (P = 0,043). Inoltre, la durata e l’intensità delle vampate e della congestione nasale sono state percepite a livelli inferiori rispetto a FCT (rispettivamente, P = 0,011 e P = 0,015) e ODT (rispettivamente, P = 0,026 e P = 0,037).
Discussione
In questo studio, forniamo prove che la via sublinguale di somministrazione di Sild associa un aumento della biodisponibilità precoce del farmaco e un miglioramento del profilo di tollerabilità. Questa evidenza è supportata sia da indagini in vitro, che dimostrano che la formulazione Sild è caratterizzata da un tempo più lungo per la disaggregazione ma ha favorito significativamente l’assorbimento della trans-mucosa, sia da evidenze in vivo.
Gli inibitori della fosfodiesterasi sono l’opzione terapeutica di prima scelta per il trattamento di ED; tuttavia, gli effetti collaterali sperimentati dai pazienti sono riconosciuti come la ragione più prevalente per l’interruzione della terapia (Corona et al., 2016). La modifica della farmacocinetica attraverso la progettazione di una nuova formulazione farmacologica può rappresentare una strategia interessante per migliorare il profilo di sicurezza / efficacia del farmaco stesso (Mehrotra et al., 2007). A questo proposito, la scadenza 2013 del brevetto sul citrato di Sild in diversi paesi europei ha permesso l’opportunità di rilasciare una serie di nuove formulazioni di Sild. Va notato che la maggior parte delle formulazioni Sild disponibili oggi sul mercato sono effettivamente approvate come forme bioequivalenti dell’originale FCT (Leoni et al., 2013). È interessante notare che sono state sviluppate formulazioni di disintegrazione orale, caratterizzate da una rapida disaggregazione nella bocca del paziente senza la necessità di deglutire con acqua (Goel et al., 2008). Queste nuove formulazioni trovano una migliore conformità in quelle popolazioni di pazienti con difficoltà a deglutire dosaggi solidi convenzionali, come bambini, pazienti geriatrici e pazienti disfagici. Inoltre, fornendo una maggiore disponibilità di farmaci per via orale, le formulazioni che si disintegrano per via orale possono rappresentare sistemi valutati per favorire l’assorbimento della trans-mucosa e, in particolare, sub-linguale (Kathpalia e Gupte, 2013). In particolare in Italia, due formulazioni di Sild disgreganti per via orale sono ufficialmente disponibili nelle strutture farmaceutiche: l’ODTs e l’ODFs.
In questo studio, abbiamo mirato a valutare le possibili variazioni farmacocinetiche e il corrispondente pattern di ADR, derivanti dal favorire l’assorbimento trans-mucoso del Sild attraverso la somministrazione sub-linguale delle due formulazioni disponibili per via orale disintegranti del farmaco. I risultati sono stati confrontati con la formulazione originale di Sild, vale a dire il FCTS. È interessante notare che abbiamo trovato una stretta correlazione, sia in vitro che in vitro, tra le proprietà bio-tecnologiche e il PKS delle diverse formulazioni. In particolare, nonostante un dosaggio uguale del farmaco (50 mg) e un tasso leggermente ridotto di rilascio del farmaco nel test di dissoluzione, l’ODF è stato caratterizzato da un maggiore tempo di disaggregazione e da un maggiore tasso di permeazione nel modello trans-mucoso, da un lato, e da una maggiore biodisponibilità del farmaco entro la prima ora dalla somministrazione, dall’altro. Potremmo quindi ipotizzare che l’assorbimento sub-linguale del Sild sia favorito da un prolungato contatto farmaco-mucosa. In effetti, questo fenomeno è generalmente perseguito per i farmaci trans-mucosali orali, dove si raccomanda l’uso di polimeri mucoadesivi per assicurare un prolungato periodo di contatto tra la formulazione e la mucosa orale (Lam et al., 2014), in particolare da quei farmaci, come il Sild, affetti da bassa solubilità in acqua (Zayed et al., 2012; Sun et al., 2014). Questi risultati preliminari sono anche indicativi di un possibile miglioramento dell’efficacia clinica per questa classe di farmaci rispetto alle formulazioni originali. Ulteriori studi sono giustificati per chiarire questi aspetti.
La prova più sorprendente del presente studio è una significativa riduzione delle ADR della somministrazione sub-linguale di ODF, rispetto a ODT e FCT somministrati allo stesso dosaggio, che a sua volta può comportare un aumento della compliance dei pazienti. Questa evidenza può essere interpretata alla luce del principio che l’incidenza di un effetto collaterale del farmaco aumenta aumentando i livelli sierici e il tempo di esposizione al farmaco stesso (Gupta et al., 2005; Taylor et al., 2009). Nonostante una biodisponibilità globale invariata rispetto alle altre formulazioni analizzate, la somministrazione sub-linguale di ODF ha mostrato un valore inferiore di Cmax e un tmax più breve, risultando in una percentuale significativamente più elevata di Sild bio-disponibile entro la prima ora dalla somministrazione. Pertanto, potremmo ipotizzare che la somministrazione sub-linguale di ODF combini un assorbimento efficiente del farmaco con il raggiungimento di livelli sierici medi più bassi di Sild e un conseguente minor rischio di ADR. Tuttavia, riconosciamo la bassa dimensione del campione come lo svantaggio principale dello studio. Ulteriori indagini su coorti più grandi e con dosaggi diversi sono necessari per confermare questo problema.
In conclusione, in questo studio riportiamo che la somministrazione sublinguale di Sild ODF migliora il profilo di tollerabilità del farmaco attraverso il probabile coinvolgimento di una farmacocinetica modificata rispetto al generatore FCTS. Sebbene l’ODF non sia stato originariamente concepito per questo scopo, questo rappresenta una strategia interessante per migliorare la conformità del paziente alla terapia. Stiamo sviluppando ulteriori studi comparativi per valutare l’efficacia clinica nei pazienti con ED psicogena e organica.
Contributi dell’autore
LDT e CF hanno coordinato lo studio e redatto il manoscritto. La MDRP ha valutato e arruolato i pazienti. EF ha eseguito analisi in vitro. SDA ha eseguito l’analisi del siero. RP ha eseguito il confronto farmacocinetico. RP, NR, e AG criticamente rivisto e finalizzato il manoscritto.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Ringraziamenti
Ringraziamo il Dott. Alberto Barosso, il Dott. Giuseppe Maggioni, il Dott. Dimitri Portale per la consulenza ai pazienti, la Dott. ssa Flavia Rosano e la Dott. ssa Alice Passadore per la gestione dei pazienti, e tutto il personale dell’Unità di Andrologia e Medicina della Riproduzione.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online all’indirizzo: https://www.frontiersin.org/articles/10.3389/fphar.2018.00059/full#supplementary-material
FIGURA S1 / Immagini rappresentative del Tester di disintegrazione della compressa (A) e dell’apparecchio di dissoluzione (B) utilizzati rispettivamente per la prova di disaggregazione e la prova di dissoluzione.
FIGURA S2 |(A) Dettagli del gradiente di fase mobile utilizzato per la cromatografia liquida ad alte prestazioni-spettrometria di massa tandem (HPLC-MS/MS) analisi dei livelli sierici di sildenafil (Sild). Sono riportati cromatogrammi rappresentativi e spettri di massa di entrambi i Sild alla benzanilide standard interna in campioni reali (B). C) Immagine rappresentativa della pellicola oro-dispersibile residua (evidenziata da una linea discontinua), che persiste dopo la prova di permeazione nel dispositivo utilizzato per la stima in vitro dell’assorbimento transmucoso attraverso una membrana di acetato di cellulosa.
SCHEDA TECNICA S1 / Questionario sulle reazioni avverse al farmaco.
Nota in calce
- ^http://www.aifa.gov.it/en/content/reporting-adverse-reaction
Nel 2007 si trasferisce a New York. Sildenafil integrato e terapia sessuale cognitivo-comportamentale per la disfunzione erettile psicogena: uno studio pilota. J. Sesso. Med. 4, 1117–1125. doi: 10.1111 / j. 1743-6109. 2007.00535.x
PubMed Abstract / CrossRef Testo completo / Google Scholar
Bischoff, E. (2004). Potenza, selettività e conseguenze della non selettività dell’inibizione della PDE. Int. J. Impot. Res. Suppl. 1, S11-S14. doi: 10.1038 / sj.ijir.3901208
PubMed Abstract / CrossRef Testo completo / Google Scholar
Boolell, M., Allen, M. J., Ballard, SA, Gepi-Attee, S., Muirhead, GJ, Naylor, A. M., et al. (1996). Sildenafil: un tipo oralmente attivo 5 inibitore ciclico GMP-specifico della fosfodiesterasi per il trattamento di disfunzione erettile del pene. Int. J. Impot. Res. 8, 47-52.
PubMed Abstract / Google Scholar
Caretta, N., Palego, P., Ferlin, A., Garolla, A., Bettella, A., Selice, R., et al. (2005). Ripresa delle erezioni spontanee in pazienti selezionati affetti da disfunzione erettile e vari gradi di alterazione della parete carotidea: ruolo del tadalafil. EUR. Urol. 48, 326–331. doi: 10.1016 / j.eururo.2005.01.013
PubMed Abstract / CrossRef Testo completo / Google Scholar
Caretta, N., Palego, P., Schipilliti, M., Ferlin, A., Di Mambro, A., e Foresta, C. (2009). Spessore intima-media dell’arteria cavernosa: un nuovo parametro nella diagnosi della disfunzione erettile vascolare. J. Sesso. Med. 6, 1117–1126. doi: 10.1111 / j. 1743-6109. 2008.01112.x
PubMed Abstract / CrossRef Testo completo / Google Scholar
Carvalheira, A. A., Pereira, N. M., Maroco, J., e Forjaz, V. (2012). Abbandono nel trattamento della disfunzione erettile con PDE5: uno studio sui predittori e un’analisi qualitativa delle ragioni della sospensione. J. Sesso. Med. 9, 2361–2369. doi: 10.1111 / j. 1743-6109. 2012.02787.x
PubMed Abstract / CrossRef Testo completo / Google Scholar
Center for Drug Evaluation and Research (2003). NDA 021400 Levitra (Vardenafil cloridrato) Compresse: Farmacologia clinica / Biofarmaceutica Review. Rockville, Md: Dipartimento di salute e servizi umani. Silver Spring, MD: Food and Drug Administration.
Google Scholar
Corona, G., Rastrelli, G., Burri, A., Serra, E., Gianfrilli, D., Mannucci, E., et al. (2016). Abbandono degli inibitori della fosfodiesterasi di prima generazione di tipo 5: una revisione completa e meta-analisi. Andrologia 4, 1002-1009. doi: 10.1111 / andr.12255
PubMed Abstract / CrossRef Testo completo / Google Scholar
Delvadia, P. R., Barr, W. H., e Karnes, H. T. (2012). A biorelevant in vitro release/permeation system for oral transmucosal dosage forms. Int. J. Pharm. 430, 104–113. doi: 10.1016/j.ijpharm.2012.03.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Eardley, I., Donatucci, C., Corbin, J., El-Meliegy, A., Hatzimouratidis, K., McVary, K., et al. (2010). Pharmacotherapy for erectile dysfunction. J. Sex. Med. 7, 524–540. doi: 10.1111/j.1743-6109.2009.01627.x
PubMed Abstract | CrossRef Full Text | Google Scholar
European Pharmacopoeia (2016). Direzione Europea per la qualità dei medicinali &Sanità (EDQM), 9a Edn. Strasburgo: Consiglio d’Europa.
Google Scholar
Fejős, I., Neumajer, G., Béni, S., e Jankovics, P. (2014). Analisi qualitativa e quantitativa degli inibitori della PDE-5 in medicinali contraffatti e integratori alimentari da parte di HPLC-UV utilizzando sildenafil come unico riferimento. J. Pharm. Biomed. Anale. 98, 327–333. doi: 10.1016 / j. jpba.2014.06.010
PubMed Abstract / CrossRef Testo completo / Google Scholar
Goel, H., Rai, P., Rana, V., e Tiwary, A. K. (2008). Sistemi di disintegrazione orale: innovazioni nella formulazione e nella tecnologia. Pat recente. Droga Deliv. Formul. 2, 258–274. doi: 10.2174/187221108786241660
CrossRef Testo completo / Google Scholar
Nel 2005 è stato nominato presidente del Consiglio dei Ministri. La farmacocinetica clinica degli inibitori della fosfodiesterasi-5 per la disfunzione erettile. J. Clin. Pharmacol. 45, 987–1003. doi: 10.1177/0091270005276847
PubMed Abstract / CrossRef Testo completo / Google Scholar
Hatzimouratidis, K., Amar, E., Eardley, I., Giuliano, F., Hatzichristou, D., Montorsi, F., et al. (2010). Associazione Europea di Urologia. Linee guida sulla disfunzione sessuale maschile: disfunzione erettile ed eiaculazione precoce. EUR. Urol. 57, 804–814. doi: 10.1016 / j.eururo.2010.02.020
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2015 si trasferisce a New York. Gestione farmacoterapeutica della disfunzione erettile. Clin. Pharmacol. Ther. 98, 602–610. doi: 10.1002 / cpt.261
PubMed Abstract / CrossRef Testo completo / Google Scholar
Heinig, R., Weimann, B., Dietrich, H., e Böttcher, M. F. (2011). Farmacocinetica di una nuova formulazione in compresse orodispersibili di vardenafil: risultati di tre studi clinici. Clin. Drug Investig. 31, 27–41. doi: 10.2165/11584950-000000000-00000
PubMed Abstract / CrossRef Testo completo / Google Scholar
Kathpalia, H., e Gupte, A. (2013). Un’introduzione ai sistemi di somministrazione di farmaci a film sottile orale a rapida dissoluzione: una recensione. Curr. Droga Deliv. 10, 667–684. doi: 10.2174/156720181006131125150249
PubMed Abstract / CrossRef Full Text / Google Scholar
Nel 2014 è stato pubblicato il primo album in studio del gruppo musicale statunitense Lam, J. K., Xu, Y., Worsley, A. e Wong, I. C. (2014). Consegna transmucosa orale della droga per uso pediatrico. Adv. Droga Deliv. Apoc.73, 50-62. doi: 10.1016 / j.addr.2013.08.011
PubMed Abstract / CrossRef Testo completo / Google Scholar
Leoni, L. A., Leite, G. S., Wichi, R. B., e Rodrigues, B. (2013). Sildenafil: due decenni di benefici o rischi? Invecchiamento Maschile 16, 85-91. doi: 10.3109 / 13685538.2013.801952
PubMed Abstract / CrossRef Testo completo / Google Scholar
Lotti, F., Corona, G., Castellini, G., Maseroli, E., Fino, M. G., Cozzolino, M., et al. (2016). La compromissione della qualità dello sperma è associata a disfunzione sessuale in base alla sua gravità. Ronzio. Reprod. 31, 2668–2680. doi: 10.1093/humrep / dew246
PubMed Abstract / CrossRef Full Text / Google Scholar
Ludwig, W., e Phillips, M. (2014). Cause organiche della disfunzione erettile negli uomini sotto i 40 anni. Urol. Int. 92, 1–6. doi: 10.1159/000354931
PubMed Abstract / CrossRef Full Text / Google Scholar
Lugnier, C. (2006). Superfamiglia della fosfodiesterasi nucleotidica ciclica (PDE): un nuovo target per lo sviluppo di specifici agenti terapeutici. Pharmacol. Ther. 109, 366–398. doi: 10.1016 / j. pharmthera.2005.07.003
PubMed Abstract / CrossRef Full Text / Google Scholar
Mehrotra, N., Gupta, M., Kovar, A., e Meibohm, B. (2007). Il ruolo della farmacocinetica e della farmacodinamica nella terapia con inibitori della fosfodiesterasi-5. Int. J. Impot. Res. 19, 253-264. doi: 10.1038 / sj.ijir.3901522
PubMed Abstract / CrossRef Testo completo / Google Scholar
Munoz, M., Bancroft, J., e Marshall, I. (1993). Le prestazioni del Rigiscan nella misurazione della tumescenza e della rigidità del pene. Int. J. Impot. Res. 5, 69-76.
Google Scholar
Porst, H. Burnett, A., Brock, G., Ghanem, H., Giuliano, F., Glina, S., et al. (2013). Il Comitato per gli standard ISSM per la medicina sessuale. SOP trattamento conservativo (medico e meccanico) della disfunzione erettile. J. Sesso. Med. 10, 130–171. doi: 10.1111 / jsm.12023
PubMed Abstract / CrossRef Testo completo / Google Scholar
Sun, D., Wei, X., Xue, X., Fang, Z., Ren, M., Lou, H., et al. (2014). Maggiore assorbimento orale e effetto terapeutico dell’acetilpuerarina a base di D-α-tocoferil polietilenglicole 1000 succinato nanoemulsioni. Int. J. Nanomedicina 9, 3413-3423. doi: 10.2147 / IJN.S63777
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2009 è stato pubblicato il primo album in studio della band. Differenze nella durata degli effetti collaterali e livelli di disturbo correlati tra gli inibitori della fosfodiesterasi di tipo 5. BJU Int. 103, 1392–1395. doi: 10.1111 / j. 1464-410X. 2008. 08328.x
PubMed Abstract / CrossRef Testo completo / Google Scholar
Zayed, R., Kamel, A. O., Shukr, M., e El-Shamy, A. H. (2012). Uno studio comparativo in vitro e in vivo di dispersioni solide direttamente compresse e compresse sublinguali di citrato di sildenafil liofilizzato per la gestione dell’ipertensione arteriosa polmonare. Acta Pharm. 62, 411–432. doi: 10.2478/v10007-012-0027-9
PubMed Abstract | CrossRef Full Text | Google Scholar