L’aggiunta di una porzione di carboidrati a una molecola proteica viene definita glicosilazione proteica. È una modifica post-traslazionale comune per le molecole proteiche coinvolte nella formazione della membrana cellulare. Durante questo processo, il collegamento delle unità del monosaccaride alle catene dell’amminoacido stabilisce la fase per una serie di reazioni enzimatiche che piombo alla formazione delle glicoproteine (oligosaccaridi collegati n ed o che sono trovati ad un’entità della proteina). In tutti e 16 gli enzimi noti dovrebbero mediare questa reazione. Una glicoproteina tipica ha almeno 41 legami che coinvolgono 8 aminoacidi e 13 diverse unità di monosaccaridi e comprende i legami glicofosfatidilinositolo (GPI) e fosfoglicosil. La glicosilazione proteica aiuta a piegare correttamente le proteine, la stabilità e l’adesione cellulare-cellulare comunemente necessaria alle cellule del sistema immunitario. I principali siti di glicosilazione proteica nel corpo sono ER, corpo di Golgi, nucleo e fluido cellulare.
La glicosilazione proteica può essere classificata in due tipi principali:
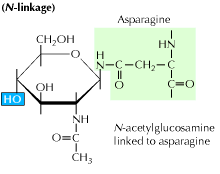 a) Glicosilazione legata all’N: inizia con l’aggiunta di un precursore di 14 zuccheri ad un amminoacido asparagina. Contiene molecole di glucosio, mannosio e n-acetilglucosamina. Questa entità viene quindi trasferita al lume ER. L’enzima oligosaccaril transferasi lega la catena oligosaccaridica all’asparagina che si verifica nella sequenza tripeptidica, Asn-X-Ser o Asn-X-Thr. X può essere qualsiasi aminoacido diverso dalla Prolina. La sequenza proteica legata all’oligosaccaride ora si ripiega correttamente e viene ora traslocata nel corpo di Golgi dove viene rimosso il residuo di mannosio.
a) Glicosilazione legata all’N: inizia con l’aggiunta di un precursore di 14 zuccheri ad un amminoacido asparagina. Contiene molecole di glucosio, mannosio e n-acetilglucosamina. Questa entità viene quindi trasferita al lume ER. L’enzima oligosaccaril transferasi lega la catena oligosaccaridica all’asparagina che si verifica nella sequenza tripeptidica, Asn-X-Ser o Asn-X-Thr. X può essere qualsiasi aminoacido diverso dalla Prolina. La sequenza proteica legata all’oligosaccaride ora si ripiega correttamente e viene ora traslocata nel corpo di Golgi dove viene rimosso il residuo di mannosio.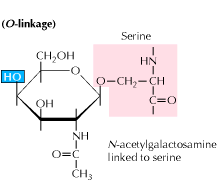
b) Glicosilazione legata all’O: la glicosilazione inizia con un’aggiunta enzimatica di N-acetil-galattosamina seguita da altri carboidrati ai residui di serina o treonina. Gli studi rivelano che la glicosilazione legata all’O si verifica in una fase successiva nell’elaborazione delle proteine.