Introduzione
I tessuti, le cellule e le strutture più piccole all’interno delle cellule (organelli) sono per lo più acqua e sono quindi trasparenti. L’imaging di minuscoli sacchetti d’acqua trasparenti produce immagini che non contengono molte informazioni e, in microscopia, è fondamentale avere una sorta di contrasto o macchia che dia alle aree del colore del campione e le renda molto più facili da vedere. Inoltre, cosa succede se vuoi solo immaginare alcune delle strutture più piccole all’interno di una cellula, come un nucleo o una membrana cellulare? Colorare l’intera cella renderebbe impossibile localizzare le aree che ti interessano.
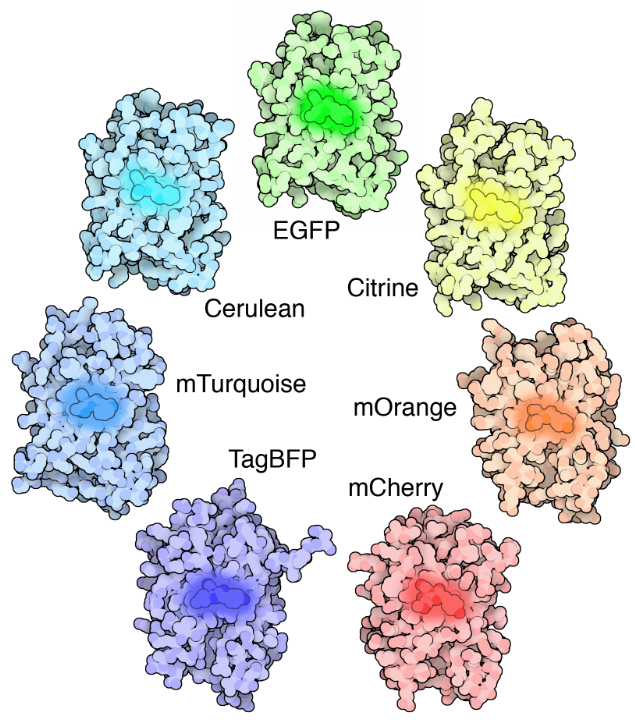
La fluorescenza risolve entrambi questi problemi di contrasto e localizzazione. La fluorescenza è dove un oggetto emetterà luce dopo aver assorbito la luce. Molti oggetti diversi presentano fluorescenza, come minerali (la parola fluorescenza proveniente dalla fluorite minerale), pesci di acque profonde (la più famosa è la medusa Aequorea victoria, da cui è stata scoperta la proteina fluorescente verde (GFP)), piante, prodotti chimici e molti altri.
Le molecole fluorescenti (note come fluorofori) vengono utilizzate per etichettare i campioni e sono disponibili fluorofori che emettono luce praticamente in qualsiasi colore. In un microscopio fluorescente, un campione viene etichettato con un fluoroforo e quindi viene utilizzata una luce intensa (luce di eccitazione) per illuminare il campione, che emana fluorescenza (luce di emissione). In questo modo, i campioni sono fortemente contrastati con lo sfondo nero poiché il fluoroforo emette una luce di colore brillante. Localizzando questi fluorofori nell’area di interesse è possibile ottenere un’immagine chiara di qualsiasi parte di una cellula, rendendo la microscopia a fluorescenza un potente strumento per le scienze della vita.
Brightfield vs Fluorescence Imaging
Nella microscopia brightfield, il campione viene illuminato con luce bianca trasmessa. Ciò crea un’illuminazione uniforme del campione al microscopio per osservare campioni altamente contrastati, macchiati o naturalmente pigmentati. Tuttavia, brightfield non è sufficiente per distinguere tra cellule trasparenti/traslucide, non colorate o strutture cellulari per studiare i processi di interesse.
La microscopia a fluorescenza si basa sull’uso di fluorofori, molecole che emettono luce di una specifica lunghezza d’onda visibile quando esposte a luce di una diversa lunghezza d’onda. Quando questi fluorofori sono legati a una struttura mirata di interesse, i fotoni emessi dal fluoroforo possono essere utilizzati per visualizzare questa struttura di interesse. Il vantaggio della microscopia a fluorescenza è che le strutture mirate sono illuminate mentre le aree indesiderate del campione hanno poca o nessuna fluorescenza, consentendo un facile targeting e imaging.
Perché le molecole Fluoresce
L’origine della fluorescenza sono gli elettroni che si muovono liberamente attorno al fluoroforo attivo e rilasciano energia assorbita, come visto in Fig.2.
Prima dell’eccitazione, gli elettroni sono nello stato di energia più basso a loro disposizione – lo stato fondamentale (S0). Quando un elettrone viene colpito con un fotone di un certo intervallo di energia, l’elettrone assorbe l’energia del fotone e salta fino a uno stato di energia superiore (S1, S2 o S3). Per tornare allo stato fondamentale (S0), l’elettrone rilascia l’energia aggiuntiva come emissione di un fotone. L’energia di questo fotone è inferiore all’energia di eccitazione, quindi ha una lunghezza d’onda più lunga. Questo è il motivo per cui la luce di emissione ha una lunghezza d’onda più lunga della luce di eccitazione e può apparire come un colore diverso.
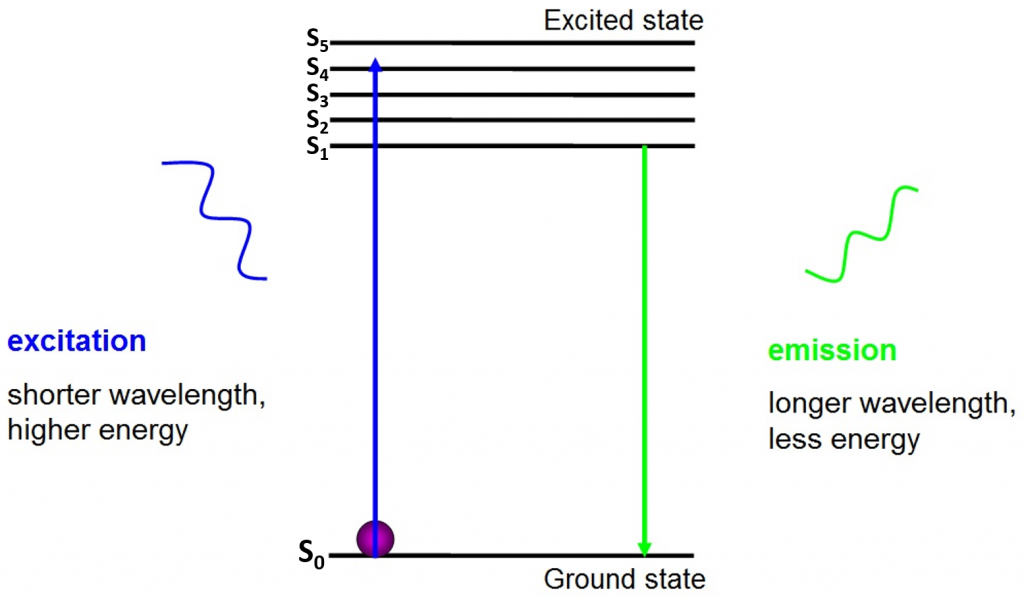
Il fotone emesso è di solito nello spettro visibile e può essere visto al microscopio se ci sono abbastanza fluorofori eccitati. La lunghezza d’onda del fotone rilasciato è specifica per ogni fluoroforo e questa prevedibilità consente una facile imaging a fluorescenza.
Fattori di intensità della fluorescenza
Mentre i fluorofori possono emettere fluorescenza di una lunghezza d’onda prevedibile, è anche importante sapere quali fattori controllano l’intensità della fluorescenza. Senza un’emissione abbastanza intensa di luce, la fluorescenza non sarà rilevabile con un microscopio.
Resa quantistica
La resa quantistica (ϕ) di un fluoroforo è il rapporto tra il numero di fotoni rilasciati e il numero di fotoni assorbiti. La resa quantistica è spesso espressa come un valore da 0-1, che 1 è l’efficienza del 100% della conversione dei fotoni. È anche importante notare che ogni fluoroforo ha un pH unico, una forza ionica e una temperatura per un’efficienza di fluorescenza ottimale.
Coefficiente di estinzione
Ogni fluoroforo ha una diversa capacità di assorbire i fotoni anche se si trovano all’interno di un intervallo di lunghezze d’onda appropriato per eccitarlo. Se un fluoroforo è esposto a un fotone che corrisponde adeguatamente alla sua lunghezza d’onda di eccitazione, la probabilità che un fotone venga assorbito è una caratteristica misurabile e nota come coefficiente di estinzione (ε).
Il rendimento quantico e il coefficiente di estinzione di un fluoroforo sono spesso visualizzati insieme per descrivere quanto brillante è dimostrato che il fluoroforo è in ambienti sperimentali.
Durata della fluorescenza
Quando un elettrone fluoroforo assorbe un fotone non rilascia immediatamente un fotone a lunghezza d’onda più lunga. È noto che il rilascio di una certa energia tra stati energetici eccitati richiede diverse lunghezze di tempo. La quantità di tempo che un elettrone trascorre nello stato eccitato prima di rilasciare un fotone e tornare allo stato fondamentale è una misura della sua durata di fluorescenza. La durata di ogni fluoroforo è unica e può essere misurata sperimentalmente. Quando si utilizzano coloranti fluorescenti sperimentalmente, è utile per la loro vita, soprattutto per applicazioni che richiedono alta velocità, come i neuroni di imaging del calcio.
Intensità della lunghezza d’onda di eccitazione
La maggior parte delle configurazioni di microscopia fluorescente include una fonte di luce che può essere sintonizzata per emettere la gamma di lunghezze d’onda desiderata. Molte sorgenti luminose fluorescenti possono anche essere regolate per l’intensità di eccitazione per aumentare il numero di fotoni che si muovono attraverso il percorso della luce. In un campione fluorescently-marcato che è esposto alla sua lunghezza d’onda di eccitazione, ogni fluoroforo non sarà attivato allo stesso tempo. Aumentando l’intensità di eccitazione e aumentando il numero di fotoni che raggiungono il campione, c’è una maggiore probabilità che più fluorofori siano eccitati.
Fotostabilità
La fotostabilità è la capacità di una molecola o di un organismo di resistere ai danni. Nella microscopia a fluorescenza, i fluorofori alla fine smettono di assorbire i fotoni in arrivo e entrano in uno stato scuro permanente. Come un organismo raccoglie più fluorofori nello stato scuro, l’aspetto del bersaglio etichettato si riduce e il campione si dice che sia photobleaching. Nella microscopia a fluorescenza, vengono spesso adottate misure per ridurre la quantità di photobleaching sperimentato durante la sperimentazione. Alcune misure includono una riduzione dell’intensità della luce che interagisce con il campione e l’uso di coloranti fluorescenti specializzati che non rimangono attivi fino a quando altri coloranti.
Microscopia a fluorescenza
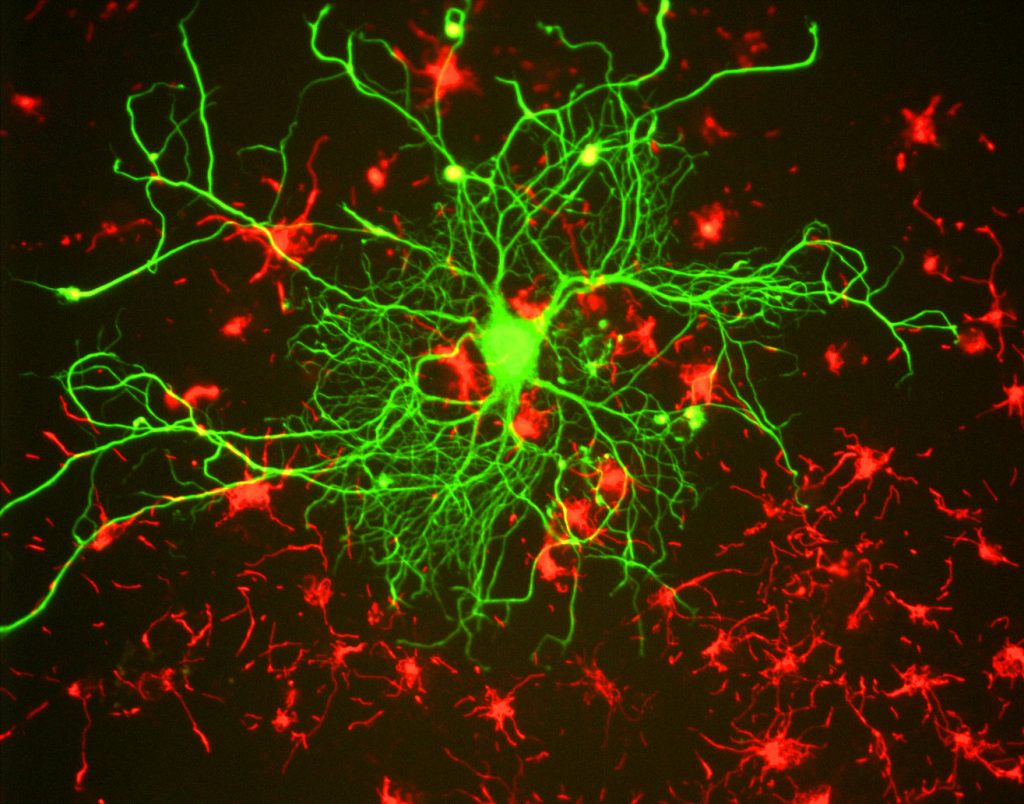
Per i ricercatori, il principale vantaggio della fluorescenza è la capacità di utilizzare la microscopia a fluorescenza, in cui i campioni sono etichettati/colorati con una sostanza fluorescente come un colorante, un anticorpo o una proteina, consentendo alle immagini di avere contrasto. Prendendo di mira queste etichette fluorescenti, i ricercatori possono selezionare ciò che vogliono vedere. Questo è dimostrato in Fig.3, dove un neurone può essere visto chiaramente tra gli astrociti, in quanto sono etichettati con diversi colori di marcatore fluorescente.
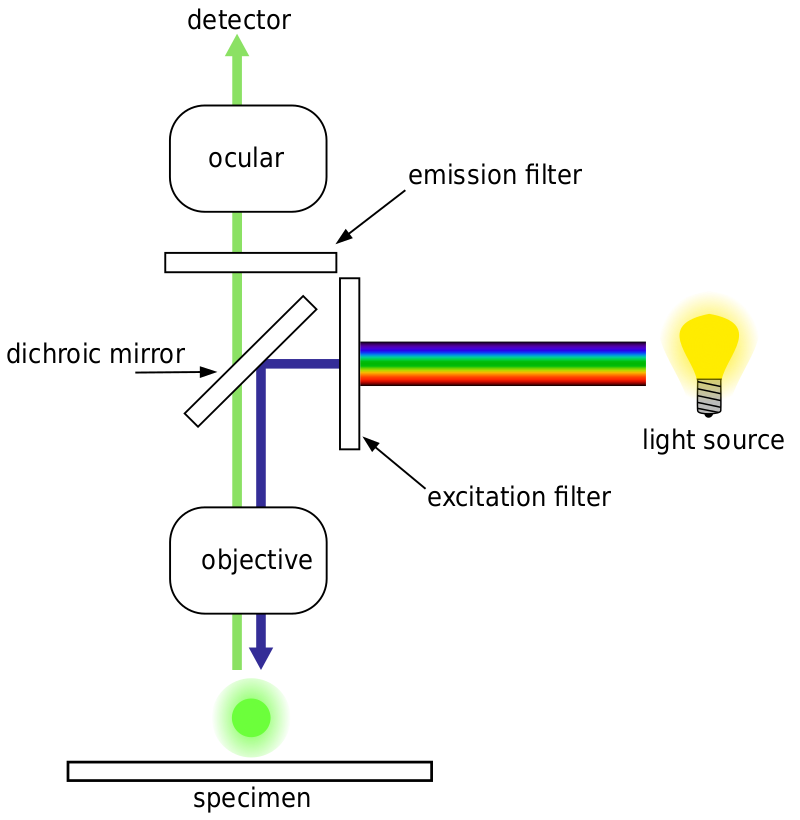
In generale, per la microscopia a fluorescenza, un campione è etichettato con marcatori fluorescenti (tipicamente specifici per alcune parti del campione). Il campione viene quindi illuminato con la lunghezza d’onda di eccitazione specifica per il fluoroforo e la fluorescenza di emissione risultante viene ricevuta dal rivelatore, solitamente una telecamera scientifica sensibile.
La maggior parte dei microscopi a fluorescenza sono microscopi a epifluorescenza, dove l’eccitazione e l’emissione vengono eseguite attraverso lo stesso percorso luminoso. Sia l’illuminazione di eccitazione che la fluorescenza emessa passano attraverso l’obiettivo del microscopio e di solito vengono filtrati per rilevare la fluorescenza. Questa configurazione è mostrata in Fig.4.
Autofluorescenza
Alcune strutture, organismi biologici e campioni di microscopia generale possono presentare naturalmente fluorescenza, nota come autofluorescenza. Questo è diverso dalla fluorescenza dei campioni etichettati, ma spesso condivide lunghezze d’onda simili, il che significa che i campioni di microscopia autofluorescenza possono oscurare la fluorescenza aggiunta artificialmente e interferire con il rilevamento, riducendo il segnale. È importante sapere se i campioni presentano autofluorescenza, in quanto ciò influirà su qualsiasi imaging a fluorescenza fatto a meno che non vengano utilizzate lunghezze d’onda specifiche per evitarlo.
Esempi comuni di oggetti autofluorescenti sono mitocondri, lisosomi, collagene e alcuni aminoacidi come triptofano, tirosina e fenilalanina. In particolare, l’autofluorescenza è comune nelle piante a causa del loro uso di clorofilla e altre molecole fluorescenti come lignine e caroteni. Fico.5 mostra i diversi colori di autofluorescenza da un campione di pino scozzese senza etichetta.
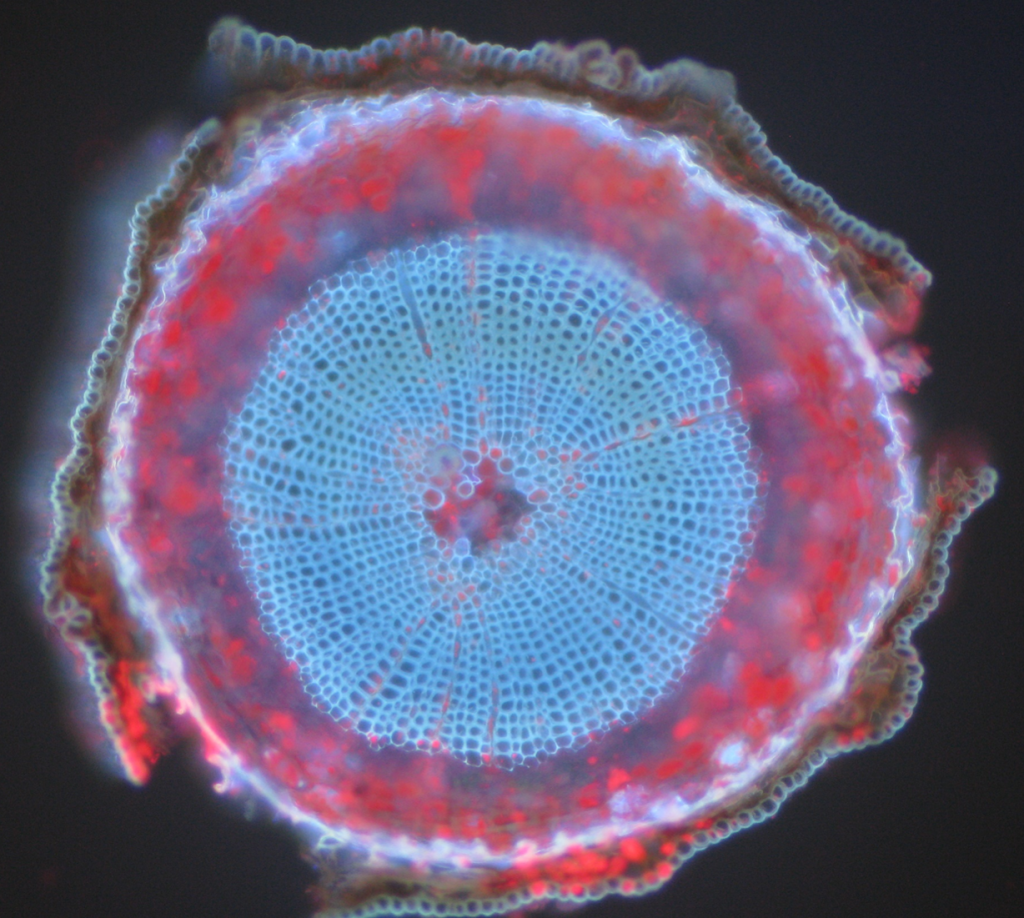
Sommario
Sin dall’introduzione del primo colorante fluorescente, la microscopia a fluorescenza è stata ampiamente utilizzata per visualizzare le cellule e le strutture cellulari con una maggiore specificità rispetto alle tradizionali tecniche di microscopia a campo luminoso. I ricercatori possonomanipolare la struttura, le proprietà ottiche e la sonda di esperimenti di influorescenza di interesse per ottenere dati rilevanti. Tale flessibilità ha permesso di includere la microscopia a fluorescenza in molti esperimenti di scienze della vita.
A seconda del tipo di campione e fluoroforo, una telecamera scientifica deve essere accuratamente selezionata per ottenere i migliori risultati di imaging.
- Microscopia ottica. (2009) Pietre miliari della natura. MacMillan Publishers Limited, 6-22.
- Lavis, L. D., & Raines, RT (2008). Idee brillanti per la biologia chimica. ACS Chemical Biology, 3(3): 142-155.
- Liu, Y., Lilly, D. (2017) Strutture cristalline se i fluorofori di cianina si accumulano all’estremità dell’RNA a doppio filamento. Biophysical Journal, 113, (11): 2236-2343.
- Berezin, M. Y., Achilefu, S. (2010). Misure di durata della fluorescenza e imaging biologico. Recensioni chimiche, 110 (5): 2641-2684.
- Stockert, J., Blazquez-Castro, A. (2017) Microscopia a fluorescenza nelle scienze della vita. Sharjah, Emirati Arabi Uniti. Bentham Science Publishers.
- Berezin, M. Y., & Achilefu, S. (2010). Misure di durata della fluorescenza e imaging biologico. Recensioni chimiche, 110 (5): 2641-2684.
- Denk, W., Strickler, J., Webb, W. (1990). Microscopia a fluorescenza a scansione laser a due fotoni. Scienza. 248, (1951): 73-76.
- So, P. (2002). Microscopia a fluorescenza a due fotoni. Gruppo editoriale Macmillan.
- Schermelleh, L., Heinztmann, R., e Leonardt, H. (2010). Una guida alla microscopia a fluorescenza a super risoluzione. Il Journal of Cell Biology 190 (2): 165-175.
- Betzig, E., Patterson, G. H., Sougrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., Davidson, M. W., LippincottSchwartz, J., Hess, H. F. (2006) Imaging di proteine fluorescenti intracellulari a risoluzione nanometrica. Scienza. 313(5793): 1642-5
- Rust, M. J., Bates ,M. & Zhuang, X. (2006) Imaging sub-diffrazione-limite mediante microscopia di ricostruzione ottica stocastica (STORM). Metodi Nat. 2, (10):793-5.
- Rego, E., Shao, L., Macklin, J. Winoto, L., Johansson, G., Kamps-Hughes, N., Davidson, M., e Gustasson, M. (2010) PNAS. 109 (3): e135-a143.
- Jungmann, R., Avendaño, MS, Woehrstein, JB, Dai, M., Shih, WM & Yin, P. (2014) Multiplexing 3D cellular super-resolution imaging con DNA-PAINT e Exchange-PAINT. Metodi Nat. 11(3): 313-318
- Jiang, X., Wang, L., Carroll, S., Chen, J., Wang, M., e Wang, J. (2018) Challenges and Opportunities for Small Molecule Fluorescent Probes in Redox Biology Applications. Antioxidants & Redox Signaling. Mary Ann Liebert, Inc.