Le cisti pancreatiche rappresentano una piccola entità ancora sempre più rilevata di anomalie pancreatiche. Circa il 70% delle lesioni cistiche pancreatiche sono scoperte incidentalmente. Le cisti pancreatiche neoplastiche più frequentemente riscontrate includono neoplasia mucinosa papillare intraduttale (IPMN), cistoadenoma sieroso (SCA), neoplasia cistica mucinosa con stroma ovarico (MCN) e neoplasia epiteliale pseudopapillare solida. IPMN è ulteriormente suddiviso in branch duct (BD), condotto principale e forme combinate. Insieme, questi costituiscono il 90% dei tumori pancreatici precancerosi, principalmente cistici. Al contrario, la pseudocisti, la vera cisti epiteliale, la cisti linfoepiteliale e la cisti non neoplastica mucinosa non hanno alcun potenziale maligno.
La malignità si verifica solo nelle cisti mucinose. La SCA è considerata una lesione non maligna e i tumori sierici maligni riportati in letteratura non sono stati trovati per soddisfare i criteri dell’OMS per la SCN. L’IPMN può progredire da gradi più bassi a più alti di displasia e, in definitiva, adenocarcinoma duttale pancreatico (PDAC). Le IPMN che coinvolgono il condotto principale hanno un tasso di malignità più elevato rispetto a quelli nei rami, con il rischio di malignità stimato al 62%; il rischio di malignità delle MCN è inferiore al 15%. Altre lesioni cistiche più rare, come la neoplasia epiteliale pseudopapillare solida e il tumore neuroendocrino pancreatico cistico (cPNET), tendono a presentare caratteristiche che suggeriscono una diagnosi specifica, che di solito porta alla rimozione chirurgica.
Per studiare la frequenza delle cisti pancreatiche incidentali in individui asintomatici, Kromrey ha eseguito un esame di colangiopancreatografia a risonanza magnetica (MRCP) in 1077 partecipanti arruolati in uno studio di coorte basato sulla popolazione. Del gruppo originale, 676 persone sono state sottoposte a un esame ripetuto 5 anni dopo. Al momento dell’esame iniziale, il 49% aveva almeno una cisti ≥2 mm di diametro. L’incidenza di nuove cisti durante il periodo di follow-up è stata del 2,6% all’anno. La presenza di cisti era fortemente correlata all’età; a 75 anni, il 75% dei partecipanti aveva una o più cisti. La discriminazione tra cisti pancreatiche benigne e premaligne o maligne è di grande importanza in modo da evitare procedure inutili, come esami radiologici di follow-up o resezione chirurgica.
Neoplasia cistica mucinosa con stroma ovarico (MCN)
Le MCN sono comuni nelle donne di mezza età, sono generalmente ben definite e sono prevalentemente nella coda del pancreas (>90%). Rispetto ai tumori cistici sierosi, gli MCN sono più grandi (> 20 mm di diametro) e meno numerosi (di solito < 6). Il comportamento biologico di MCNs è variabile, e diversi modelli istologici spesso coesistono nello stesso tumore. I tumori possono essere interamente benigni, così come i cistoadenomi mucinosi o gli adenomi mucinosi papillari intraduttali. Alcuni tumori sono borderline, mostrando displasia cellulare, mentre altri sono francamente maligni. Il cistoadenocarcinoma maligno e i carcinomi mucinosi intramidollari possono essere ulteriormente suddivisi in tipi non invasivi e invasivi.
(Le caratteristiche radiologiche di MCNs sono dimostrate nelle immagini qui sotto.)
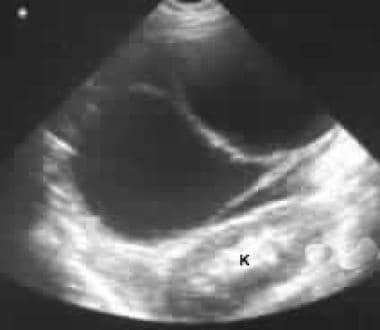 L’ecografia attraverso l’ipocondrio sinistro mostra una grande massa settata anteriore al rene (K).
L’ecografia attraverso l’ipocondrio sinistro mostra una grande massa settata anteriore al rene (K). 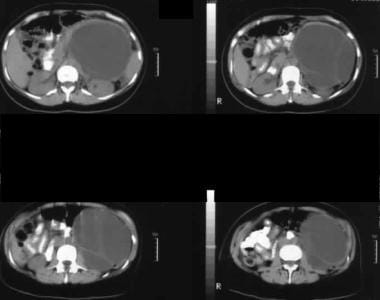 Scansioni TC assiali non potenziate. L’immagine 1 mostra una grande massa settata nell’ipocondrio sinistro. Si noti il contorno esterno liscio tipico di una neoplasia cistica mucinosa.
Scansioni TC assiali non potenziate. L’immagine 1 mostra una grande massa settata nell’ipocondrio sinistro. Si noti il contorno esterno liscio tipico di una neoplasia cistica mucinosa. Neoplasia mucinosa papillare intraduttale (IPMN)
Sulla base del coinvolgimento del dotto pancreatico, le IPMN sono classificate come dotto principale IPMN, ramo laterale IPMN o variante mista IPMN che coinvolge sia il dotto pancreatico principale che i rami laterali. Le IPMN del condotto principale hanno spesso epitelio di tipo intestinale e le IPMN del ramo laterale di solito hanno epitelio di tipo gastrico. Sebbene tutte le varianti morfologiche di IPMN possano progredire verso il cancro, l’adenocarcinoma invasivo originario di IPMNs di tipo gastrico è associato a un tasso di sopravvivenza significativamente peggiore rispetto a quello proveniente da altri tipi di IPMNs. Tuttavia, le caratteristiche di imaging non sono specifiche per differenziare le varie varianti istologiche di IPMNs.
Le IPMN laterali sono comunemente rilevate negli uomini più anziani e si trovano più frequentemente nel pancreas prossimale (testa e processo uncinato). Un’importante caratteristica di differenziazione tra MCN e IPMN è la visualizzazione della comunicazione duttale pancreatica. Se viene visualizzato un chiaro canale di comunicazione con il dotto pancreatico, la diagnosi di IPMN laterale è quasi certa perché SCAS e MCN non comunicano con il sistema duttale pancreatico.
Nonostante la bassa incidenza di aggressività delle lesioni cistiche mucinose di 3 cm e più piccole, l’incidenza non è abbastanza bassa da respingere completamente le lesioni e un’attenta revisione delle caratteristiche di imaging è obbligatoria. Inoltre, i pazienti le cui condizioni non sono adatte per la gestione chirurgica spesso necessitano di valutazioni frequenti per la crescita e il cambiamento delle caratteristiche dell’imaging.
(IPMNs sono visti nelle immagini qui sotto.)
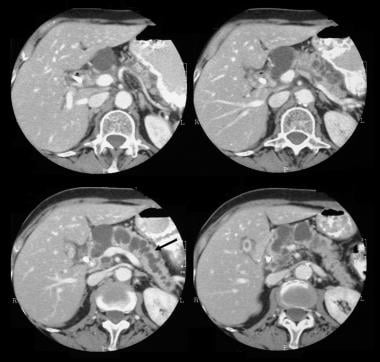 Tumore mucinoso papillare intraduttale pancreatico (IPMT). Le scansioni TC assiali potenziate dal contrasto attraverso il pancreas mostrano un tumore cistico di 5,5 cm nella testa del pancreas. Si noti la dilatazione a monte e grossolana del dotto pancreatico. Anche il dotto pancreatico accessorio è dilatato.
Tumore mucinoso papillare intraduttale pancreatico (IPMT). Le scansioni TC assiali potenziate dal contrasto attraverso il pancreas mostrano un tumore cistico di 5,5 cm nella testa del pancreas. Si noti la dilatazione a monte e grossolana del dotto pancreatico. Anche il dotto pancreatico accessorio è dilatato. 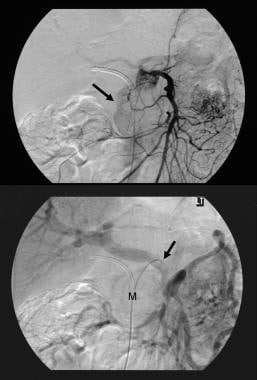 Tumore mucinoso papillare intraduttale pancreatico (IPMT). (Top) L’angiogramma mesenterico superiore mostra la vascolarizzazione capillare nella massa nella testa pancreatica durante la fase arteriosa. (In basso) L’immagine della fase venosa portale mostra lo spostamento dei rami venosi portale e l’involucro della giunzione della vena mesenterica superiore e della vena porta. M indica la massa pancreatica.
Tumore mucinoso papillare intraduttale pancreatico (IPMT). (Top) L’angiogramma mesenterico superiore mostra la vascolarizzazione capillare nella massa nella testa pancreatica durante la fase arteriosa. (In basso) L’immagine della fase venosa portale mostra lo spostamento dei rami venosi portale e l’involucro della giunzione della vena mesenterica superiore e della vena porta. M indica la massa pancreatica. 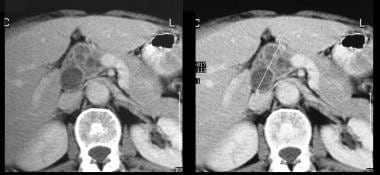 Tumore mucinoso papillare intraduttale pancreatico (IPMT). Le scansioni TC assiali potenziate dal contrasto attraverso il pancreas mostrano un tumore multiseptato nella testa del pancreas.
Tumore mucinoso papillare intraduttale pancreatico (IPMT). Le scansioni TC assiali potenziate dal contrasto attraverso il pancreas mostrano un tumore multiseptato nella testa del pancreas. 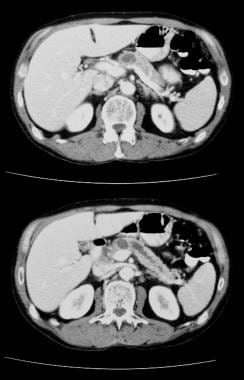 Tumore mucinoso papillare intraduttale pancreatico (IPMT). Le scansioni TC potenziate dal contrasto attraverso il pancreas mostrano una dilatazione grossolana del dotto pancreatico. All’intervento chirurgico, l’IPMT è stato confermato.
Tumore mucinoso papillare intraduttale pancreatico (IPMT). Le scansioni TC potenziate dal contrasto attraverso il pancreas mostrano una dilatazione grossolana del dotto pancreatico. All’intervento chirurgico, l’IPMT è stato confermato. Cistoadenomi sierosi
I cistoadenomi sierosi (adenomi microcistici) (vedi le immagini sotto) sono i secondi tumori cistici più comuni del pancreas. La presentazione clinica dei cistoadenomi sierici è simile a quella dei tumori pancreatici cistici mucinosi.
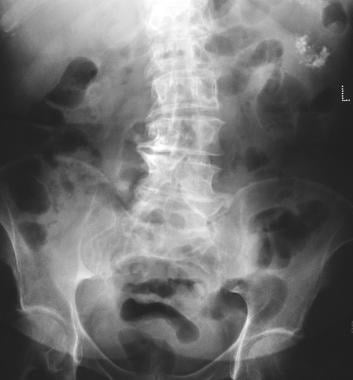 Adenoma microcistico pancreatico. La radiografia normale mostra la calcificazione del tumore in un adenoma microcistico (quadrante superiore sinistro). La calcificazione nell’adenoma microcistico si presenta come un ammasso centrale disposto in uno sprazzo di sole o in una disposizione stellata. La calcificazione centrale è meglio valutata con TC che con radiografia.
Adenoma microcistico pancreatico. La radiografia normale mostra la calcificazione del tumore in un adenoma microcistico (quadrante superiore sinistro). La calcificazione nell’adenoma microcistico si presenta come un ammasso centrale disposto in uno sprazzo di sole o in una disposizione stellata. La calcificazione centrale è meglio valutata con TC che con radiografia. 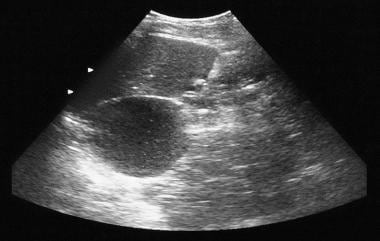 . L’ecografia mostra una massa cistica nella regione della coda del pancreas.
. L’ecografia mostra una massa cistica nella regione della coda del pancreas. 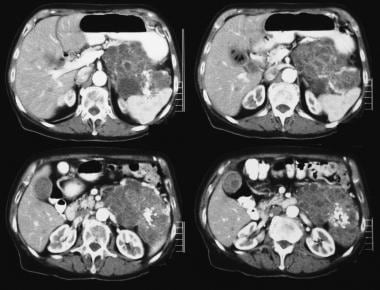 Adenoma microcistico pancreatico. Le scansioni TC assiali potenziate dal contrasto mostrano un tumore ipervascolare nella coda pancreatica con calcificazione dello sprazzo di sole. Nota il miglioramento del formaggio svizzero.
Adenoma microcistico pancreatico. Le scansioni TC assiali potenziate dal contrasto mostrano un tumore ipervascolare nella coda pancreatica con calcificazione dello sprazzo di sole. Nota il miglioramento del formaggio svizzero. A causa del crescente uso di imaging trasversale, molti di questi tumori sono rilevati come un reperto incidentale e asintomatico.
Sulle immagini in sezione trasversale, i cistoadenomi sierici appaiono come numerose piccole cisti separate da delicati setti fibrosi, che conferiscono loro un aspetto a nido d’ape. Le cisti sono piene di liquido chiaro e acquoso e sono spesso disposte attorno a una cicatrice stellata centrale, che può essere calcificata. Nelle scansioni TC, la calcificazione centrale dello sprazzo di sole in una massa spugnosa è patognomonica di questo tumore, ma questa scoperta si verifica solo nel 10% dei pazienti.
L’ecografia endoscopica (EUS) consente una migliore risoluzione della struttura a nido d’ape rispetto alla TC. A volte, le cisti possono essere grandi, una caratteristica che rende difficile differenziare queste cisti da MCN.
L’ipervascolarità può essere dimostrata su angiogrammi e alcuni tumori si verificano con emorragia intra-addominale.
Diagnosi differenziali
Pseudocisti pancreatiche o raccolte di liquidi pancreatici
Le raccolte di liquidi si verificano in ben il 50% dei casi di pancreatite acuta. Le pseudocisti sono solitamente viste come spazi fluidi anecogeni sui sonogrammi, ma possono mostrare echi interni se contengono tessuto necrotico o coagulo.
I risultati di imaging che suggeriscono una diagnosi di pseudocisti piuttosto che di neoplasia cistica includono quanto segue: mancanza di septae, loculazioni, componenti solidi o calcificazioni della parete cisti su scansioni tomografiche computerizzate (TC); ipovascolarità su angiogrammi; e comunicazione tra cisti e dotti pancreatici su colangiopancreatografia retrograda endoscopica (ERCP). La maggior parte delle pseudocisti sono extrapancreatiche, mentre le neoplasie cistiche pancreatiche sono intrapancreatiche.
Ascesso pancreatico
L’ascesso pancreatico è solitamente secondario all’infezione di una pseudocisti, ma in rari casi può verificarsi a seguito di diffusione diretta da infezione renale o del colon. Tipicamente, un ascesso pancreatico si verifica 2-4 settimane dopo un episodio di pancreatite acuta.
Sulle immagini, questi ascessi possono apparire simili alle pseudocisti. Generalmente, l’aspetto dipende dalla loro età. Nella fase acuta, i cambiamenti possono essere sottili, con solo la perdita del normale contorno pancreatico associato all’obliterazione del contorno pancreatico e degli spazi vascolari peripancreatici e di altri tessuti molli. Questi cambiamenti possono essere indistinguibili da quelli riscontrati nella pancreatite acuta grave. Negli stadi subacuti e cronici, quando si verifica la necrosi centrale, di solito si osserva una massa cistica anecogena o complessa. Un livello di detriti può essere osservato nella porzione dipendente dell’ascesso. Nella fase subacuta o cronica, attraverso la trasmissione è solitamente buona tranne quando il gas è presente all’interno dell’ascesso. In presenza di gas, l’ascesso può diventare ecogenico e può ombreggiare.
Le pareti dell’ascesso pancreatico subacuto e cronico hanno caratteristiche variabili. Le pareti possono essere spesse, irregolari e ben definite, o l’ascesso può non avere alcun muro definibile. I risultati ecografici non sono specifici, ma nell’ambito clinico appropriato, una diagnosi di un ascesso può essere suggerita e confermata mediante aspirazione percutanea o TC.
Cisti parassitarie
Sono state descritte cisti di echinococcus granulosis e cisti multilocularis del pancreas, sebbene il coinvolgimento pancreatico sia eccezionalmente raro. E. le cisti di granulosi possono essere uniloculari, multiloculari o cistiche complesse.
Sulla sola imaging, la differenziazione di queste e di altre masse cistiche è difficile. I test sierologici possono essere utili nel contesto clinico appropriato. E. le cisti multilocularis mostrano un pattern infiltrativo ecogenico. Questa diagnosi dovrebbe essere intrattenuto nelle regioni endemiche quando un tale modello è visto.
Tumori pancreatici epiteliali solidi e papillari
Il neoplasma epiteliale solido e papillare del pancreas può essere solido o cistico. Questi sono tumori rari che vengono spesso scambiati per tumori secernenti mucina o adenomi non funzionanti.
I tumori pancreatici epiteliali solidi e papillari si trovano più spesso nella coda pancreatica. Sono masse grandi e ben incapsulate con aree di emorragia e necrosi. Sui sonogrammi, appaiono come masse eterogenee, rotonde e solide con un centro necrotico cistico e calcificazione distrofica, che può ombreggiare.
Cisti disontogene
Le cisti disontogene sono cisti amartomatose che sono spesso associate a cisti renali, angiomi cerebellari ed encephalocele. L’imaging rivela una cisti grande e sottile con una configurazione di gelso.
Pseudoaneurismi
Gli pseudoaneurismi di solito non sono veramente intrapancreatici e possono essere confusi con una cisti pancreatica. Questi aneurismi sono una complicazione della pancreatite nel 3,5-10% dei pazienti. L’ecografia doppler può mostrare un flusso arterioso turbolento all’interno di uno pseudoaneurisma, mentre l’ecografia Doppler a flusso di colore mostra un flusso bidirezionale e un vortice all’interno della massa anecoica. L’imaging doppler può consentire l’identificazione provvisoria dell’arteria che alimenta lo pseudoaneurisma.
Neurofibroma retroperitoneale o schwannoma
Questi tumori possono essere iperecogeni o ipoecogeni/lesioni cistiche con echi interni sporadici. Questa è una caratteristica comune nei tumori più grandi in cui si sono verificate degenerazione cistica ed emorragia. I tumori sono retroperitoneali ma possono imitare le masse pancreatiche.
Sarcoma pancreatico
Il sarcoma pancreatico è un tumore raro delle strutture di supporto mesenchimali del pancreas. È una massa relativamente sonolucente e può essere scambiata per una raccolta fluida o pseudocisti. I risultati ecografici possono essere normali, o i sonogrammi possono dimostrare una massa retroperitoneale, che è relativamente sonolucente rispetto ai tessuti circostanti. Pertanto, questa lesione può essere confusa con una massa pancreatica cistica.
Linfoma pancreatico
Il linfoma pancreatico primario è raro. La presentazione clinica non è dissimile da quella del carcinoma pancreatico. L’ecografia può rivelare una massa omogenea, sonolucente o complessa. Queste masse sono di solito eco-poveri e possono imitare lesioni cistiche. Poiché la prognosi di un linfoma pancreatico è favorevole, la sua differenziazione da un carcinoma è cruciale. La correlazione dei risultati ecografici, TC e angiografici può portare a una diagnosi corretta. Tuttavia, se esiste un dubbio, la biopsia guidata dall’ecografia può rivelare la vera natura della massa.
Carcinoma a cellule acinari pancreatiche
I carcinomi a cellule pancreatiche (PACC) costituiscono circa l ‘ 1% dei tumori pancreatici esocrini. PACC è una neoplasia epiteliale con evidenza di differenziazione acinare. I pazienti con carcinoma a cellule acinari hanno una prognosi migliore rispetto ai pazienti con adenocarcinomi di tipo duttale, ma una prognosi peggiore rispetto ai pazienti con tumori endocrini pancreatici. Su CT, PACC è stato descritto in vari modi, anche come una massa densa mal definita; come una massa ben definita con necrosi centrale; e come una massa cistica circondata da una spessa parete ipervascolare.
Esame preferito
La risonanza magnetica è la tecnica preferita per la diagnosi dei tumori pancreatici cistici. Le risonanze magnetiche sono di solito utili per differenziare tra pseudocisti e neoplasie cistiche. La colangiopancreatografia a risonanza magnetica (MRCP) può rappresentare l’anatomia del dotto biliare e pancreatico in modo non invasivo e aiuta nella diagnosi dei tumori intraduttali.
L’ecografia è generalmente la prima tecnica in un paziente con sintomi epigastrici. Questa è una modalità eccellente per la diagnosi delle masse pancreatiche cistiche. L’ecografia offre anche l’opportunità di un intervento guidato, come l’aspirazione e la biopsia. L’ecografia doppler fornisce un ulteriore vantaggio nella valutazione dei tumori ipervascolari e della trombosi/occlusione vascolare associata a tumori pancreatici. Echo-enhanced power Doppler sonography ha un’elevata sensibilità e specificità nella diagnosi differenziale dei tumori pancreatici.
In casi equivoci o in casi in cui la malignità è altamente sospettata, EUS-FNA fornisce la migliore resa diagnostica, in quanto consente l’acquisizione di campioni citologici e liquido cistico per l’analisi di vari marcatori tumorali.
Occasionalmente, nonostante la valutazione completa di una massa cistica, il tipo di cisti può rimanere indeterminato. Sebbene costoso e invasivo, l’ecografia laparoscopica, la biopsia della parete cistica e l’analisi dell’aspirato cistico contribuiscono in modo significativo alla diagnosi differenziale delle lesioni cistiche pancreatiche.
La TC mostra calcificazione tumorale ed è una modalità eccellente per la rilevazione di metastasi locali e distanti. Sebbene la TC e la RM non possano essere utilizzate per differenziare il contenuto di mucina dal succo pancreatico, la comunicazione tra la lesione cistica e l’MPD dilatato e una papilla sporgente con un orifizio patulo sono caratteristiche dell’IPMT. L’architettura interna dei tumori mucinosi è visualizzata almeno altrettanto bene sulle scansioni di MRI come è sulle scansioni di CT, con l’eccezione di calcificazione all’interno della lesione (che MRI ha soltanto una capacità limitata di rivelare).
La TC a spirale e/o multisezione sono tecniche eccellenti per l’imaging del pancreas, fornendo una risoluzione spaziale superba e dettagli anatomici. Con collimazione sottile e fasi arteriose e venose e ricostruzioni multiplanari e/o 3-dimensionali (3D), viene raffigurato un eccellente dettaglio dell’anatomia vascolare; la maggior parte dei centri ora usa raramente l’angiografia per valutare i tumori pancreatici.
Le radiografie semplici sono spesso ottenute per cercare la calcificazione pancreatica. Gli studi di bario GI superiore possono essere eseguiti nel contesto del dolore epigastrico. Con i tumori pancreatici, gli studi di bario possono descrivere lo spostamento estrinseco dello stomaco e del duodeno.
Limitazioni delle tecniche
La risonanza magnetica non è universalmente disponibile, è costosa e rappresenta un problema per i pazienti con claustrofobia. Le linee guida ACG raccomandano cautela quando si utilizza l’imaging per diagnosticare il tipo di cisti o malignità concomitante; l’accuratezza della risonanza magnetica o MRCP nella diagnosi del tipo di cisti è del 40-50% ed è del 55-76% nel determinare tumori benigni o maligni.
Il gas viscerale, l’habitus del paziente e la dipendenza dell’operatore limitano il valore dell’ecografia. L’ecografia laparoscopica è invasiva. L’imaging EUS non può distinguere in modo affidabile le IPMN benigne da quelle maligne e non è chiaro se le caratteristiche di imaging delle lesioni mucinose con un aumentato potenziale maligno siano sufficientemente predittive da influenzare la gestione clinica. Quando l’istologia chirurgica viene utilizzata come standard di riferimento, l’accuratezza diagnostica dell’imaging EUS varia dal 40 al 96%. Un singolo studio prospettico ha dimostrato che la sensibilità (56%) e la specificità (45%) della sola morfologia EUS per differenziare le cisti mucinose (neoplasie cistiche mucinose e IPMNs) dalle cisti nonmucinose erano basse, con conseguente scarsa accuratezza complessiva (51%).
Le radiografie semplici e gli studi di bario GI superiore sono aspecifici e risultati simili possono essere riscontrati in una varietà di patologie. La TC comporta un carico significativo di radiazioni ionizzanti e utilizza materiale di contrasto iodato con rischio di anafilassi e nefrotossicità.
Studi trasversali, tra cui ecografia, TC e RM, non possono essere utilizzati per distinguere tra cistoadenoma mucinoso e cistoadenocarcinoma a meno che il tumore non abbia metastatizzato o invaso organi vicini. L’angiografia è aspecifica e invasiva. Richiede anche mezzo di contrasto iodato, con il rischio di anafilassi e nefrotossicità.
Imaging di follow-up
Le linee guida ACG raccomandano che la sorveglianza delle cisti sia offerta a candidati in forma chirurgica con cisti asintomatiche che si presume siano IPMNs o MCNs. Tutte le IPMN resecate chirurgicamente richiedono una sorveglianza postoperatoria, ma le MCN resecate senza cancro al pancreas non lo fanno. MRCP è la modalità preferita per la sorveglianza; EUS può anche essere lo strumento di sorveglianza primario quando le scansioni MRI sono controindicati. In assenza di caratteristiche riguardanti che giustificano una maggiore sorveglianza o un rinvio per un’ulteriore valutazione, la dimensione della cisti guida gli intervalli di sorveglianza per presunti IPMN e MCN.
Linee guida
Le linee guida per la diagnosi e la gestione delle cisti pancreatiche sono state pubblicate dalle seguenti organizzazioni:
-
l’istituto universitario Americano della Gastroenterologia (ACG)
-
Gruppo di Studio Europeo sui Tumori Cistici del Pancreas
-
American College of Radiology (ACR)
Il 2018 ACG linee guida raccomandano di imaging a risonanza magnetica (MRI) o la risonanza magnetica colangiopancreatografia (MRCP) come preferito metodica diagnostica a causa della loro invasività, la mancanza di radiazioni, e una maggiore precisione nella valutazione di comunicazione tra il dotto pancreatico principale e cisti (che è una caratteristica del ramo laterale IPMNs). La tomografia computerizzata del protocollo pancreatico (CT) o l’ecografia endoscopica (EUS) sono state considerate “alternative eccellenti” se la risonanza magnetica è controindicata. EUS aspirazione con ago sottile (FNA) e analisi del fluido cisti devono essere considerati in cisti in cui la diagnosi non è chiara e dove i risultati sono suscettibili di alterare la gestione.
Analisi del fluido cisti CEA può essere considerato per differenziare IPMNs e MCNs da altri tipi di cisti, ma non può essere utilizzato per identificare IPMNs e MCNs con displasia di alto grado o cancro al pancreas. IPMNs o Mcn con una qualsiasi delle seguenti caratteristiche dovrebbero essere sottoposti a EUS con o senza FNA e/o essere riferito ad un gruppo di lavoro multidisciplinare per un’ulteriore valutazione :
-
Qualsiasi dei seguenti segni o sintomi: ittero secondaria di cisti, pancreatite acuta secondaria a cisti, significativamente elevati livelli sierici di CA 19-9
-
Qualsiasi dei seguenti risultati di imaging: la presenza di un murale o nodulo solido componente all’interno della cisti o nel parenchima pancreatico, dilatazione del dotto pancreatico principale di >5 mm, focale, dilatazione del dotto pancreatico che è materia per dotto principale IPMN o una lesione ostruttiva, o la produzione di mucina cisti di misura ≥3 cm di diametro
-
La presenza di displasia o cancro del pancreas sulla citologia
Il 2018 linee guida Europee raccomandano anche la RM come il metodo preferito per la diagnosi delle neoplasie cistiche del pancreas (PCN). L’imaging multimodale deve essere considerato nei casi in cui l’identificazione della calcificazione è importante, per la stadiazione del tumore o per diagnosticare la malattia ricorrente postoperatoria. Tuttavia, l’accuratezza rimane relativamente bassa per identificare il tipo specifico di PCN, per differenziare il piccolo PCN dalle cisti nonoplastiche o nonepiteliali, o per il collegamento al sistema duttale. La TC deve essere presa in considerazione nelle seguenti situazioni cliniche :
-
Per la rilevazione di calcificazione parenchimale, murale o centrale, e soprattutto quando si differenziano le pseudocisti associate a pancreatite cronica da neoplasie cistiche pancreatiche
-
Quando c’è sospetto di malignità o cancro pancreatico concomitante e quando è richiesta la valutazione del coinvolgimento vascolare, della malattia peritoneale o della malattia metastatica.
-
Quando vi è il sospetto di recidiva postoperatoria del cancro al pancreas.
Le linee guida europee trovano EUS utile per identificare PCN con caratteristiche che dovrebbero essere considerati per la resezione chirurgica. Simile a MRI e CT, EUS ha una bassa precisione per identificare il tipo esatto di PCN. EUS-FNA migliora l’accuratezza diagnostica per differenziare il PCN mucinoso rispetto a quello non mucinoso, così come il PCN maligno rispetto a quello benigno, nei casi in cui i risultati di TC o RM non sono chiari. Ulteriori raccomandazioni per l’uso di EUS-FNA includono quanto segue:
-
EUS-FNA deve essere eseguita solo quando i risultati sono attesi per modificare la gestione clinica
-
EUS-FNA non deve essere eseguita se la diagnosi è già stabilito da cross-sectional imaging o dove c’è una chiara indicazione per la chirurgia
-
Controindicazioni Relative per EUS-FNA, nel PCN è una distanza di >10 mm tra la cisti e il trasduttore, la presenza di un alto rischio di sanguinamento a causa di sanguinamento disturbo o l’uso di dual farmaci antiaggreganti piastrinici