Adesione cellulare
L’adesione cellulare è il processo mediante il quale le cellule interagiscono con molecole specifiche sulla superficie cellulare e si attaccano alle cellule adiacenti. Questo processo può avvenire attraverso interazioni dirette o indirette tra le superfici cellulari, dove le cellule si attaccano alla matrice extracellulare circostante, che contiene le molecole rilasciate dalle cellule nello spazio tra le cellule. L’adesione cellulare si verifica quando la molecola di adesione cellulare (CAM) interagisce con una proteina transmembrana situata sulla superficie cellulare. L’adesione cellulare collega le cellule in modi diversi e può partecipare alla trasduzione del segnale per consentire alle cellule di rilevare e rispondere ai cambiamenti nell’ambiente circostante. Altri processi cellulari regolati dall’adesione cellulare includono la migrazione cellulare e lo sviluppo tissutale negli organismi multicellulari. I cambiamenti nell’adesione cellulare possono interrompere importanti processi cellulari e portare a una varietà di malattie, tra cui il cancro e l’artrite. L’adesione cellulare è anche essenziale per le malattie causate da organismi infettivi come batteri o virus.
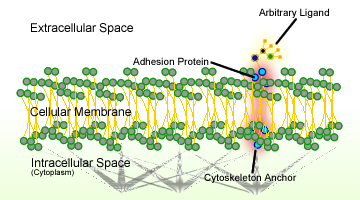 Figura 1. Schema di adesione cellulare
Figura 1. Schema di adesione cellulare
Classificazioni
Le CAM sono suddivise in quattro famiglie principali: integrine, superfamiglia di immunoglobuline (Ig), caderina e selectine. Ognuna di queste molecole di adesione ha una funzione diversa e riconosce un ligando diverso. Cadherine e immunoglobuline sono CAM omotipiche perché si legano direttamente allo stesso tipo di CAM su un’altra cellula, mentre integrine e selectine sono CAM eterologhe che si legano a diversi tipi di CAM. I difetti nell’adesione cellulare sono spesso attribuiti a difetti nell’espressione delle CAMME. Negli organismi multicellulari, il legame tra le CAMME fa sì che le cellule aderiscano l’una all’altra e formino una struttura chiamata giunzione cellulare.
In base alle loro funzioni, le giunzioni cellulari possono essere classificate come:
Giunzioni di ancoraggio (giunzioni aderenti, desmosomi ed emidesmosomi), che mantengono le cellule lungo e rafforzano il contatto tra le cellule.
Giunzioni occludenti (giunzioni strette), che sigillano gli spazi tra le cellule attraverso il contatto cellula–cellula, creando una barriera resistente all’acqua per la diffusione.
Giunzioni di formazione di canali (giunzioni di gap), che collegano il protoplasma delle cellule adiacenti permettendo il trasporto di molecole tra le cellule.
Giunzioni di inoltro del segnale, che potrebbero essere sinapsi all’interno del sistema.
In alternativa, le giunzioni cellulari possono essere classificate in 2 varietà principali in linea con ciò che interagisce con la cellula: giunzioni cellula–cellula, nel principale mediato dalle caderine, e giunzioni cellula–matrice, nel principale mediato dalle integrine.
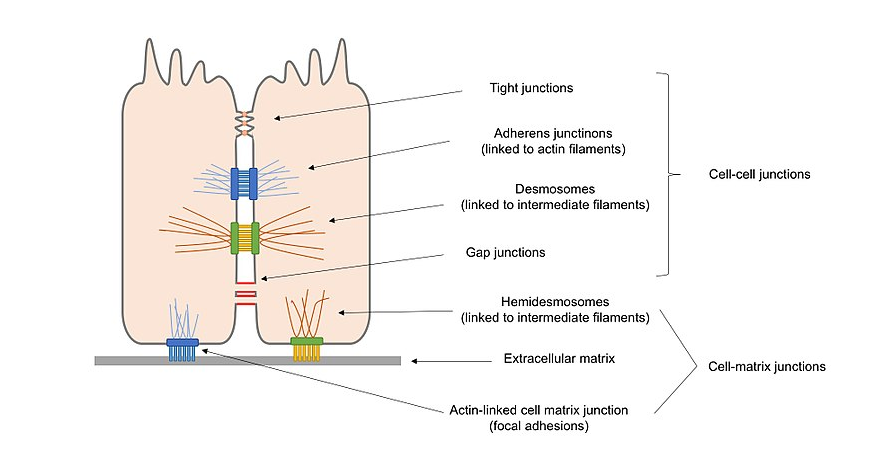 Figura 2. Schema generale dei diversi tipi di giunzioni cellulari presenti nelle cellule epiteliali, comprese le giunzioni cellula–cellula e le giunzioni cellula–matrice.
Figura 2. Schema generale dei diversi tipi di giunzioni cellulari presenti nelle cellule epiteliali, comprese le giunzioni cellula–cellula e le giunzioni cellula–matrice.
Caratteristiche strutturali delle proteine di adesione cellulare
Le proteine di adesione cellulare sono solitamente glicoproteine che mediano il riconoscimento della matrice extracellulare cellulare e cellulare sulla superficie extracellulare. La maggior parte delle molecole di adesione cellulare hanno conformazioni simili nei loro domini adesivi. Ad esempio: i domini adesivi di caderina, immunoglobulina, fibronectina di tipo III ed EGF sono prevalentemente strutture in fogli β. Il motivo comune coinvolto nell’adesione cellulare è la struttura a botte a chiave greca contenente uno o due panini β anti-paralleli.
I domini Ig-like sono una classe importante di domini a chiave greca. Hanno somiglianze di sequenza al dominio variabile o costante degli anticorpi che contengono sette-nove filamenti β anti-paralleli. I fogli P anti-paralleli formano un β-barilotto 3-D. I domini Ig-like sono stabilizzati dai legami idrofobici del disolfuro e del centro. Sono divisi in due gruppi principali: domini Ig C-like e Ig V-like.
Caratteristiche strutturali funzionalmente correlate delle proteine di adesione cellulare
Le proteine di adesione cellulare hanno diversità funzionale. L’interazione delle molecole di adesione cellulare potrebbe essere omofila o eterofila interazioni proteina-proteina o interazioni proteina-carboidrato. I cambiamenti strutturali delle molecole di adesione cellulare sono spesso correlati alle loro proprietà funzionali.
Interazioni proteina-proteina omofila.
Ad esempio, le cadherine sono molecole di adesione omofile transmembrana Ca2+-dipendenti. Le caderine sono responsabili del mantenimento delle giunzioni tra cellule simili nei tessuti. L’adesione cellulare-cellulare è mediata attraverso il dominio N-terminale delle caderine. Contiene cinque domini extracellulari simili da EC1 a EC5. Studi cristallografici a raggi X in N-caderina hanno mostrato che il dominio EC1 forma un dimero, in cui i monomeri sono orientati in parallelo con la loro superficie di legame adesivo rivolta verso l’esterno dalla membrana plasmatica. Le unità monomeriche dei domini EC1 interagiscono tra loro in modo antiparallelo, utilizzando le loro superfici di legame adesivo e formando una struttura β-barrel. Un’interfaccia putativa dell’interazione è stata suggerita per avere sia un carattere idrofobo che polare/carico che imita l’interfaccia dell’interazione dei domini delle immunoglobuline l’uno con l’altro nella superfamiglia Ig.
Interazioni proteina-proteina eterofila.
Ad esempio, il legame delle integrine a vari recettori di superficie cellulare e ligandi di matrice extracellulare è una classe importante di interazione proteina-proteina eterofila nei sistemi di adesione cellulare. Legandosi al fibrinogeno solubile, l’integrina aIIbß3 viene convertita in uno stato di legame ad alta affinità. I cambiamenti conformazionali dell’integrina indotti dal legame del legante in questo caso sono critici per la sua attività adesiva. Il legame di un recettore delle cellule T può anche modulare l’affinità di legame dell’integrina, antigene – 1 associato alla funzione leucocitaria (LFA-1), ai suoi recettori come ICAM-l o ICAM-2 (molecola di adesione cellulare intercellulare). Il legame di ICAM – l può ulteriormente indurre cambiamenti conformazionali di LFA-1. Il sito di legame adesivo della proteina si trova nel C-terminale di LFA – l basato sullo studio cristallografico a raggi X.Un tripeptide, acido arginina-glicina-aspartico (RGD), è un motivo legante ligando integrina comune. Ad esempio, il modulo di tipo III del ligando legante integrina di fibronectina ha una struttura a botte a chiave greca, il cui motivo RGD, situato all’apice del ciclo che collega i fili F e G β, media l’adesione. Raddrizzamento del RGD-loop in una conformazione fluttuante più lineare dispiegando riduce l’accessibilità del ciclo alle integrine legate alla superficie, e quindi diminuisce l’affinità e la selettività del legame.
Interazioni proteine-carboidrati.
Le selectine sono importanti nell’interazione dei linfociti e dei neutrofili con l’endotelio vascolare. Le selectine sono molecole di adesione che si legano ai carboidrati. Non ci sono ancora dati strutturali diretti sul legame delle selectine ai carboidrati. Le selectine legano i carboidrati con bassa affinità e hanno tassi di accensione e spegnimento molto veloci.