DISCUSSION
ここでは、25種のキロノミド種のゲノムサイズを決定しました。 2009)、0.13と0.21pgのDNAの間で構成されていた。 この研究の結果、キロノミドのゲノムサイズは一様に非常に小さいことが示された(図2)。 図3、表1)。 Chironomidaeファミリーの得られた平均C値は0.13+0です。03pg DNAは、D.melanogasterゲノムサイズよりも明らかに小さい。 昆虫の中で最も小さいゲノムサイズは、約0.11pgのDNA(約108Mbに相当する)を有するStrepsiptera Caenocholax fenyesiに記録されているが、ヘッセンバエMayetiola destructorも0.09pgのさらに小さいゲノムサ 2004年、グレゴリー、2014年)。 ここでは、既知の昆虫よりも小さいゲノムを持つ少なくとも三つの種を報告します:C.tsushimensis、Diamesa japonicaとHydrobaenus tsukubalatus、それぞれ0.07pg、0,08pgと0.08pgのc値を持つ(表1)。 我々の知る限りでは、C.tsushimensis(Fig. 1B)は現在、既知の昆虫の中で最も小さいゲノムサイズを有し、0.07pg DNAのC値を有し、おおよそ68Mbに対応すると考えることができる。 この値は、一度95Mb、さらに最近では87.2Mbと推定された関連種、Clunio marinusのゲノムサイズと一致する(Kaiser and Heckel、2012;Tobias S.Kaiser、personal communication)。
最近、南極のミッジ、B.antarcticaのゲノムが配列決定された(Kelley et al., 2014). 著者らは、この種のゲノムサイズは89と推定されていると主張した。5-105Mbは、すべての昆虫の中で最小でした。 しかし、我々はこのゲノムサイズがchironomids値の正常範囲内で構成されていることをここで示しています。 また、b.antarcticaのゲノムサイズが小さいことが、極端な寒冷環境への適応であることも示唆した。 Diamesinae亜科の高山種であるD.japonicaも小さなゲノムサイズを示すので,この仮説を裏付ける可能性がある。 別の関連するDiamesinae、Himalayan midge Diamesa sp。 実際には-16℃という低い温度で活性であることが判明した(Kohshima、1984)。 しかし、非常に低い温度でも発生するTelmatogeton japonicus(Danks,1971;Sunose and Fujisawa,1982)は、chironomidファミリーの平均と比較して、比較的大きなゲノムサイズを示しています。 B.antarcticaはOrthocladiinae亜科に属し、平均して小さなゲノムサイズを示すので、ここではゲノムサイズに対する系統発生的影響を考慮する必要があります。 C.tsushimensisとHydrobaenustkubalatusはChironomidsの中で最も小さいゲノムサイズを示し,またOrththocladiinae亜科に属した。 したがって、Bの小さなゲノムサイズ。 南極は、極端な寒さの適応の結果ではなく、単に祖先の形質を構成する可能性があります。
P.vanderplankiは、完全に脱水状態でanhydrobiosisを達成することが知られている唯一の昆虫種です(図。 1D)および再水和後に回復する(Hinton,1951,1960a;Watanabe,2006;Cornette and Kikawada,2011)。 私たちの研究グループは最近、乾燥耐性Polypedilum vanderplankiと乾燥感受性同属Polypedilum nubiferのゲノム配列の比較解析を発表しました(Gusev et al., 2014). 比較は、両方の種が同様のゲノムサイズを有し、複製された遺伝子クラスターの限られたセットだけがP.vanderplankiのanhydrobiosisに関連していることを示した(Gusev et al., 2014). ゲノムアセンブリから推論されたゲノムサイズは、P.vanderplankiのための104MbとP.nubiferのための107Mbであり、これらの値は、約98Mbに対応し、本研究では、これらの種 P.vanderplankiとP. nubiferゲノムはDNA反復の同様の低い割合を示し,他のdipteran種と比較して少数のトランスポーザブル要素のみが見出された。 転置可能な元素の割合のこの減少は、南極のミッジ、B.antarcticaでも観察された(Kelley et al., 2014). 平均イントロン長はまた、南極のミッジおよびP.vanderplankiおよびP.nubiferの両方でもかなり減少した(Gusev et al., 2014). 乾燥に敏感で凍結不耐性のP. nubiferはこれらの特徴を南極ミッジとアンヒドロビオティックミッジと共有しており,転置可能な要素の割合が低く,イントロン長が短いことは,すべてのクロノミドによって共有される特徴を構成し,適応効果を排除できなくても極端な環境に対する耐性に直接関係しない可能性がある。
3.
推定されたC値を示す双翅目の系統発生。 チロノミドファミリーは黒で示されています。 ダッシュラインは、D.melanogasterのゲノムサイズを示しています。 系統発生学的クラドグラムは、異なるキロノミドおよびジプテラン木からのコンセンサスである(Yeates and Wiegmann,1999,2005;Saether,2000;Cranston et al., 2012). 誤差バーには標準偏差が表示されます。 エラーバーのないゲノムサイズは、動物ゲノムサイズデータベースに記載されている以前の研究から得られた(Gregory、2014)。
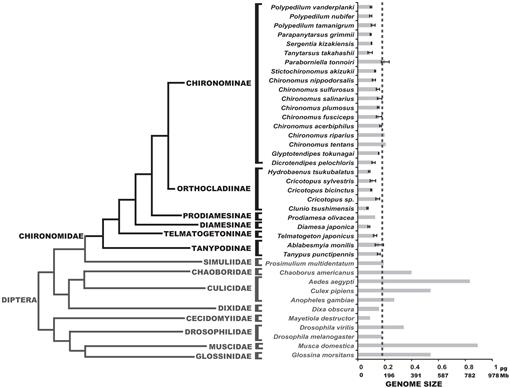
図1.1.1. 4.
本研究で調べたチロノミド種の体の大きさとゲノムの大きさとの関係。 (A)それぞれの種について、平均総体長をミリメートルで示し、平均C値をpg DNAで表す。 実線で具体化された弱い正の相関(r2=0.171、n=25)のみが、二つの変数の間に観察された。 (B)属レベルでは、Cranston et al.の系統発生に基づいて、系統学的に独立した対照の方法によって同じ値の手段を変換した。 (2012). 実線によって具体化されたこれらの変換されたコントラストの間の相関は有意ではなかった(r2=0.118、n=13)。 データ解析は、Prism4で行った。0Macintosh用ソフトウェア(GraphPad Software,Inc.).

Chironomidaeファミリーの中で小さなゲノムサイズに潜在的に関連する適応形質は何でしょうか? 実際には、いくつかの発生的および生態学的要因は、ゲノムサイズに相関することが示唆されている。 第一に、ゲノムサイズと体のサイズとの間に正の相関が多くの分類群で発見されており、この相関は比較的一般的な現象として現れる(Gregory、2005)。 この相関は蚊でも報告されている(Ferrari and Rai、1989)が、他の昆虫分類群では必ずしも明らかではない(Gregory and Hebert、2003;Ardila-Garcia and Gregory、2009)。 キロノミドの中では、ゲノムサイズと体サイズの間に弱い正の相関しか見られませんでした(図1)。 4A)。 Chironomus属(0.15pg)の平均C値はPolypedilum属(0.10pg)のそれよりも高く、この差はChironomus種の一般的に大きな体サイズに起因する可能性があります。 しかし、両属間の系統発生距離は、ゲノムサイズのこの違いを説明することもできます。 その結果、系統学的に独立した対照分析を用いて属レベルでデータを修正した(Garland and Adolph,1994;Garland et al. その結果、ゲノムサイズと体サイズとの間の相関は有意ではないことが判明した(Fig. 4B)。 チロノミドゲノムサイズの狭い範囲(二から三倍のみ)とこれらの種の平均小さな体サイズ(ほとんどは数ミリメートルを超えない)は、おそらくチロノミダ
昆虫の間では、ゲノムサイズと発達の複雑さとの間に別の相関が示唆された。 半代謝性昆虫は、緩やかな幼虫の脱皮のみで、ゲノムサイズの広い範囲を示すのに対し(0.18から16までのC値。93pg)、それらの複雑な変態を伴うholometabolous昆虫は、それらのほとんどのために、推定2pgの閾値内に制限されたC値を有する(Gregory、2002、2005)。 Holometabolous昆虫は変態の限られた時間の間に集中的な形態学的リモデリングを受け、小さなゲノムサイズが高い速度で細胞分裂を達成するための利点を提 Chironomidsはholometabolous昆虫であり、それらの変態は非常に急速です。 彼らの蛹の段階は、特定の種のために一日だけ、あるいはほんの数時間続くかもしれません(Cranston、1995c)。 例えば、C.tsushimensisは、顕著な性的二形性を有する複雑な変態を示す(図2)。 1B)。
ゲノムサイズと細胞分裂速度の関係も発生速度に影響します。 例えば、アブラムシの急速なライフサイクルは、それらの小さなゲノムサイズに関連していることが示唆された(Ma et al., 1992). したがって、小さなゲノムサイズは、急速に一時的な環境で開発chironomid種のための利点を構成する必要があります。 Clunio属のChironomidsは一時的な潮溜まりに発達し、また月の周期と干潮の短い窓の間に成虫の同期した出現を示すことができる(Kaiser and Heckel、2012)。 これを達成するためには、高い発達率が必要であるべきである。 類似の間質環境で急速に発達する小さな多毛類環形動物は、マクロベント種よりも小さいゲノムサイズを示すことに留意されたい(Gambi e t a l., 1997). 例えば、B.antarctiaまたはEretmoptera murphyi(Lee e t a l., 2006; Worland,2010),幼虫の開発は二年間続きます,主に凍結状態で逮捕,しかし、変態と再生は非常に短い夏の期間中に発生しなければなりません. この場合、高い発生率が必要であり、これはB.antarcticaの小さなゲノムによって促進される可能性がある。 この現象は、被子植物の研究によって説明され、短い南極の夏の間にライフサイクル全体を完了することができる種が最小のゲノムサイズを提示したことを示している(Bennett et al., 1982). もう一つの極端な、anhydrobiotic midge P.vanderplankiは一時的な岩のプールに適応しています。 ここでも、一時的な生息地での高い発生率は、この種の小さなゲノムサイズと関連している可能性があります。 しかし、オーストラリアの種P.tonnoiriも同様の岩のプールで乾燥にさらされている(Jones,1975;Adams,1985;Frouz et al. ら、2 0 0 3)は、キロノミドの比較的大きなゲノムサイズを示す(図1 0A)。 および表1)。
非生物的ストレスもDNAの完全性に影響を及ぼし、結果としてゲノムサイズに影響を与える可能性があります。 例えば、pの幼虫。 vanderpiankiは、無加水分解後に大規模なDNA損傷を経験し、効率的なDNA修復は、再水和後の数日の間に起こる(Gusev e t a l., 2010). 植物では、ゲノムサイズと放射線耐性との間に負の相関が見られ(Bennett and Leitch、2005)、ゲノムサイズが小さい種では突然変異率も低かった(Abrahamson et al., 1973). その結果,p.vanderpiankiのゲノムサイズが小さいことは,乾燥と再水和のサイクルに関連するDNA修復イベント中の有害な変異の蓄積を避けるための利点であると考えられる。 海洋種として、C.tsushimensisはまたほとんどの昆虫種のために致命的である高い塩分の圧力に露出されます。 高塩分および他の非生物的ストレスは、DNA損傷の主な原因として示唆された細胞内活性酸素種(ROS)を生成することが知られている(Franca et al. 2007年、Gill and Tuteja、2010年)。 これはまた、小さなゲノムサイズに関連している可能性があります。 しかし,T.japonicusやChironomussalinariusのような他の海洋および高塩分耐性種は,c.tsushimensisほど小さいゲノムサイズを示さない。 酸耐性種、例えば、Chironomus sulfurosus、Chironomus acerbiphilusまたはPolypedilum tamanigrum(Fig. 1C)は、1.4という低いpHの温泉で生き残ることができる(Doi et al.,2004;Takagi et al., 2005). 酸性ストレスに対する耐性と小さなゲノムサイズとの間には明確な相関は認められず,系統発生的影響はより重要であり,Polypedilum属ではゲノムサイズが小さく,Chironomus属ではゲノムサイズが大きいことが分かった。
結論として、chironomidsで観察された小さなゲノムサイズは、おそらくそれらのゲノム構造中のトランスポーズ可能な要素の数とイントロンの長さの祖先の減少の結果である。 Chironomidae科の中で,ゲノムサイズは亜科レベルと属レベルで系統発生によって異なっていた。 様々な分類群の相関から推測されるように、チロノミドの小さなゲノムサイズは、理論的には、高い発生率と低い突然変異率を介して不安定で極端な環境 本研究が今後のチロノミドゲノムプロジェクトを促進し、この分類群内の比較ゲノミクスがチロノミドゲノムがその環境とどのように相互作用しているかを理解するのに役立つことを願っています。