細胞接着
細胞接着は、細胞表面上の特定の分子と相互作用し、隣接する細胞に付着するプロセスです。 このプロセスは、細胞が細胞間の空間に細胞によって放出された分子を含む周囲の細胞外マトリックスに付着する細胞表面間の直接的または間接的な相互作用を介して起こり得る。 細胞接着は、細胞接着分子(CAM)が細胞表面に位置する膜貫通タンパク質と相互作用するときに起こる。 細胞接着は、様々な方法で細胞をリンクし、細胞が周囲の環境の変化を検出し、応答することを可能にするためのシグナル伝達に関与することができ 細胞接着によって調節される他の細胞プロセスには、多細胞生物における細胞遊走および組織発達が含まれる。 細胞接着の変化は、重要な細胞プロセスを破壊し、癌および関節炎を含む様々な疾患を引き起こす可能性がある。 細胞接着は、細菌やウイルスなどの感染性生物によって引き起こされる疾患にも不可欠です。
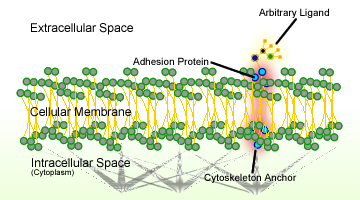 図1. 細胞接着の概略
図1. 細胞接着の概略
分類
CAMsは、インテグリン、免疫グロブリン(Ig)スーパーファミリー、カドヘリン、セレクチンの四つの主要なファミリーに分かれています。 これらの接着分子のそれぞれは、異なる機能を有し、異なるリガンドを認識する。 カドヘリンと免疫グロブリンは、別の細胞上の同じタイプのCAMに直接結合するのに対し、インテグリンとセレクチンは異なるタイプのCAMに結合する異種のCamであるため、ホモタイプのCamである。 細胞接着の欠陥は、多くの場合、Cam発現の欠陥に起因する。 多細胞生物では、カム間の結合は、細胞が互いに接着し、細胞接合と呼ばれる構造を形成させる。
それらの機能に応じて、細胞接合部は次のように分類することができます:
アンカリング接合(接着接合、デスモソームおよびヘミデスモソーム)、細胞に沿って細胞を維持し、細胞間の接触を強化する。
閉塞接合(タイトジャンクション)は、細胞間の隙間を細胞と細胞の接触によって密封し、拡散のための耐水性の障壁を作り出す。
隣接する細胞の原形質をリンクし、細胞間で分子の輸送を可能にするチャネル形成接合(ギャップ接合)。
システム内のシナプスである可能性のある信号中継ジャンクション。
あるいは、細胞接合は、細胞との相互作用に応じて、カドヘリンによって主に媒介される細胞–細胞接合と、インテグリンによって主に媒介される細胞–マトリックス接合の2つの主要な品種に分類することができる。
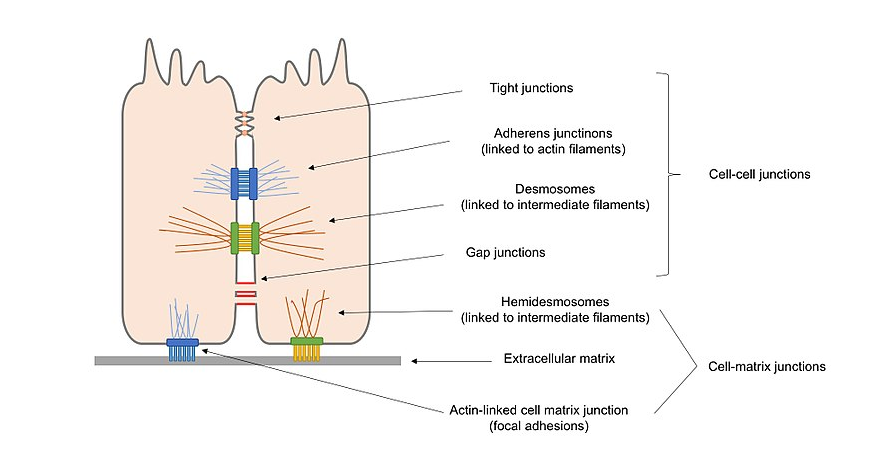 図2。 細胞–細胞接合部および細胞–マトリックス接合部を含む上皮細胞に存在する細胞接合部の異なるタイプの概要図。
図2。 細胞–細胞接合部および細胞–マトリックス接合部を含む上皮細胞に存在する細胞接合部の異なるタイプの概要図。
細胞接着タンパク質の構造的特徴
細胞接着タンパク質は、通常、細胞外表面で細胞-細胞および細胞外マトリックス認識を仲介する糖タンパク質である。 ほとんどの細胞接着分子は、それらの接着ドメインにおいて同様の立体配座を有する。 例えば、カドヘリン、免疫グロブリン様、フィブロネクチンIII型およびEGFの接着ドメインは、主にβシート構造である。 細胞接着に関与する共通のモチーフは、一つまたは二つの抗平行βサンドイッチを含むギリシャのキーバレル構造である。
Ig様ドメインは、ギリシャのキーバレルドメインの主要なクラスです。 それらは、7〜9本の抗平行β鎖を含む抗体の可変ドメインまたは定常ドメインと配列類似性を有する。 反平行Pシートは3次元βバレルを形成する。 Ig様ドメインは疎水性コアとジスルフィド結合によって安定化される。 それらは2つの主要なセットに分けられます:Ig C様ドメインとIg V様ドメイン。
細胞接着タンパク質の機能的に関連する構造特性
細胞接着タンパク質は機能的に多様性を持っています。 細胞接着分子の相互作用は、ホモ親和性またはヘテロ親和性のタンパク質-タンパク質相互作用またはタンパク質-炭水化物相互作用であり得る。 細胞接着分子の構造変化は、多くの場合、それらの機能的特性に関連している。
ホモ親和性タンパク質-タンパク質相互作用。
例えば、カドヘリンは膜貫通Ca2+依存性ホモ親和性接着分子である。 Cadherinsはティッシュの同じような細胞間の接続点の維持に責任があります。 細胞-細胞接着は、カドヘリンのN末端ドメインを介して媒介される。 それはEC5に5つの同じような細胞外の範囲EC1を含んでいます。 N-カドヘリンにおけるX線結晶学的研究は、EC1ドメインが単量体が原形質膜から外側を指すそれらの接着結合表面と平行に配向している二量体を形成することを示した。 EC1ドメインのモノマー単位は、それらの接着剤結合表面を使用して、βバレル構造を形成し、反平行な方法で互いに相互作用します。 Igスーパーファミリーにおける免疫グロブリンドメイン相互作用の界面を模倣する疎水性および極性/荷電性の両方を有することが示唆された。
ヘテロ親和性タンパク質-タンパク質相互作用。
例えば、様々な細胞表面受容体および細胞外マトリックスリガンドへのインテグリンの結合は、細胞接着系におけるヘテロ親和性タンパク質-タンパク質相互作用の主要なクラスである。 可溶性フィブリノーゲンに結合すると、インテグリンaiib β3は高親和性結合状態に変換される。 この場合のリガンド結合によって誘導されるインテグリンの立体配座変化は,その接着活性にとって重要である。 T細胞受容体の結合はまた、icam−lまたはICAM−2(細胞間接着分子)などのその受容体に対するインテグリン、白血球機能関連抗原−1(LFA−1)の結合親和性を調節 ICAM−lの結合は、LFA−1の立体配座変化をさらに誘導することができる。 タンパク質の接着結合部位は、X線結晶学的研究に基づいてLFA-lのC末端に位置する。トリペプチド、アルギニン-グリシン-アスパラギン酸(RGD)は、一般的なインテグリンリガンド結合モチーフである。 例えば、フィブロネクチンのインテグリン結合リガンドIII型モジュールは、fとG β鎖を結ぶループの頂点に位置するrgdモチーフが接着を仲介するギリシャのキーバレル構造を有する。 展開によるより線形変動立体配座へのRGDループのまっすぐにすることは、表面結合インテグリンへのループのアクセシビリティを減少させ、したがって、結合の親和性と選択性を減少させる。
タンパク質-炭水化物相互作用。
セレクチンは、リンパ球および好中球と血管内皮との相互作用において重要である。 セレクチンは炭水化物に結合する接着分子である。 炭水化物へのセレクチンの結合に関する直接的な構造データはまだない。 セレクチンは低い類縁の炭水化物を結合し、非常に速い断続的な率があります。