はじめに
組織、細胞、および細胞内の小さな構造(オルガネラ)はほとんどが水であり、したがって透明です。 水の小さなシースルー袋をイメージングすると、多くの情報が含まれていない画像が得られ、顕微鏡検査では、サンプルの色の領域を与え、それらをはるかに見やすくするコントラストや汚れのいくつかの並べ替えを持っていることが不可欠です。 さらに、核や細胞膜のような細胞内の小さな構造のいくつかだけをイメージしたい場合はどうなりますか? セル全体を着色すると、興味のある領域をローカライズすることが不可能になります。
蛍光は、コントラストと局在化の両方のこれらの問題を解決します。 蛍光は、物体が光を吸収した後に光を放出する場所です。 鉱物(鉱物蛍石から来る蛍光という言葉)、深海魚(最も有名なクラゲAequorea victoria、緑色蛍光タンパク質(GFP)が発見された)、植物、化学物質など、多くの異なる物体が蛍光
蛍光分子(蛍光色素として知られている)は、サンプルを標識するために使用され、実質的に任意の色で光を放出する蛍光色素が利用可能である。 蛍光顕微鏡では、試料を蛍光色素で標識し、明るい光(励起光)を用いて試料を照らし、蛍光(発光光)を発する。 このようにして、フルオロフォアが明るい色の光を放出するので、サンプルは黒色の背景と非常に対照的である。 これらの蛍光色素を関心領域に局在化することにより、細胞の任意の部分の鮮明な画像を撮影することができ、蛍光顕微鏡は生命科学のための強力
明視野vs蛍光イメージング
明視野顕微鏡では、サンプルを透過した白色光で照明します。 これは顕微鏡の下で非常に対比されるか、汚されるか、または自然に彩色されたサンプルを観察するためにサンプルの均一照明を作成する。 しかし、明視野は、目的のプロセスを研究するために透明/半透明、染色されていない細胞または細胞構造を区別するのに十分ではない。
蛍光顕微鏡は、異なる波長の光にさらされたときに特定の可視波長の光を放出する分子であるフルオロフォアを使用することに依存しています。 これらの蛍光体が目的の標的構造に結合している場合、蛍光体から放出された光子を使用して、この目的の構造を可視化することができる。 蛍光顕微鏡の利点は、標的構造が照射され、試料の望ましくない領域が蛍光または蛍光をほとんど持たないことであり、容易な標的化および画像化を可能にすることである。
なぜ分子が蛍光を発するのか
蛍光の起源は、図に示すように、活性蛍光体の周りを自由に移動し、吸収されたエネルギーを放出する電子である。2.
励起の前に、電子はそれらに利用可能な最も低いエネルギー状態、すなわち基底状態(S0)にあります。 電子が特定のエネルギー範囲の光子に当たると、電子は光子のエネルギーを吸収し、より高いエネルギー状態(S1、S2、またはS3)にジャンプします。 基底状態(S0)に戻るために、電子は光子の放出として追加のエネルギーを放出する。 この光子のエネルギーは励起エネルギーよりも小さいので、より長い波長を有する。 これが、発光光が励起光よりも長い波長を有し、異なる色として現れることができる理由である。
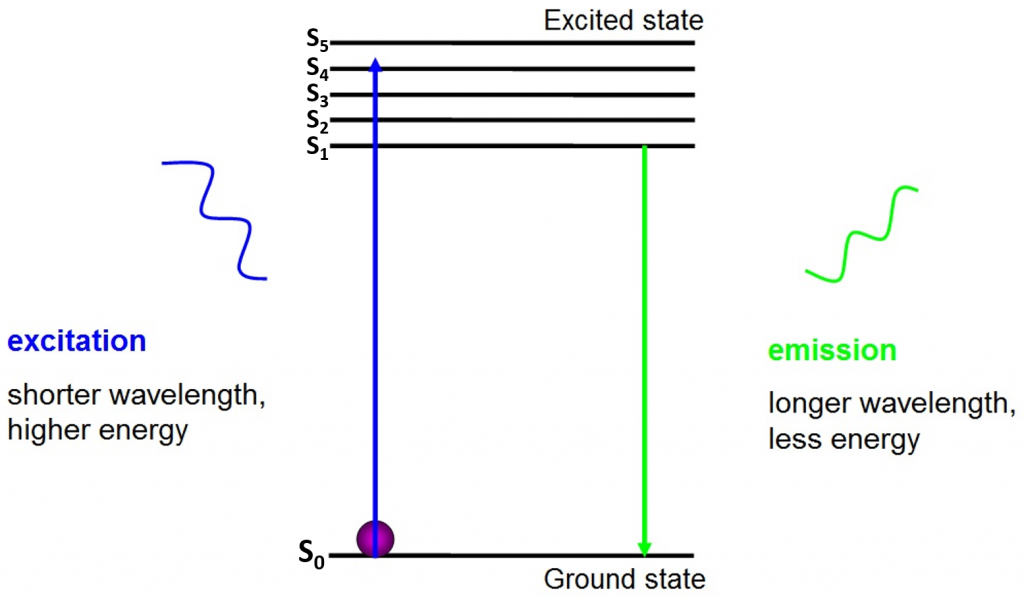
放出された光子は通常可視スペクトルにあり、十分な励起された蛍光体があれば顕微鏡下で見ることができます。 解放された光子の波長はあらゆるfluorophoreのために特定であり、この予測可能性は容易な蛍光性イメージ投射を可能にする。
蛍光強度因子
蛍光色素は予測可能な波長の蛍光を放出することができますが、蛍光強度を制御する因子を知ることも重要です。 十分に強い光の放出がなければ、蛍光は顕微鏡では検出できません。
量子収率
フルオロフォアの量子収率(λ)は、放出された光子の数と吸収された光子の数の比です。 量子収率は0-1の値として表されることが多く、1は光子変換の効率100%である。 また、各蛍光体は、最適な蛍光効率のために固有のpH、イオン強度、および温度を有することに注意することも重要である。
吸光係数
すべてのフルオロフォアは、光子を励起するための適切な波長範囲内であっても、光子を吸収する能力が異なります。 蛍光体が励起波長に適切に一致する光子に曝される場合、光子が吸収される確率は測定可能な特性であり、吸光係数(λ)として知られている。
蛍光体の量子収率と吸光係数は、蛍光体が実験的な設定でどれだけ明るいかを記述するために一緒に表示されることがよくあります。
蛍光寿命
フルオロフォア電子が光子を吸収するとき、それはすぐに長波長光子を放出しません。 励起されたエネルギー状態間のあるエネルギーの放出は、異なる時間を要することが知られている。 電子が光子を放出して基底状態に戻る前に励起状態で過ごす時間は、その蛍光寿命の測定値です。 あらゆるfluorophoreの寿命は独特で、実験的に測定することができる。 蛍光色素を実験的に使用する場合、特にカルシウムイメージングニューロンなどの高速を必要とする用途には、その寿命に役立ちます。
励起波長強度
ほとんどの蛍光顕微鏡のセットアップには、所望の波長範囲を出力するように調整できる光源が含まれています。 多くの蛍光光源は、光路を通って移動する光子の数を増加させるために励起強度を調整することもできる。 蛍光標識された試料では、その励起波長に曝されると、すべての蛍光体は同時に活性化されないであろう。 励起強度を増加させ、試料に到達する光子の数を増加させることによって、より多くの蛍光体が励起される可能性が高くなる。
光安定性
光安定性は、分子または生物が損傷に抵抗する能力です。 蛍光顕微鏡では、蛍光色素は最終的に対向する光子の吸収を停止し、永久的な暗い状態になります。 生物が暗い状態でより多くの蛍光体を集めると、標識されたターゲットの外観が減少し、サンプルは光退色であると言われています。 蛍光顕微鏡では、多くの場合、実験中に経験される光漂白の量を減らすためのステップが取られます。 いくつかの措置には、サンプルと相互作用する光の強度の低下、および他の染料と同じくらい活性を維持しない特殊な蛍光染料の使用が含まれる。
蛍光顕微鏡
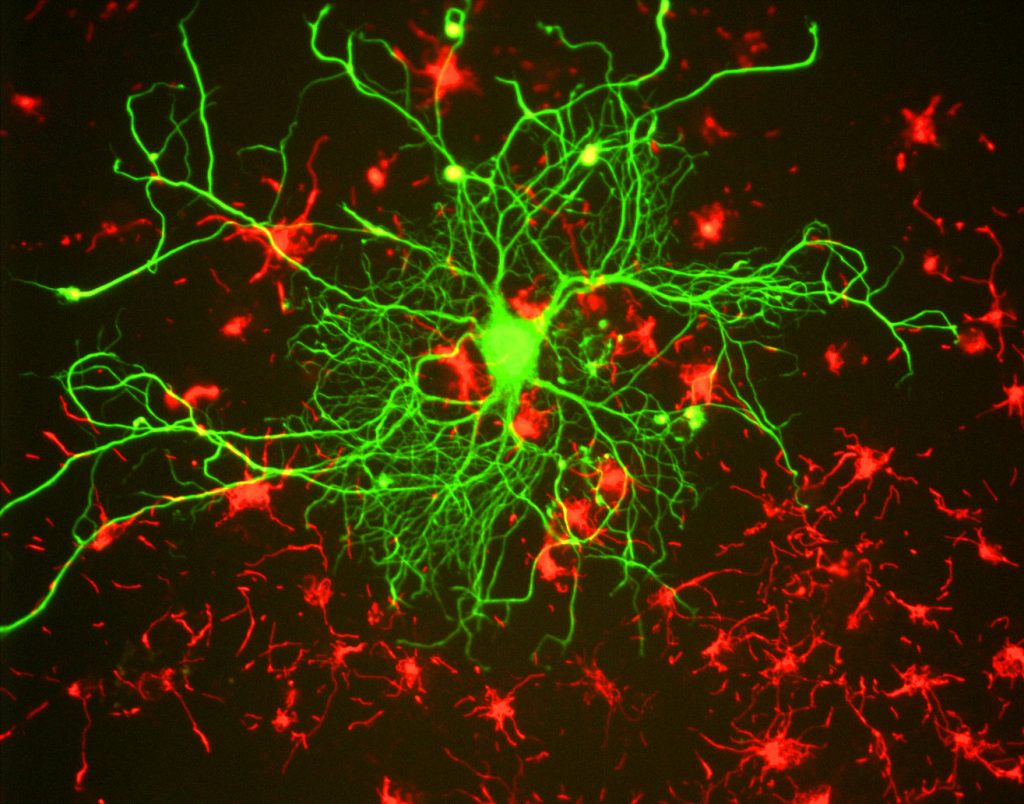
研究者にとって、蛍光の主な利点は、試料を色素、抗体、タンパク質などの蛍光物質で標識/染色し、画像にコントラストを持たせる蛍光 これらの蛍光ラベルをターゲットにすることにより、研究者は、彼らが見たいものを選択することができます。 これを図1 0Bに示す。3、それらは蛍光マーカーの異なる色で標識されているように、ニューロンが明確にアストロサイトの間で見ることができる場所。
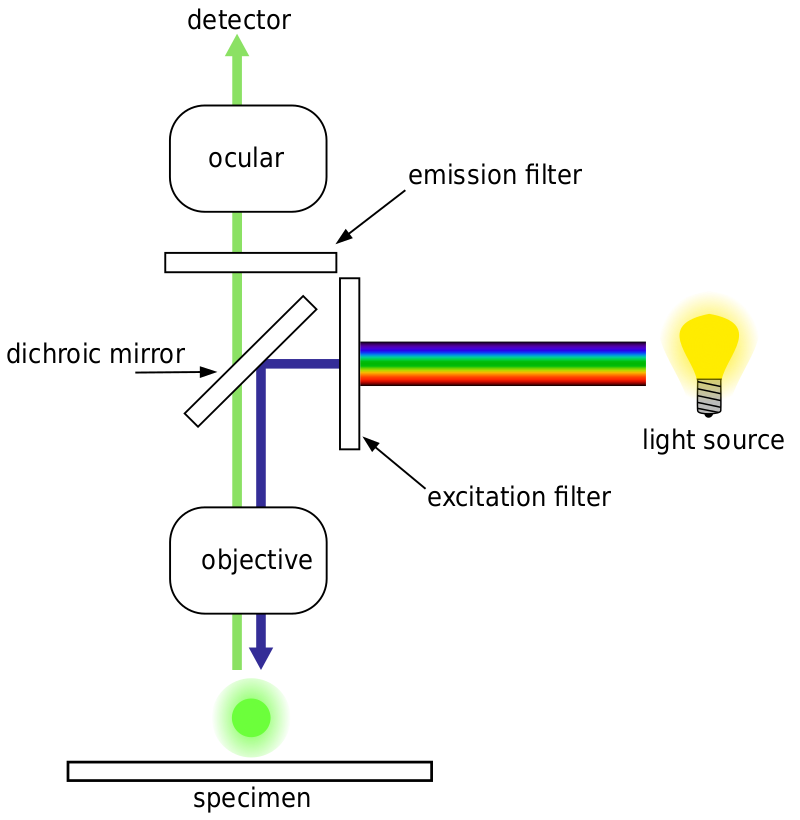
一般に、蛍光顕微鏡の場合、試料は蛍光マーカー(典型的には試料の特定の部分に特異的)で標識される。 サンプルはfluorophoreのための特定の刺激波長とそれから照らされ、生じる放出蛍光性は探知器、通常敏感な科学的なカメラによって受け取られます。
ほとんどの蛍光顕微鏡はepifluorescence顕微鏡であり、励起と発光は同じ光路を介して行われます。 励起照明と放出された蛍光の両方が顕微鏡の対物レンズを通過し、通常は蛍光を検出するために濾過される。 この設定を図10に示す。4.
自家蛍光
いくつかの構造、生物、および一般的な顕微鏡サンプルは、自家蛍光として知られている蛍光を自然に示すことができます。 これは、標識された試料からの蛍光とは異なるが、それは多くの場合、自家蛍光顕微鏡試料が人工的に追加された蛍光を不明瞭にし、信号を減少させ、検 特定の波長がそれを避けるために使用されない限り、これは行われた任意の蛍光イメージングに影響を与えるように、あなたのサンプルは、自家蛍光を
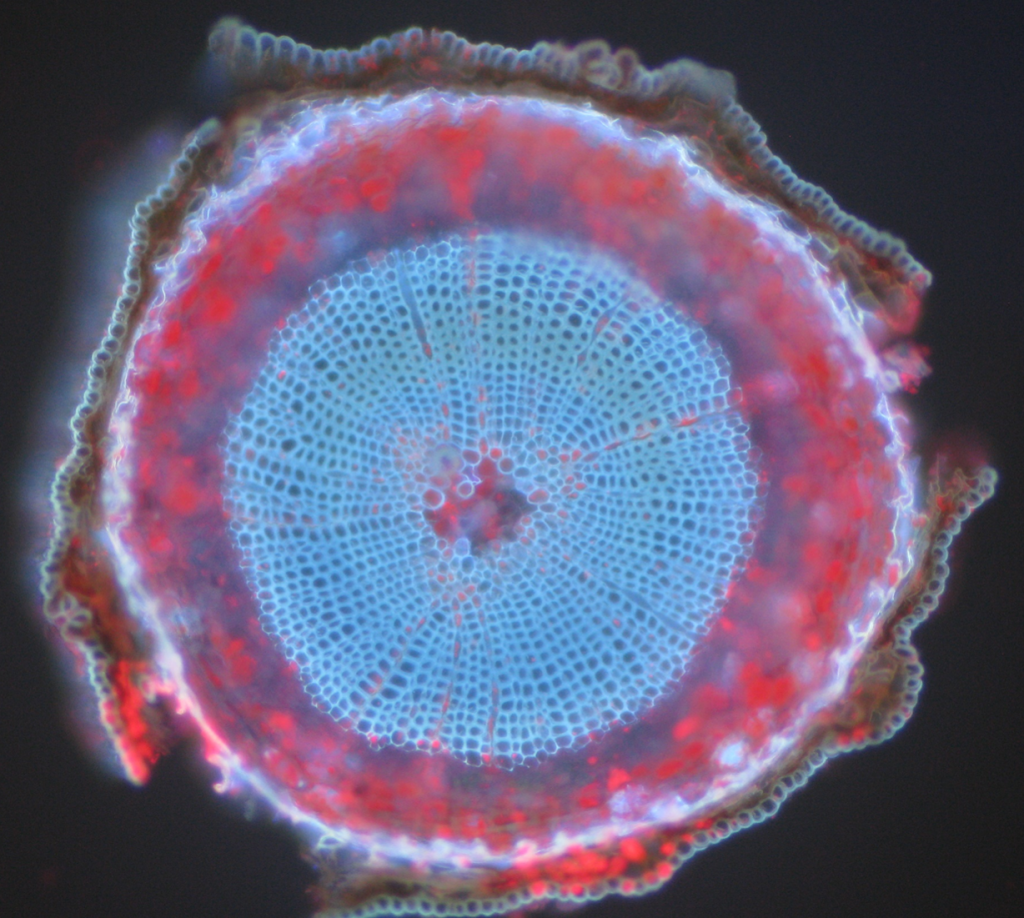
自家蛍光対象の一般的な例は、ミトコンドリア、リソソーム、コラーゲン、およびトリプトファン、チロシン、フェニルアラニンなどのいくつかのアミノ酸である。 最も顕著なのは、自家蛍光は、クロロフィルおよびリグニンおよびカロテンのような他の蛍光分子の使用のために植物において一般的である。 図1.1.1.図5は、標識されていないScots pineサンプルからの自家蛍光の異なる色を示しています。
概要
最初の蛍光色素の導入以来、蛍光顕微鏡は、従来の明視野顕微鏡技術よりも高い特異性で細胞および細胞構造を視覚化するためのツールを積極的に利用してきた。 研究者は、関連するデータを得るために、興味のあるinfluorescence実験の構造、光学的性質、およびプローブを操作することができます。 このような柔軟性により、蛍光顕微鏡は多くの生命科学実験に含まれるようになった。
サンプルと蛍光体の種類に応じて、最良の撮像結果を得るために科学的なカメラを慎重に選択する必要があります。
- 光学顕微鏡。 (2009)自然のマイルストーン。 マクミラン-パブリッシャーズ-リミテッド(MacMillan Publishers Limited,6-22.
- Lavis,L.D.,&Raines,R.T.(2008). 化学生物学のための明るいアイデア。 ACSケミカルバイオロジー、3(3):142-155。
- Liu,Y.,Lilly,D.(2017)シアニンフルオロフォアが二本鎖RNAの末端にスタックする場合の結晶構造。 生物物理学ジャーナル、113、(11):2236-2343。
- Berezin,M.Y.,Achilefu,S.(2010). 蛍光性の寿命の測定および生物的イメージ投射。 化学レビュー、110(5):2641-2684。
- Stockert,J.,Blazquez-Castro,A.(2017)生命科学における蛍光顕微鏡. アラブ首長国連邦のシャルジャ。 ベンサム・サイエンス・パブリッシャーズ所属。
- Berezin,M.Y.,&Achilefu,S.(2010). 蛍光性の寿命の測定および生物的イメージ投射。 化学レビュー、110(5):2641-2684。
- Denk,W.,Strickler,J.,Webb,W.(1990). 二光子レーザー走査蛍光顕微鏡。 科学だ 248, (1951): 73-76.
- だから、P.(2002)。 二光子蛍光光学顕微鏡。 マクミラン出版グループ。 ることができると考えられている。 超解像蛍光顕微鏡のガイド。 細胞生物学のジャーナル190(2):165-175。
- Betzig,E.,Patterson,G.H.,Souugrat,R.,Lindwasser,O.W.,Olenych,S.,Bonifacino,J.S.,Davidson,M.W.,LippincottSchwartz,J.,Hess,H.F.(2006)Imaging incellular fluorescent proteins at nanometer resolution. 科学だ 313(5793): 1642-5
- Rust,M.J.,Bates,M.&Zhuang,X. (2006)確率的光学再構成顕微鏡によるサブ回折限界イメージング(STORM)。 Natメソッド。 2, (10):793-5.
- Rego,E.,Shao,L.,Macklin,J.Winoto,L.,Johansson,G.,Kamps-Hughes,N.,Davidson,M.,And Gustasson,M.(2010)PNAS. 109(3):e135-a143.
- Jungmann,R.,Avendaño,M.S.,Woehrstein,J.B.,Dai,M.,Shih,W.M.&Yin,P.(2014)DNA-PAINTおよびExchange-PAINTを用いた3Dセルラー超解像イメージングを多重化しました。 Natメソッド。 11(3): 313-318
- Jiang,X.,Wang,L.,Carroll,S.,Chen,J.,Wang,M.,およびWang,J. (2018) Challenges and Opportunities for Small Molecule Fluorescent Probes in Redox Biology Applications. Antioxidants & Redox Signaling. Mary Ann Liebert, Inc.