タンパク質処理に加えて、ERとゴルジはいくつかのタイプのタンパク質輸送も世話します。 小胞(膜結合気泡、本質的に)は、ER、ゴルジ、および他の膜細胞小器官からピンチオフし、それらと一緒に封入された流体の中にあった可溶性分子だけでなく、膜のそのセクションに埋め込まれた任意の分子を運んでいます。 これらの小胞は、キネシンやミオシンなどの分子モーターに乗って、適切な目的地にドッキングし、標的膜またはオルガネラと融合するまで細胞骨格に沿って移動する。 一般に、小胞は、ERからcisゴルジに、cisから内側ゴルジに、内側からtransゴルジに、およびtransゴルジから原形質膜または他の区画に移動する。 ほとんどの動きはこの方向にありますが、ゴルジからERに戻って移動する小胞もあり、ERにとどまるはずのタンパク質を運びます(例: PDI)と誤って小胞内にスクープされました。
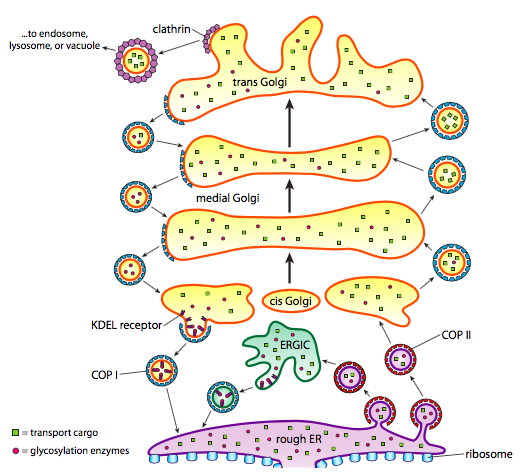
小胞の形成は、適切な条件下で球状ケージに自己集合するコートタンパク質に依存する。 膜貫通蛋白質と関連付けられたとき、それらは球形の形に付す膜をまた引っ張ってもいいです。 小胞形成に使用されるコートタンパク質の主要なタイプは、COPII、COPI、およびクラスリンである。
COPIIコートタンパク質は、ERからゴルジに移動する小胞を形成する。 コピ被覆タンパク質は、ゴルジ装置の部分の間で使用され、ゴルジから小胞に戻る小胞を形成するために使用される。 最後に、クラスリンは、エンドサイトーシスのための原形質膜から形成された小胞のためだけでなく、原形質膜のためのゴルジを残す小胞を形成するた
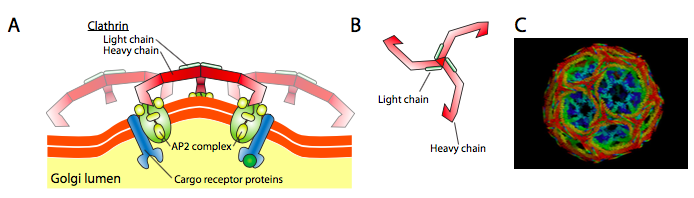
Clathrin(図\(\PageIndex{17}\))は三つの中で最もよく記述されており、小胞のコートはclathrin triskelions(ギリシャ語から、三本足を意味する)の配置から作られています。 各トリスケリオンは、C末端で一緒に結合された3つの重鎖と、1つは各重鎖に関連する3つの軽鎖とから構成される。 異なる三重鎖の重鎖は、それらの重鎖「脚」の長さに沿って相互作用して、非常に頑丈な構造物を生成する。 軽鎖は小胞形成には不要であり、細胞質中のクラスリン分子の偶発的な相互作用を防ぐのに役立つと考えられている。
これらの異なるコートタンパク質を用いた小胞形成機構の間には、ARF1(ARFはADPリボシル化因子の略で、ここではその機能とは関係ない)が膜に動員されることから始まる重要な類似性がある。 これには、ARNOによるGTPのGDPへの交換が必要である(ARNOはARFヌクレオチド結合部位である)。 ARF1がGTPを結合すると、立体配座の変化は、膜に挿入するN末端ミリストイル基を明らかにする。 COPIおよびclathrin上塗を施してある小胞は両方ARF1およびARNOを使用しますが、COPIIはSar1PおよびSec12Pと呼ばれる同じような蛋白質を使用します.
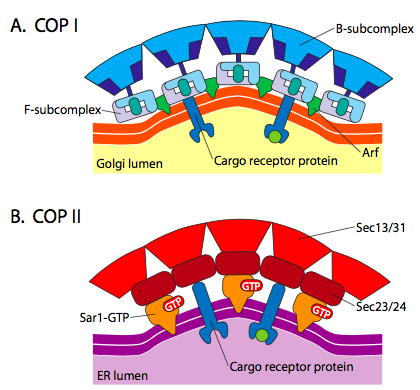
図\(\PageIndex{18}\)。 COPコーティングされた小胞
ARF1(またはSar1P)は、膜結合受容体タンパク質の”尾”末端に結合するアダプタータンパク質を募集するために使用されます。 これらの受容体の事業終了は、小胞に包装される必要があるcar-go分子に結合する。 アダプタータンパク質は、膜(受容体を介して)とコートタンパク質との間のリンクとして作用する。 クラスリンの場合、アダプタータンパク質はトランスゴルジ由来小胞のAP1とエンドサイトーシス小胞のAP2である。 COPI小胞の場合、おおよその相同体はβ-、γ-、δ-、およびγ-COPsであり、COPIIシステムはSec23PおよびSec24Pを使用する。
最後に、アダプターは実際のコートタンパク質にリンクする:クラスリン、α-またはγ-COP、Sec13PおよびSec31P。これらのタンパク質がすべて共通しているのは、自発的に(すなわち、すなわち)である。 エネルギー消費のための条件なしで)、それらはおりそっくりの球形の構造に自己組み立てます。 電子顕微鏡下では,クラスリン被覆小胞はより鋭く定義され,クラスリンサブユニットによって囲まれた六角形および五角形の形状は小胞に”サッカーボール”の外観を与える。 COPコータマー被覆小胞はEMの下では外観がはるかにファジーである。
3種類の小胞被覆タンパク質はすべて自発的に球状構造体に結合する能力を持っていますが、COPIとCOPII被覆小胞だけが自発的に膜を”ピンチオフ”して、小胞を元の膜から放出します。 クラスリン被覆小胞は、小胞を放出するために外部機構を必要とする(図\(\PageIndex{19}\))。
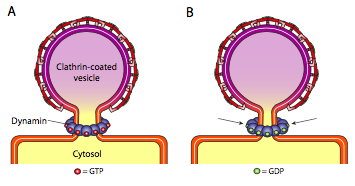
小胞がほぼ完成すると、小胞と膜を結ぶ小さな茎または膜の首がまだあります。 この茎のまわりで、動的GTPの分子はリング/螺線形の構造で集まっています。 ダイナミン分子は、gtpの加水分解時に収縮する球状のGtpアーゼである。 それらが小胞の茎のまわりで関連付けるとき、各ダイナミンタンパク質は膜が一緒につまむこと十分に茎を収縮させ、密封し、元の膜から小胞を解放す
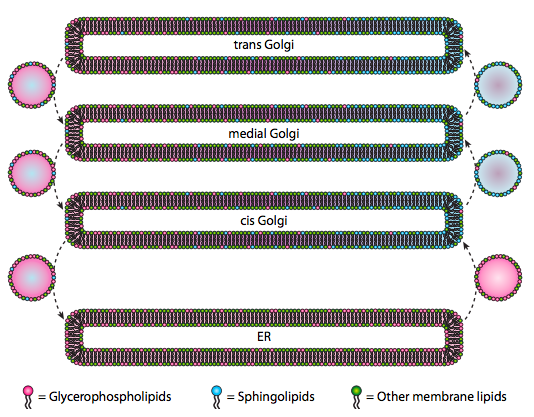
脂質および膜は第4章で議論されたが、我々は真核生物におけるそれらの合成の位置を議論することを無視した。 図\(\PageIndex{20}\)が示すように、特定の種類の脂質の合成は分離され排他的である。 グリセロリン脂質は主に小胞体で形成されるが、ミトコンドリアやペルオキシソームでも形成される。 対照的に、スフィンゴ脂質は哺乳類のERでは作られていません(セラミド前駆体はありますが)、必要な酵素はシスおよび内側ゴルジの内腔に見られます。 理論的には脂質タイプの再分配を示すであろう様々なゴルジとERコンパートメント間の順行性および逆行性小胞トラフィックの証拠があります。 しかし,スフィンゴ脂質は脂質ラフトに凝集する傾向があり,順行性移動小胞により集中しているようである。
小胞が放出された直後にコートタンパク質が脱落する。 クラスリンの場合、このプロセスにはATPaseであるHsc70が含まれる。 しかし、COPIまたはCOPIIコーティングされた小胞のために、ARF/Sar1P上のGTPの加水分解は、アダプターのためのコートタンパク質親和性を弱めるように見え、コーティング Gtpアーゼ活性化剤は、ARF GAP(またはSec2 3P)であり、COP i(またはII)コートの不可欠な部分である。
小胞は、可溶性タンパク質と膜貫通タンパク質の二つのカテゴリーの貨物を運ぶ。 可溶性タンパク質のうち、いくつかは、受容体に結合されることによって小胞に取り込まれる。 他の蛋白質はちょうど近くにあることを起こり、小胞が形作ると同時にすくわれます。 例えば、PDIは、ERから形成される小胞に封入されていてもよい。 それはゴルジではほとんど機能しておらず、ERで必要とされているので、それはどうなりますか? 幸いなことに、PDIおよび他の多くのERタンパク質は、c末端シグナル配列であるKDEL(リジン-アスパラギン酸-グルタミン酸-ロイシン)を有しており、「私はERに属す。「この配列はゴルジ内のKDEL受容体によって認識され、受容体へのKDELタンパク質の結合は小胞形成を引き起こし、それらをERに送り返す。
分泌小胞には可溶性貨物に特別な問題があります。 小胞が形成プロセス中にその中にタンパク質を封入するだけに依存するならば、それらのタンパク質を高濃度に得ることは困難であろう。 多くの分泌された蛋白質は生物によってすぐにそしてかなりの量で必要とされます、従って分泌蛋白質を集めるためのtransゴルジにメカニズムがあ この機構は、セクレトグラニンIIやクロモグラニンBなどの凝集タンパク質を用いて、大きな濃縮顆粒中に標的タンパク質をまとめる。 これらのgraninsは低いpHおよび高いCa2+のtransのゴルジの環境で最もよく働きます、従って小胞が細胞の外の内容を解放するとき、より高いpHおよびより低いCa2+は個々の蛋白質を解放するために総計を離れて壊します。
ゴルジの成熟中に一貫したpH変化があるため、ERからゴルジに移行すると、各コンパートメントのlumenal pHは徐々に低くなります(より酸性)。
最後に、小胞を標的とする問題があります。 小胞は、分子貨物列車に投げ込まれ、無作為に落とされると、はるかに有用ではありません。 したがって、小胞の細胞質表面上のv-SNAREタンパク質と標的膜の細胞質表面上のt-SNAREのマッチングを必要とするドッキング機構がある。 小胞の膜への融合は、一致がある場合にのみ進行する。 そうでなければ、小胞は融合することができず、別の分子モーターに付着して別の、うまくいけば正しい目的地に向かう。 このプロセスは、最初に入ってくる小胞と接触し、スネアタンパク質の相互作用をテストするためにターゲットに十分に近いそれを描くタンパク質をテザリングすることによって支援されています。 小胞およびターゲット膜の他の蛋白質はそれから相互に作用し、スネアが一致すれば、膜が融合するターゲット膜に小胞を”ウィンチ”助けることができます。 小胞融合と膜タンパク質と脂質の方向性を理解するための重要な経験則は、膜の細胞質に面した側が常に細胞質に面しているということです。 したがって、最終的に細胞膜の外表面に見出されるタンパク質は、最初にER膜の内腔表面に挿入されているであろう。
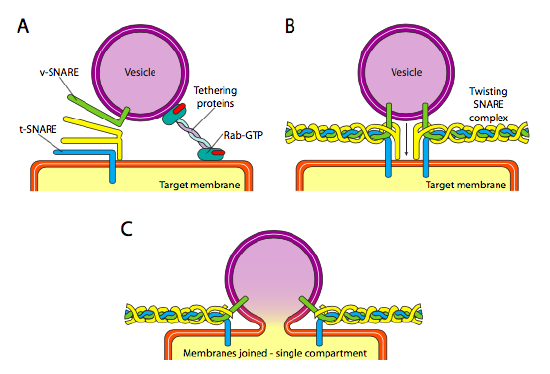
具体的には、小胞が標的膜に近づくにつれて、二重ゲラニルゲラニル脂質尾部を介して標的膜に結合しているテザリングタンパク質Rab-GTPは、小胞と緩く会合し、標的膜の近傍に保持してスネアに働く機会を与える。 V-スネアとt-スネアは今、相互作用し、試合のためにテストする機会を持っています。 最近、スネアは保存されたアルギニン残基とグルタミン残基に基づいて、それぞれR-スネアとQ-スネアと改名されている。 これら二つの主要なスネアに加えて、少なくとも一つの他のスネアが関与し、四つのαヘリックスの束を形成する(少なくとも最もよく研究されている例では、スネアの一つが曲がっているため、二つのαヘリックスドメインが相互作用に関与する。 四つのヘリックスは互いに包み合い、そうすると、小胞と標的膜を一緒に引っ張ると考えられている。
破傷風毒素であるテタノスパスミンは、クロストリジウム-テタニ細菌によって放出され、神経細胞に作用し、神経伝達物質の放出を防ぐことによって痙攣を引き起こす。 このメカニズムは、SNAREタンパク質であるシナプトブレビンを切断し、シナプス小胞が細胞膜と融合することができないことである。 別のニューロンを目標とし、従って反対の効果をもたらすが、ボツリヌス菌の毒素は、Clostridium botulinumからまたスネアで小胞の融合および神経伝達物質解放を防ぐた: 破傷風は抑制的な神経伝達物質の解放を防ぐことによってボツリヌス中毒は興奮性の神経伝達物質の解放を防ぐことによって引き起こされるが引