I tillegg til proteinbehandling tar ER og Golgi også vare på noen typer proteintransport. Vesikler (membranbundne bobler, i hovedsak) klemmer seg fra ER, Golgi og andre membranøse organeller, og bærer med seg hva som helst oppløselige molekyler var inne i væsken som var vedlagt, så vel som eventuelle molekyler innebygd i den delen av membranen. Disse vesiklene tar deretter en tur på en molekylær motor som kinesin eller myosin, og reiser langs cytoskelettet til de dokker på riktig destinasjon og smelter sammen med målmembranen eller organellen. Generelt beveger vesikler seg fra ER til cis Golgi, fra cis til medial Golgi, fra medial til trans Golgi, og fra trans Golgi til plasmamembranen eller andre rom. Selv om de fleste bevegelser er i denne retningen, er det også vesikler som beveger seg tilbake Fra Golgi til ER, som bærer proteiner som skulle forbli I ER (f. eks. PDI) og ble ved et uhell skutt opp i en vesikkel.
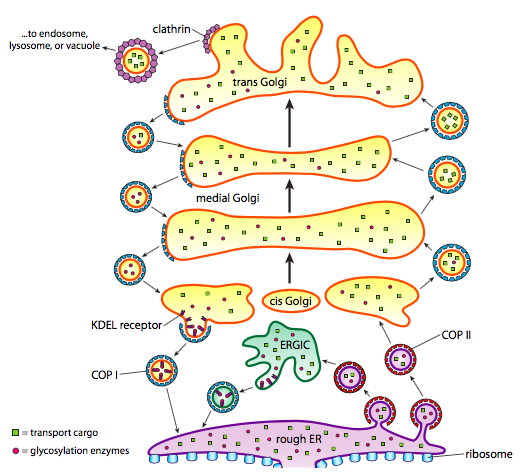
dannelsen av vesikler er avhengig av kappeproteiner som under rette forhold vil selvmonteres i sfæriske bur. Når det er forbundet med transmembranproteiner, kan de trekke den vedlagte membranen sammen i en sfærisk form også. De viktigste typer pels proteiner som brukes i vesikkel dannelse ER COPII, COPI, og clathrin.
COPII coat proteiner danner vesiklene som beveger SEG fra ER Til Golgi. COPI coat proteiner brukes mellom deler Av Golgi apparatet samt å danne vesikler går Fra Golgi tilbake TIL ER. Endelig brukes clathrin til å danne vesikler som forlater Golgi for plasmamembranen, så vel som for vesikler dannet fra plasmamembranen for endocytose.
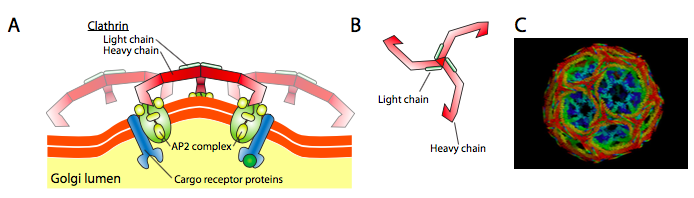
Clathrin (Figur \(\PageIndex{17}\)) er den best beskrevne av de tre, og de vesikulære strøk er laget av arrangementer av clathrin triskelions (fra gresk, betyr tre-legged). Hver triskelion består av tre tunge kjeder som er koblet sammen På C-terminus, og tre lette kjeder, en forbundet med hver tunge kjede. De tunge kjedene i forskjellige triskelioner samhandler langs lengden av deres tunge kjede » ben » for å skape en meget solid konstruksjon. De lette kjedene er unødvendige for vesikeldannelse, og antas å bidra til å forhindre utilsiktede interaksjoner av clathrin-molekyler i cytoplasma.
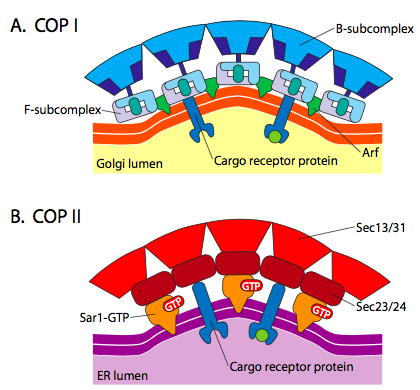
det er betydelig likhet mellom vesikkelformasjonsmekanismene som bruker disse forskjellige kappeproteinene, som begynner med rekruttering AV ARF1 (ARF står FOR ADP ribosylasjonsfaktor, som ikke har noe å gjøre med funksjonen her) til membranen. DETTE krever ARNO-tilrettelagt utveksling AV EN GTP FOR BNP (ARNO ER ARF nucleotid binding site opener). NÅR ARF1 har bundet GTP, avslører konformasjonsendringen En n-terminal myristoylgruppe som setter inn i membranen. Både COPI og clathrin-belagte vesikler bruker ARF1 og ARNO, MEN COPII bruker lignende proteiner kalt Sar1p Og Sec12p.
Figur \(\PageIndex{18}\). COP-belagte vesikler
ARF1 (Eller Sar1p) brukes til å rekruttere adapterproteiner som binder seg til «hale»-enden av membranbundne reseptorproteiner. Forretningsenden av disse reseptorene binder seg til bil – go-molekyler som må pakkes inn i vesiklet. Adapterproteinene fungerer som koblingen mellom membranen (gjennom reseptorene) og kappeproteinene. For klathrin ER adapterproteinene AP1 FOR trans-Golgi-avledede vesikler og AP2 for endocytiske vesikler. For COPI blemmer, omtrentlig homologues er β-, γ-, δ-og ζ – Politiet mens COPII systemet bruker Sec23p og Sec24p.
til Slutt, kort link til den faktiske frakk proteiner: clathrin, α – eller ε – COP, Sec13p og Sec31p. Hva disse proteinene har felles, er at spontant (dvs. uten krav til energiforbruk), samler de seg selv i burlignende sfæriske strukturer. Under elektronmikroskopet er de clathrin-belagte vesiklene mer skarpt definert, og de sekskantede og femkantede former som er begrenset av clathrin-underenhetene, gir vesiklet et» fotball » utseende. COATAMER-belagte vesikler er mye fuzzier i utseende under EM.
Alle tre typer vesikkelbeleggproteiner har evnen til spontant å knytte seg til en sfærisk konstruksjon, men bare COPI-og COPII-belagte vesikkel spontant «klemmer av» membranen for å frigjøre vesiklet fra sin opprinnelsesmembran. Clathrin-belagte vesikler krever en ekstern mekanisme for å frigjøre vesiklet (Figur \(\PageIndex{19}\)).
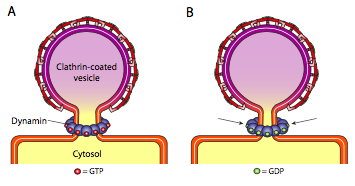
Når vesiklet nesten er ferdig, er det fortsatt en liten stengel eller membranhals som forbinder vesiklet med membranen. Rundt denne stilken aggregerer dynamiske gtp-molekyler i en ring / spiralkonstruksjon. Dynaminmolekyler er globulære Gtpaser som trekker seg sammen ved hydrolyse AV GTP. Når de knytter seg rundt vesikelstengelen, samler hvert dynaminprotein, med den kombinerte effekten av å begrense stengelen nok til at membranen klemmer seg sammen, tetter av og frigjør vesiklet fra den opprinnelige membranen.
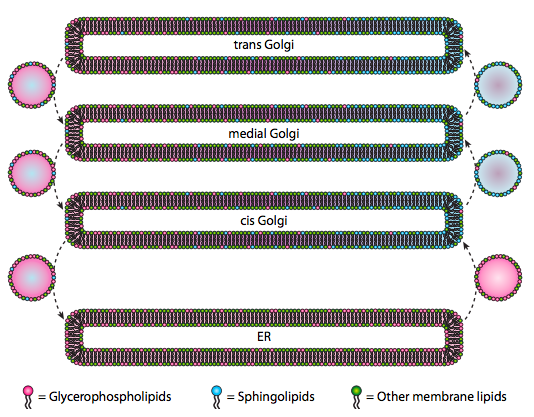
selv om lipider og membraner ble diskutert i kapittel 4, forsømte vi å diskutere plasseringen av deres synteser i eukaryoter. Som Figur \(\PageIndex{20}\) indikerer, er syntesen av visse typer lipider segregert og eksklusiv. Glycerofosfolipider dannes primært i endoplasmatisk retikulum, selv om de også er laget i mitokondrier og peroksisomer. I kontrast er sfingolipider ikke laget I ER (selv om deres ceramidforløpere er) hos pattedyr, er de nødvendige enzymer funnet i lumen av cis og medial Golgi. Det er tegn på anterograd og retrograd vesikulær trafikk mellom De forskjellige Golgi – og ER-romene, noe som teoretisk ville indikere en omfordeling av lipidtyper. Sfingolipidene har imidlertid en tendens til å aggregere seg i lipidflåter og synes å være mer konsentrert i anterograd-bevegelige vesikler.
frakkproteinene kommer av kort tid etter vesikulær frigjøring. For clathrin involverer Prosessen Hsc70, En ATPase. For COPI-eller COPII-belagte vesikler synes imidlertid hydrolysen AV GTP PÅ ARF/Sar1p å svekke coatproteinaffiniteten for adapterne og initierer ubestrøket. GTPase-aktivatoren er ARF GAP (Eller Sec23p) og er en integrert del AV COP I (ELLER II) – kappen.
vesiklene bærer to kategorier av last: oppløselige proteiner og transmembrane proteiner. Av de oppløselige proteinene tas noen opp i vesiklet i kraft av å være bundet til en reseptor. Andre proteiner bare skje for å være i nærheten og er øses opp som vesikkel former. Av og til tas et protein opp som ikke skulle være; FOR eksempel KAN PDI være innelukket i en vesikkel som dannes fra ER. Det har liten funksjon I Golgi, og er nødvendig I ER, så hva skjer med Det? Heldigvis HAR PDI og mange andre er-proteiner En C-terminal signalsekvens, Kdel (Lysin-Asparaginsyre-Glutaminsyre-Leucin), som skriker «jeg tilhører ER.»Denne sekvensen gjenkjennes av kdel-reseptorer inne I Golgi, og binding AV kdel-proteiner til reseptorene utløser vesikeldannelse for å sende dem tilbake til ER.
Sekretoriske vesikler har et spesielt problem med løselig last. Hvis vesiklet bare skulle stole på å omslutte proteiner i det under formasjonsprosessen, ville det være vanskelig å få høye konsentrasjoner av disse proteinene. Mange utskilte proteiner trengs av organismen raskt og i betydelige mengder, så det er en mekanisme i trans Golgi for aggregering av sekretoriske proteiner. Mekanismen bruker aggregerende proteiner som secretogranin II OG chromogranin B som samler målproteinene i store konsentrerte granulater. Disse graninene fungerer best i Trans Golgi-miljøet med lav pH og høy Ca2+, så når vesiklet frigjør innholdet utenfor cellen, bryter høyere pH og lavere Ca2+ aggregatene fra hverandre for å frigjøre de enkelte proteinene.
det er en konsekvent pH-endring under modningen Av Golgi, slik at når vi går fra ER Til Golgi, har hvert rom en gradvis lavere (surere) lumenal pH.
Til Slutt er det spørsmålet om å målrette vesiklene. Vesiklene er mye mindre nyttige hvis de kastes på et molekylært godstog og slippes av tilfeldig. Derfor er det en dockingsmekanisme som krever en matching av v-SNARE-proteinet på vesikelens cytoplasmatiske overflate og t-SNARE på den cytoplasmatiske overflaten av målmembranen. Fusjon av vesiklet til membranen fortsetter bare hvis det er en kamp. Ellers kan vesiklet ikke smelte, og vil feste seg til en annen molekylær motor for å gå til en annen, forhåpentligvis riktig destinasjon. Denne prosessen er hjulpet av tethering proteiner som i utgangspunktet ta kontakt med en innkommende vesikkel og trekke den nær nok til målet å teste FOR SNARE protein interaksjon. Andre proteiner på vesikkel og målet membraner deretter samhandle og Hvis Snarer kamp, kan bidra til å «vinsj» vesikel inn i målet membran, hvorpå membraner sikring. En viktig tommelfingerregel for å forstå vesikulær fusjon og også retningen av membranproteiner og lipider, er at den cytoplasmatiske siden av en membran alltid skal vende mot cytoplasma. Derfor vil et protein som til slutt finnes på den ytre overflaten av cellemembranen, ha blitt satt inn i lumenaloverflaten AV er-membranen til å begynne med.
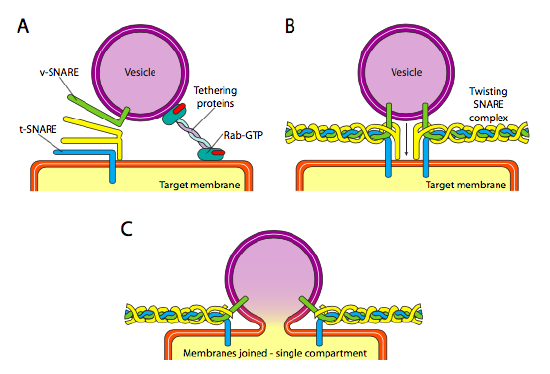
Nærmere bestemt, som en vesikkel nærmer seg målmembranen, tethering-proteinet Rab-GTP, som er knyttet til målmembranen via en dobbel geranylgeranyl lipidhale, knytter seg løst til vesiklet og holder det i nærheten av målmembranen for å gi SNARENE en sjanse til å jobbe. V-Snarer og t-Snarer har nå muligheten til å samhandle og teste for en kamp. Nylig Har Snarene blitt omdøpt Til Henholdsvis R-Snarer og Q-Snarer basert på konserverte arginin – og glutaminrester. I tillegg til disse to primære Snarer, er minst en ANNEN SNARE involvert, sammen danner en bunt av fire α-helices (fire, ikke tre, fordi i det minste i det best studerte eksemplet er en Av Snarene bøyd rundt slik at to av sine alfa-spiralformede domener deltar i samspillet. De fire helikser vikle rundt hverandre, og det er antatt at når de gjør det, de trekker vesiklet og målet membranen sammen.
tetanustoksin, tetanospasmin, som frigjøres av Clostridium tetani-bakterier, forårsaker spasmer ved å virke på nerveceller og forhindre nevrotransmitterfrigivelse. Mekanismen for dette er at den spalter synaptobrevin, ET SNARE-protein, slik at de synaptiske vesiklene ikke kan smelte sammen med cellemembranen. Botulinumtoksin, Fra Clostridium botulinum, virker også På Snarer for å forhindre vesikkelfusjon og nevrotransmitterfrigivelse, selv om den retter seg mot forskjellige nevroner og så har motsatt effekt: tetanus er forårsaket av å forhindre frigjøring av hemmende nevrotransmittere, mens botulisme er forårsaket av å forhindre frigjøring av eksitatoriske nevrotransmittere.