Cell adhesjon
Cell adhesjon er prosessen som celler samhandle med spesifikke molekyler på celleoverflaten og feste til tilstøtende celler. Denne prosessen kan skje gjennom direkte eller indirekte interaksjoner mellom celleoverflater, hvor cellene fester seg til den omkringliggende ekstracellulære matrisen, som inneholder molekylene som frigjøres av cellene inn i rommet mellom cellene. Celleadhesjon oppstår når celleadhesjonsmolekylet (CAM) interagerer med et transmembranprotein plassert på celleoverflaten. Celleadhesjon kobler celler på forskjellige måter og kan delta i signaltransduksjon for å tillate celler å oppdage og reagere på endringer i omgivelsene. Andre cellulære prosesser regulert av celleadhesjon inkluderer cellemigrasjon og vevsutvikling i flercellede organismer. Endringer i celleadhesjon kan forstyrre viktige cellulære prosesser og føre til en rekke sykdommer, inkludert kreft og leddgikt. Celleadhesjon er også viktig for sykdommer forårsaket av smittsomme organismer som bakterier eller virus.
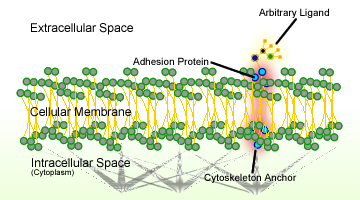 Figur 1. Skjematisk av celleadhesjon
Figur 1. Skjematisk av celleadhesjon
Klassifikasjoner
CAMs er delt inn i fire hovedfamilier: integriner, immunoglobulin (Ig) superfamily, cadherin og selectins. Hver av disse adhesjonsmolekylene har en annen funksjon og gjenkjenner en annen ligand. Kadheriner og immunglobuliner er homotypiske Kam fordi de binder seg direkte til samme TYPE KAM på en annen celle, mens integriner og selectiner er heterologe Kam som binder seg til forskjellige TYPER KAM. Defekter i celleadhesjon er ofte tilskrevet defekter I CAMs uttrykk. I flercellede organismer forårsaker binding mellom Kamene at cellene holder seg til hverandre og danner en struktur som kalles en cellekobling.
i henhold til deres funksjoner kan cellekryssene klassifiseres som:
Forankringskryss (adherenskryss, desmosomer og hemidesmosomer), som opprettholder celler langs og styrker kontakten mellom celler.
Okkluderende veikryss (tette veikryss), som tetter hull mellom celler gjennom celle-cellekontakt, og skaper en vannbestandig barriere for diffusjon.
Kanaldannende veikryss (gapkryss), som forbinder protoplasma av tilstøtende celler som tillater transport av molekyler mellom celler.
Signal-relaying veikryss, som kan være synapser i systemet.
Alternativt kan cellekryss klassifiseres i 2 hovedvarianter i tråd med hva som interagerer med cellen: celle-cellekryss, i hovedmediatet av cadheriner, og celle-matrisekryss, i hovedmediatet av integriner.
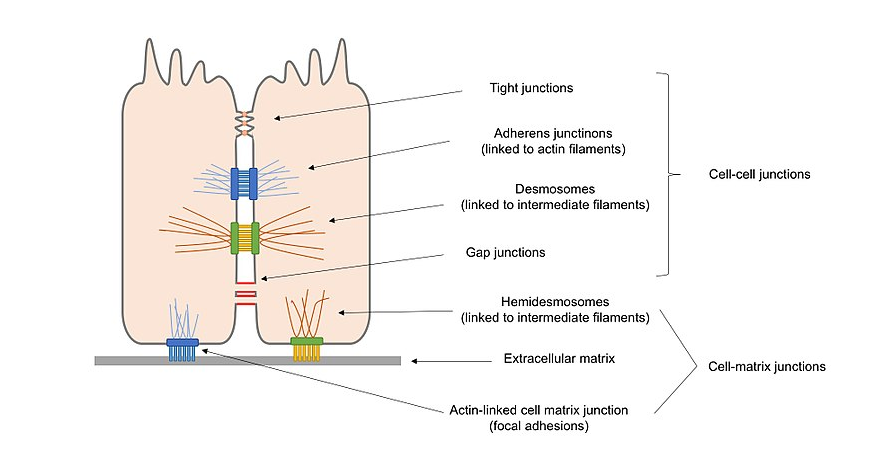 Figur 2. Oversikt diagram av ulike typer celle veikryss tilstede i epitelceller, inkludert celle-celle veikryss og celle-matrise veikryss.
Figur 2. Oversikt diagram av ulike typer celle veikryss tilstede i epitelceller, inkludert celle-celle veikryss og celle-matrise veikryss.
Strukturelle Egenskaper Av Celleadhesjonsproteiner
celleadhesjonsproteiner er vanligvis glykoproteiner som medierer celle-celle og celle ekstracellulær matriksgjenkjenning på den ekstracellulære overflaten. De fleste celleadhesjonsmolekyler har lignende konformasjoner i deres klebende domener. For eksempel: adhesive domener av cadherin, Immunoglobulinlignende, fibronektin TYPE III og EGF er overveiende β-arkstrukturer. Det vanlige motivet som er involvert i celleadhesjon er den greske nøkkelfat-strukturen som inneholder en eller to anti-parallelle β smørbrød.
ig-lignende domener er en stor klasse av greske nøkkeldomener. De har sekvenslikheter med det variable eller konstante domenet til antistoffer som inneholder syv til ni antiparallelle β tråder. De antiparallelle p-arkene danner en 3-D β-fat. Ig-lignende domener stabiliseres av hydrofobe kjerne-og disulfidbindinger. De er delt inn i to store sett: ig C-lignende og Ig V-lignende domener.
Funksjonelt Relaterte Strukturelle Egenskaper Av Celleadhesjonsproteiner
celleadhesjonsproteiner har funksjonelt mangfold. Interaksjon av celleadhesjonsmolekyler kan være homofile eller heterofile protein-protein-interaksjoner eller protein-karbohydratinteraksjoner. Strukturelle endringer i celleadhesjonsmolekylene er ofte relatert til deres funksjonelle egenskaper.
Homofile Protein-Protein-Interaksjoner.
for eksempel er cadheriner transmembrane Ca2+-avhengige homofile adhesjonsmolekyler. Kadheriner er ansvarlige for vedlikehold av kryssene mellom lignende celler i vev. Cellecelleadhesjon medieres gjennom det n-terminale domenet til cadherinene. Den inneholder fem lignende ekstracellulære domener EC1 TIL EC5. Røntgenkrystallografiske studier I N-cadherin viste AT EC1-domenet danner en dimer, hvor monomerene er orientert parallelt med deres klebende bindingsoverflate som peker utover fra plasmamembranen. Monomerenhetene I EC1-domener interagerer med hverandre på en antiparallell måte, ved hjelp av deres klebende bindingsflater og danner en β-barrel struktur. Et antatt grensesnitt av samspillet ble foreslått å ha både hydrofob og polar / ladet karakter som etterligner grensesnittet for samspillet mellom immunoglobulin-domener med hverandre i Ig-superfamilien.
Heterofile Protein-Protein-Interaksjoner.
for eksempel er binding av integrinene til forskjellige celleoverflatereceptorer og ekstracellulære matriksligander en stor klasse av heterofil protein-proteininteraksjon i celleadhesjonssystemer. Ved binding til oppløselig fibrinogen omdannes integrin aIIbß3 til en bindingstilstand med høy affinitet. Konformasjonsendringene av integrinet indusert av ligandbinding i dette tilfellet er kritiske for limaktiviteten. Binding av En t-cellereseptor kan også modulere bindingsaffiniteten til integrinet, leukocyttfunksjonen assosiert antigen-1 (LFA-1), til dets reseptorer SOM ICAM – l eller ICAM-2 (intercellulær celleadhesjonsmolekyl). Binding AV ICAM-l kan videre indusere konformasjonsendringer AV LFA-1. Limbindingsstedet til proteinet er lokalisert I C-terminalen TIL LFA-l basert på Røntgenkrystallografisk studie.Et tripeptid, arginin-glysin-asparaginsyre (RGD), er et vanlig integrinligandbindende motiv. For eksempel har integrinbindende ligand TYPE III-modul av fibronektin en gresk nøkkelfat struktur, HVIS rgd-motiv, plassert ved toppunktet Av sløyfen som forbinder F Og G β tråder, medierer adhesjon. Retting AV RGD-sløyfen til en mer lineær fluktuerende konformasjon ved utfoldelse reduserer tilgjengeligheten av sløyfen til overflatebundne integriner, og reduserer derfor affiniteten og selektiviteten til bindingen.
Protein-Karbohydrat-Interaksjoner.
selektinene er viktige ved lymfocytt-og nøytrofilinteraksjon med vaskulært endotel. Selectins er adhesjonsmolekyler som binder seg til karbohydrater. Det er ennå ikke noen direkte strukturelle data om binding av selectiner til karbohydrater. Selectins binder karbohydrater med lav affinitet og har svært raske på og av priser.