Innledning
Vev, celler og de mindre strukturer inne i celler (organeller) er for det meste vann og er derfor gjennomsiktige. Imaging små gjennomsiktige poser med vann resulterer i bilder som ikke inneholder mye informasjon, og i mikroskopi er det viktig å ha en slags kontrast eller flekk som vil gi områder av prøvefargen og gjøre dem langt lettere å se. I tillegg, hva om du bare vil vise noen av de mindre strukturer inne i en celle, som en kjerne eller en cellemembran? Farging av hele cellen ville gjøre det umulig å lokalisere områdene du er interessert i.
Fluorescens løser begge disse problemene med kontrast og lokalisering. Fluorescens er der et objekt vil avgi lys etter absorberende lys. Mange forskjellige objekter utviser fluorescens, som mineraler (ordet fluorescens kommer fra mineralfluoritt), dyphavsfisk (mest kjent maneter aequorea victoria, hvorfra grønt fluorescerende protein (GFP) ble oppdaget), planter, kjemikalier og mange flere.
Fluorescerende molekyler (kjent som fluoroforer) brukes til å merke prøver, og fluoroforer er tilgjengelige som avgir lys i nesten hvilken som helst farge. I et fluorescerende mikroskop er en prøve merket med en fluorofor, og deretter brukes et sterkt lys (eksitasjonslys) for å belyse prøven, som avgir fluorescens (utslippslys). På denne måten er prøvene sterkt kontrastert til den svarte bakgrunnen da fluoroforen avgir et lyst farget lys. Ved å lokalisere disse fluoroforene til området av interesse et klart bilde av noen del av en celle kan tas, noe som gjør fluorescens mikroskopi et kraftig verktøy for biovitenskap.
Brightfield vs Fluorescens Imaging
i brightfield mikroskopi, er prøven opplyst med overført hvitt lys. Dette skaper en jevn belysning av prøven under mikroskopet for å observere svært kontrasterte, fargede eller naturlig pigmenterte prøver. Brightfield er imidlertid ikke tilstrekkelig til å skille mellom gjennomsiktige / gjennomskinnelige, unstained celler eller cellulære strukturer for å studere prosesser av interesse.
Fluorescensmikroskopi er avhengig av bruk av fluoroforer, molekyler som avgir lys av en bestemt synlig bølgelengde når de utsettes for lys av en annen bølgelengde. Når disse fluoroforene er bundet til en målrettet struktur av interesse, kan fotoner utgitt fra fluoroforen brukes til å visualisere denne strukturen av interesse. Fordelen med fluorescensmikroskopi er at de målrettede strukturer er opplyst mens uønskede områder av prøven har liten eller ingen fluorescens, noe som åpner for enkel målretting og avbildning.
Hvorfor Molekyler Fluorescerer
opprinnelsen til fluorescens er elektroner som beveger seg fritt rundt den aktive fluoroforen og frigjør absorbert energi, som vist I Fig.2.
før eksitasjon er elektroner i laveste energitilstand tilgjengelig for dem-grunntilstanden (S0). Når et elektron blir truffet med en foton av et bestemt energirekkevidde, absorberer elektronen energien til fotonet og hopper opp Til en høyere energitilstand (S1, S2 eller S3). For å gå tilbake til grunntilstanden (S0), frigjør elektronen den ekstra energien som utslipp av en foton. Energien til denne fotonen er mindre enn eksitasjonsenergien, så den har en lengre bølgelengde. Dette er grunnen til at emisjonslyset har en lengre bølgelengde enn eksitasjonslyset og kan vises som en annen farge.
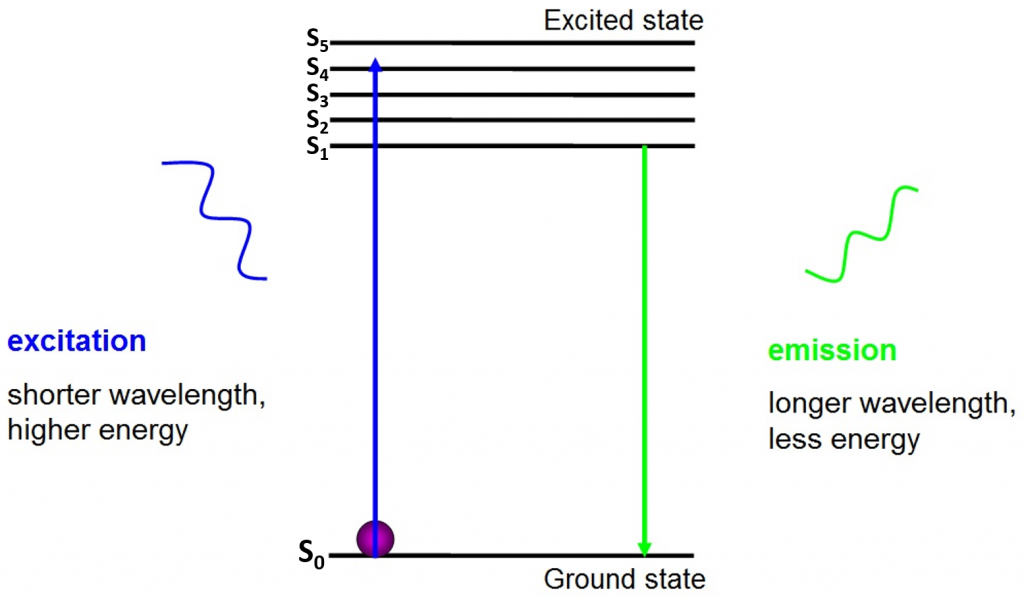
den utstrålede fotonen er vanligvis i det synlige spektret og kan ses under et mikroskop hvis det er nok spente fluoroforer. Bølgelengden til den frigjorte fotonen er spesifikk for hver fluorofor, og denne forutsigbarheten muliggjør enkel fluorescensavbildning.
Fluorescensintensitetsfaktorer
mens fluoroforer kan avgi fluorescens av en forutsigbar bølgelengde, er det også viktig å vite hvilke faktorer som styrer fluorescensintensiteten. Uten en intens nok utslipp av lys, vil fluorescensen ikke påvises med et mikroskop.
Quantum Yield
quantum yield (ϕ) av en fluorofor er forholdet mellom antall frigjorte fotoner til antall absorberte fotoner. Kvanteutbyttet uttrykkes ofte som en verdi fra 0-1, hvorav 1 er 100% effektivitet av fotonkonvertering. Det er også viktig å merke seg at hver fluorofor har en unik pH, ionisk styrke og temperatur for optimal fluorescenseffektivitet.
Utryddelseskoeffisient
Hver fluorofor har en annen kapasitet til å absorbere fotoner, selv om de er innenfor et passende bølgelengdeområde for å opphisse det. Hvis en fluorofor eksponeres for et foton som samsvarer med eksitasjonsbølgelengden, er sannsynligheten for at et foton vil bli absorbert en målbar egenskap og kjent som utryddelseskoeffisienten (ε).
en fluorofores kvanteutbytte og utryddelseskoeffisient vises ofte sammen for å beskrive hvor lyst fluoroforen er vist å være i eksperimentelle innstillinger.
Fluorescens Levetid
når et fluoroforelektron absorberer et foton, frigjør det ikke umiddelbart et lengre bølgelengdefoton. Frigivelsen av noe energi mellom spente energitilstander er kjent for å ta forskjellige lengder av tid. Hvor mye tid som et elektron bruker i opphisset tilstand før du slipper en foton og tilbake til grunntilstanden er en måling av fluorescens levetid. Levetiden til hver fluorofor er unik og kan måles eksperimentelt. Når du bruker fluorescerende fargestoffer eksperimentelt, er det nyttig for deres levetid, spesielt for applikasjoner som krever høy hastighet, for eksempel kalsiumavbildningsneuroner.
Eksitasjon Bølgelengde Intensitet
de fleste fluorescerende mikroskopi oppsett inkluderer en kilde til lys som kan stilles inn for å sende ut ønsket bølgelengdeområde. Mange fluorescerende lyskilder kan også justeres for eksitasjonsintensitet for å øke antall fotoner som beveger seg gjennom lysbanen. I en fluorescent-merket prøve som er utsatt for sin eksitasjonsbølgelengde, vil hver fluorofor ikke bli aktivert samtidig. Ved å øke eksitasjonsintensiteten og øke antall fotoner som når prøven, er det en høyere sannsynlighet for at flere fluoroforer vil bli begeistret.
Fotostabilitet
Fotostabilitet er evnen til et molekyl eller en organisme til å motstå skade. I fluorescensmikroskopi vil fluoroforer til slutt slutte å absorbere motgående fotoner og gå inn i en permanent mørk tilstand. Som en organisme samler flere fluoroforer i mørk tilstand, reduserer utseendet til det merkede målet, og prøven sies å være fotobleking. I fluorescensmikroskopi blir det ofte tatt skritt for å redusere mengden fotobleking som oppleves under eksperimentering. Noen tiltak inkluderer en reduksjon i intensiteten av lys som interagerer med prøven og bruk av spesialiserte fluorescerende fargestoffer som ikke forblir aktive så lenge som andre fargestoffer.
Fluorescensmikroskopi
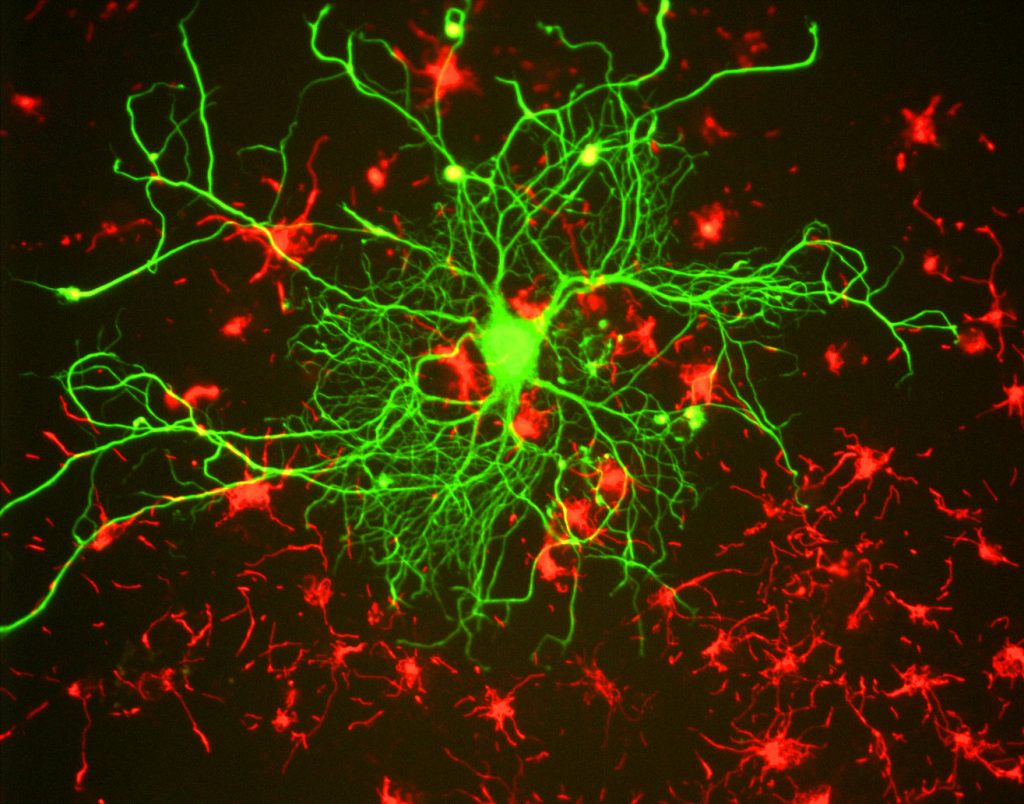
for forskere er den viktigste fordelen med fluorescens evnen til å bruke fluorescensmikroskopi, hvor prøvene er merket/farget med et fluorescerende stoff som et fargestoff, antistoff eller protein, slik at bildene kan ha kontrast. Ved å målrette disse fluorescerende etikettene, kan forskere velge hva de vil se. Dette er demonstrert I Fig.3, hvor en nevron kan sees tydelig blant astrocytter, som de er merket med forskjellige farger av fluorescerende markør.
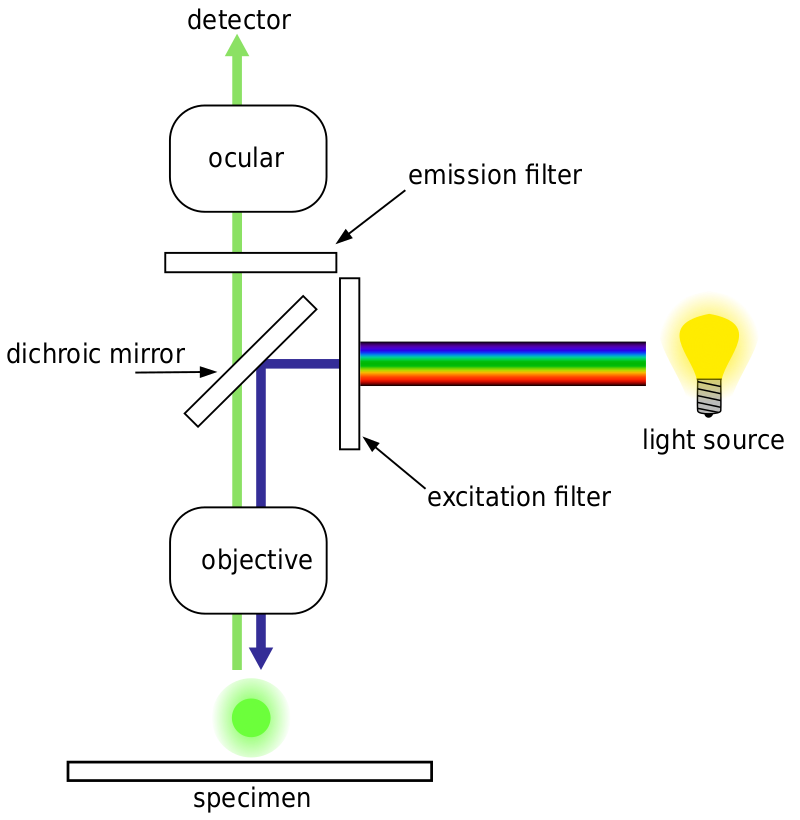
generelt, for fluorescensmikroskopi, er en prøve merket med fluorescerende markører (typisk spesifikk for visse deler av prøven). Prøven blir deretter opplyst med den spesifikke eksitasjonsbølgelengden for fluoroforen, og den resulterende emisjonsfluorescens mottas av detektoren, vanligvis et følsomt vitenskapelig kamera.
de fleste fluorescensmikroskop er epifluorescensmikroskop, hvor eksitasjon og utslipp gjøres gjennom samme lysbane. Både eksitasjonsbelysningen og den utstrålede fluorescensen passerer gjennom mikroskopets mål og filtreres vanligvis for å bare oppdage fluorescensen. Dette oppsettet er vist I Fig.4.
Autofluorescens
noen strukturer, biologiske organismer og generelle mikroskopiprøver kan naturlig utvise fluorescens, kjent som autofluorescens. Dette er forskjellig fra fluorescens fra merkede prøver, men det deler ofte lignende bølgelengder, noe som betyr at autofluorescensmikroskopi prøver kan skjule kunstig tilsatt fluorescens og forstyrrer deteksjon, reduserende signal. Det er viktig å vite om prøvene viser autofluorescens, da dette vil påvirke noen fluorescens avbildning gjort med mindre bestemte bølgelengder brukes til å unngå det.
Vanlige eksempler på autofluorescerende objekter er mitokondrier, lysosomer, kollagen og noen aminosyrer som tryptofan, tyrosin og fenylalanin. Mest spesielt er autofluorescens vanlig i planter på grunn av deres bruk av klorofyll og andre fluorescerende molekyler som ligniner og karotener. Fig.5 viser de forskjellige fargene på autofluorescens fra en umerket Furuprøve.
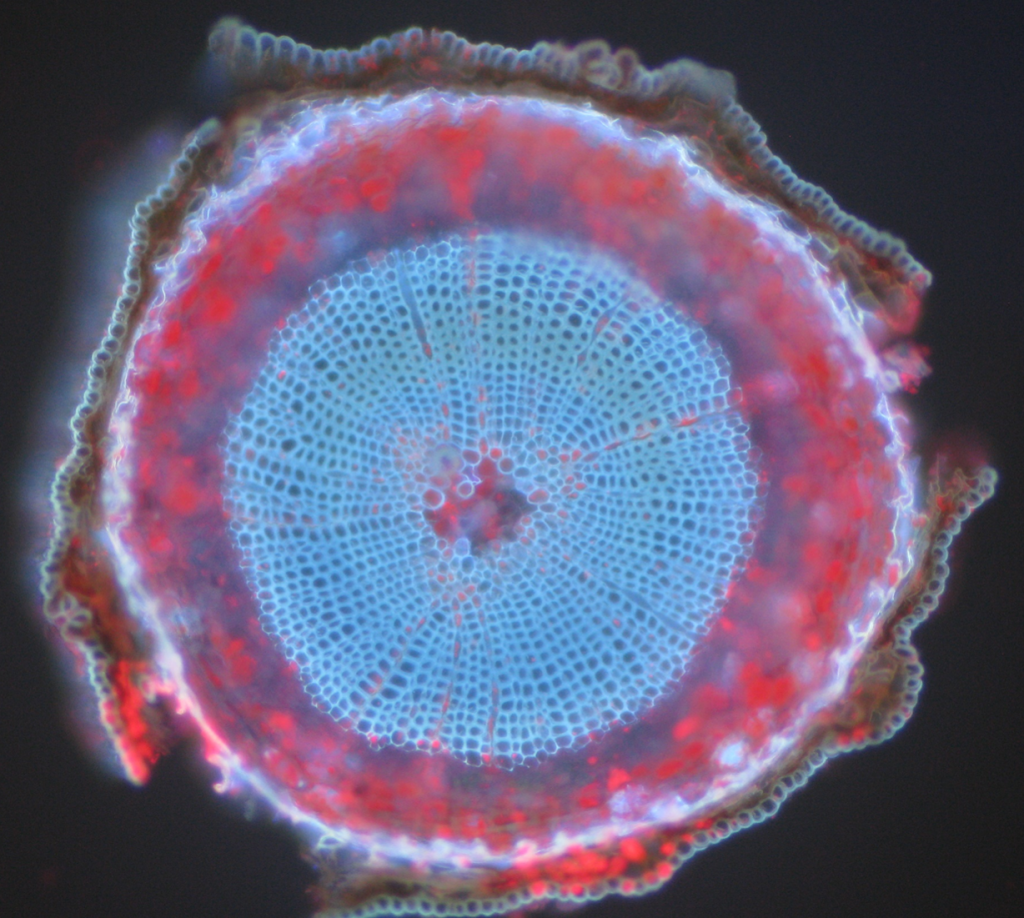
Oppsummering
Siden theintroduction av den første fluorescerende fargestoff, har fluorescens mikroskopi blitt aheavily utnyttet verktøy for å visualisere celler og cellestrukturer med higherspecificity enn tradisjonelle brightfield mikroskopi teknikker. Forskere kanmanipulere strukturen, optiske egenskaper og sonde av interesse influorescens eksperimenter for å oppnå relevante data. Slik fleksibilitet har tillattfluorescensmikroskopi som skal inkluderes imange livsvitenskapseksperimenter.
avhengig av type prøve og fluorofor, bør et vitenskapelig kamera velges nøye for å oppnå de beste bilderesultatene.
- Lysmikroskopi. (2009) Natur Milepæler. MacMillan Publishers Limited, 6-22.
- Lavis, L. D., & Raines, R. T. (2008). Lyse Ideer For Kjemisk Biologi. ACS Kjemisk Biologi, 3 (3): 142-155.
- Liu, Y., Lilly, D. (2017) Krystallstrukturer hvis Cyaninfluoroforer Stabler på Enden Av Dobbeltstrenget RNA. Biofysisk Tidsskrift, 113, (11): 2236-2343.
- Berezin, M. Y., Achilefu, S. (2010). Fluorescens Livstidsmålinger og Biologisk Avbildning. Kjemiske Anmeldelser, 110( 5): 2641-2684.
- Stockert, J., Blazquez-Castro, A. (2017) Fluorescensmikroskopi I Biovitenskap. Sharjah, UAE. Bentham Science Publishers (Engelsk).
- Berezin, M. Y., & Achilefu, S. (2010). Fluorescens Livstidsmålinger og Biologisk Avbildning. Kjemiske Anmeldelser, 110( 5): 2641-2684.
- Denk, W., Strickler, J., Webb, W. (1990). To-Foton Laser Skanning Fluorescens Mikroskopi. Science. 248, (1951): 73-76.
- Så, P. (2002). To-foton Fluorescens Lysmikroskopi. Macmillan Publishing Group (Engelsk).
- Schermelleh, L., Heinztmann, R., Og Leonardt, H. (2010). En Guide Til Superoppløsning Fluorescensmikroskopi. Tidsskrift For Cellebiologi 190 (2): 165-175.
- Betzig, E., Patterson, Gh, Sougrat, R., Lindwasser, Ow, Olenych, S., Bonifacino, Js, Davidson, Mw, LippincottSchwartz, J., Hess, Hf (2006) Imaging intracellulære fluorescerende proteiner ved nanometer oppløsning. Science. 313(5793): 1642-5
- Rust, M. J., Bates, M. & Zhuang, X. (2006) Sub-diffraksjon-grense bildebehandling av stokastisk optisk rekonstruksjon mikroskopi (STORM). Nat Metoder. 2, (10):793-5.
- Rego, E., Shao, L., Macklin, J. Winoto, L., Johansson, G., Kamps-Hughes, N., Davidson, M. og Gustasson, M. (2010) PNAS. 109 (3): e135-a143.
- Jungmann, R., Avendañ, Ms, Woehrstein, Jb, Dai, M., Shih, Wm & Yin, P. (2014) Multipleksert 3d-cellulær superoppløsningsavbildning med DNA-MALING og Utvekslingsmaling. Nat Metoder. 11(3): 313-318
- J., Wang, L., Carroll, S., Chen, J., Wang, M., Og Wang, J. (2018) Challenges and Opportunities for Small Molecule Fluorescent Probes in Redox Biology Applications. Antioxidants & Redox Signaling. Mary Ann Liebert, Inc.