Kcsa Kanal: Struktur
dette papiret vil fokusere På KcsA, en kalium kanal Fra Streptomyces lividans, som inneholder to domener. Den første er den transmembrane delen, som inneholder 120 rester. Dette vil bli diskutert i detalj nedenfor. Det andre domenet er et cytoplasmatisk domene som inneholder ca 40 rester. Det cytoplasmatiske domenet bidrar til stabiliteten i lukket tilstand. Dette konkluderes basert på data som viser en reduksjon i effektiviteten av kanalfolding og montering og termisk stabilitet som påvirker når det cytoplasmatiske domenet fjernes fra krystallstrukturen.5 som vist I Figur 2, er det vannfylte c-terminale cytoplasmatiske domenet 4-helix buntstruktur som strekker seg lineært mot cytoplasma.5-6 DET har blitt vist ved elektronparamagnetisk resonans, EPR, data produsert Av Uysal, At C-terminalen har en strekk som buler ut hvor C-terminaldomenet møter transmembrandomenet.5 denne strekningen av helix som forbinder de to har en høyere grad av fleksibilitet enn de andre delene som potensielt spiller en rolle under åpningen av kanalen.5 Det er fortsatt mye forskning som må gjennomføres for å forstå funksjonaliteten Til C-terminal-domenet fullt ut. En foreslått funksjon av domenet er at den kan tjene som en reseptor for et uidentifisert plasmisk aktivatorprotein eller ligand, men andre hevder at det ikke er noen signifikant effekt på penetrasjonsbanen for ion. Strukturen inneholder ennå ikke orientering av noen sidekjeder, men arrangementet av heliksene antyder elektrostatiske interaksjoner i underenheten.6 Figur 3, viser hvordan cytoplasmatisk domene sammenligner mellom en åpen kanal vs. en lukket kanal med to bakteriekanaler.7 resten av papiret vil fokusere på transmembrane domenet som velger for kalium.
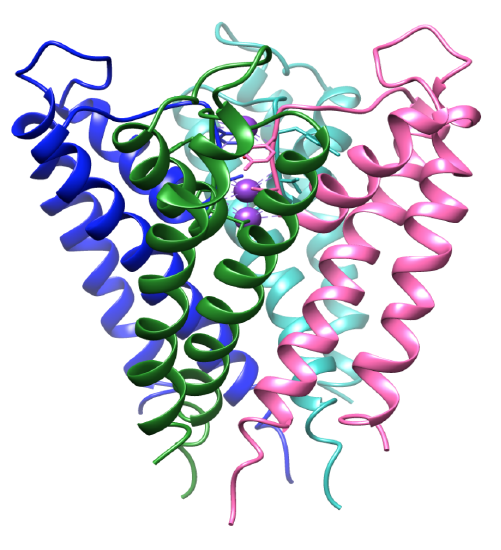
Figur 3. Det transmembrane domenet. Hver underenhet er farget annerledes og kaliumioner er lilla. PDB 1BL8.
selektiviteten for kaliumioner er avhengig av strukturen til kaliumkanalselektivitetsfilteret. Koordinasjonsmiljøet til kanalen har selektive ligander som binder seg spesielt til kaliumioner.8 kaliumkanalproteinet er en tetramer, som inneholder fire identiske underenheter som danner en sentral pore.8-9 ioner strømmer inn i en pore som åpner og lukker, styrer ionene til det sentrale hulrommet. Underenhetene inneholder to alfa-helikser hvor en vender mot den sentrale pore, indre helix, og en vender mot lipidmembranen, ellers kjent som den ytre helixen.3 sammen med indre og ytre helikser inneholder hver underenhet en porehelix.3,8 underenhetene er vippet, som vist i Figur 3, hvor selektivitetsfilteret er nær membranets ekstracellulære overflate. De fire indre heliksene er strukturert på en måte hvor de kommer sammen nær den intracellulære overflaten. Både intra-og ekstracellulære innganger er negativt ladet av sure aminosyrer. Dette muliggjør en høyere konsentrasjon av kationer nær membranen og mindre anioner på grunn av de motsatte ladningene.8

Figur 4. Kaliumkanal (Kcsa-struktur Fra Streptomyces lividans) med viktige strukturelle komponenter merket. De viktigste aspektene å merke seg er pore, hulrom og selektivitet filter (SF). Dette er de delene av kanalen hvor kaliumioner reiser gjennom. For det første strømmer ionen gjennom porene og går inn i hulrommet hydrert når porene er åpne. Deretter blir en kaliumion dehydrert og valgt for å reise gjennom SF hvor den da kommer inn i cellen. Merk at bare to underenheter vises i dette bildet for enklere visualisering. PBD 1K4C.
poreområdet ble først identifisert med poreblokkerende skorpiontoksiner. De interagerer med aminosyrer ved inngangen til porene som forårsaker blokkering og dysfunksjon. Porene er hvor kaliumionet kommer inn, hvor det overføres til det sentrale hulrommet, som vist i Figur 4. I løpet av denne tiden forblir kaliumion hydrert.8 den intracellulære pore er funksjonen til kanalen som gjør at kaliumioner kan komme inn i cellen når den er åpen, eller blokkeres fra å komme inn når den er lukket. Kanalene åpnes når det er en endring i membranpotensialet, slik at en tilstrømning av kaliumioner inn i hulromfilteret. Når selektiv binding oppstår i selektivitet filteret, faller potensialet over membranen, og dermed lukke pore.1 pore og hulrom er hydrofobisk foret, slik at evnen til å senke elektrostatisk barriere. Det må være en lavere elektrostatisk barriere, slik at den energiske kostnaden for dehydrering kompenseres på grunn av den store energibarrieren for iongjennomtrengning (dielektrisk barriere). Dermed gir det vannfylte hulrommet et energisk gunstig miljø.3,8,10,11
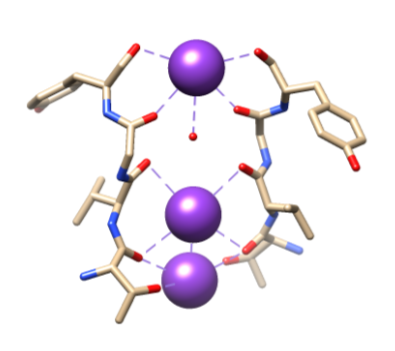
Figur 5. Binding av kaliumioner (lilla) til spesifikke ligander av ryggraden O ‘ s Av Thr 75, Val 76, Gly 77 og Tyr 78. Full koordinering vises ikke her for enklere visualisering. Gjengitt Fra Samsom.11
deretter må ionene velges i selektivitetsfilteret (sf), som er foret med polare hovedkjedeatomer som tilhører aminosyrer. SF er så smal at ionene først må dehydreres før de kommer inn i den. Det er to viktige funksjoner I SF. For det første oppretter hovedkjedeatomer passende dimensjoner for å koordinere et dehydrert kaliumion ved stabling, og dermed lage sekvensielle oksygenringer. Dette skaper en svært liten avstand at kaliumionet må reise for å nå hvert sted mens du reiser gjennom filteret. Dette danner en sekvens av fire kubikk åttedelte koordinasjonssteder, som vist i Figur 6.3,8 til enhver tid, disse områdene er okkupert av to K + ioner og to vannmolekyler i en vekslende sekvens den andre funksjonen er protein pakking rundt SF, som følger en sekvens Av T-V-G-Y-G, vist I Figur 5.9 Ledning kan da oppstå når to kaliumioner inn I SF, forårsaker en balanse mellom tiltrekkende kraft som oppstår fra sf til ion med frastøtende kraft som oppstår mellom de to kaliumioner.8 denne frastøtningen hjelper kaliumioner med å overvinne sin indre affinitet for binding tett til bindingsstedene.3 Videre diskusjon av valgmekanismen vil bli diskutert nedenfor.
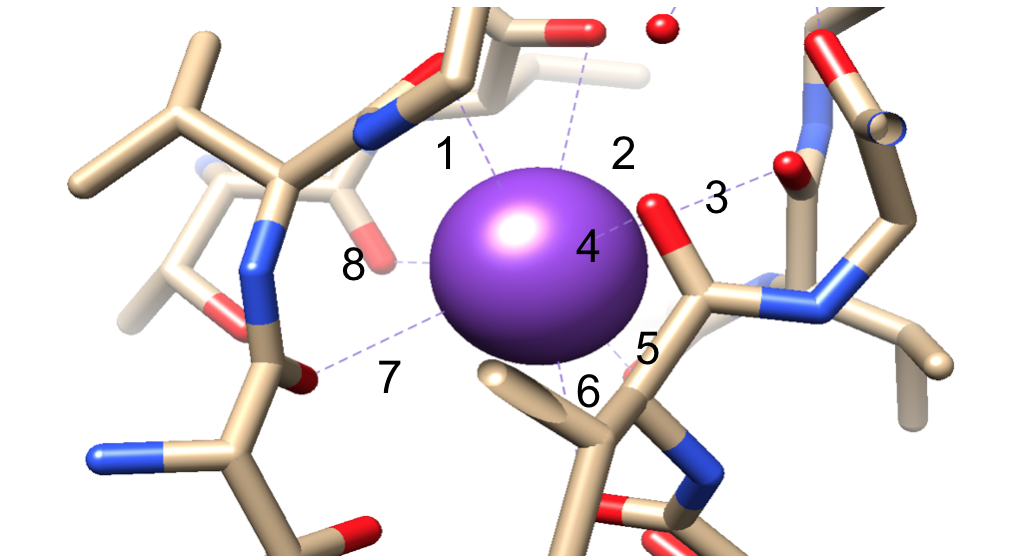
Figur 6. Et eksempel på en kaliumion (lilla) i et åttedelt koordinasjonssted. Binding nummerert for enklere visualisering.