tilsetning av en karbohydratdel til et proteinmolekyl refereres til som proteinglykosylering. Det er en vanlig post-translasjonell modifikasjon for proteinmolekyler involvert i cellemembrandannelse. Under denne prosessen setter bindingen av monosakkaridenheter til aminosyrekjedene opp scenen for en rekke enzymatiske reaksjoner som fører til dannelsen av glykoproteiner (n og o-koblede oligosakkarider som finnes i en proteinenhet). I alle 16 kjente enzymer skal mediere denne reaksjonen. Et typisk glykoprotein har minst 41 bindinger som involverer 8 aminosyrer og 13 forskjellige monosakkaridenheter og inkluderer glykofosfatidylinositol (GPI) og fosfoglykosylbindinger. Protein glykosylering hjelper i riktig folding av proteiner, stabilitet og i celle til celle adhesjon vanligvis trengs av celler i immunsystemet. De viktigste stedene for proteinglykosylering i kroppen er Er, Golgi kroppen, kjernen og cellevæsken.
Proteinglykosylering kan kategoriseres i to hovedtyper:
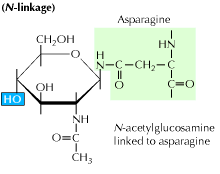 a) N-bundet glykosylering: den begynner med tilsetning av en 14-sukkerforløper til en asparaginaminosyre. Den inneholder glukose, mannose og n-acetylglukosaminmolekyler. Denne enheten overføres deretter TIL ER lumen. Oligosakkaryltransferase-enzymet fester oligosakkaridkjeden til asparagin som oppstår i tripeptid-sekvensen, Asn-X-Ser eller Asn-X-Thr. X kan være hvilken som helst aminosyre annet Enn Prolin. Den oligosakkarid-vedlagte proteinsekvensen foldes nå riktig og er nå translokert Til Golgi-kroppen hvor mannoseresten fjernes.
a) N-bundet glykosylering: den begynner med tilsetning av en 14-sukkerforløper til en asparaginaminosyre. Den inneholder glukose, mannose og n-acetylglukosaminmolekyler. Denne enheten overføres deretter TIL ER lumen. Oligosakkaryltransferase-enzymet fester oligosakkaridkjeden til asparagin som oppstår i tripeptid-sekvensen, Asn-X-Ser eller Asn-X-Thr. X kan være hvilken som helst aminosyre annet Enn Prolin. Den oligosakkarid-vedlagte proteinsekvensen foldes nå riktig og er nå translokert Til Golgi-kroppen hvor mannoseresten fjernes.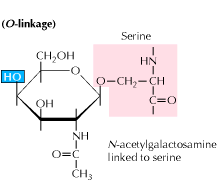
b) O-bundet glykosylering: Glykosylering begynner med en enzymmediert tilsetning Av N-acetyl-galaktosamin etterfulgt av andre karbohydrater til serin-eller treoninrester. Studier viser At o koblet glykosylering skjer på et senere stadium i proteinbehandling.