naast de eiwitverwerking verzorgen ER en Golgi ook enkele soorten eiwittransport. Blaasjes (membraan-gebonden bellen, in wezen) knijpen weg van de ER, Golgi, en andere membraneuze organellen, die met hen wat oplosbare moleculen waren binnen de vloeistof die evenals om het even welke molecules in die sectie van membraan werd ingebed. Deze blaasjes vangen dan een rit op een moleculaire motor zoals kinesin of myosin, en reizen langs het cytoskeleton tot zij dok bij de aangewezen bestemming en smelten met het doelmembraan of organelle. Over het algemeen bewegen blaasjes van de ER naar de cis Golgi, van de cis naar de mediale Golgi, van de mediale naar de trans Golgi, en van de trans Golgi naar het plasmamembraan of andere compartimenten. Hoewel de meeste beweging in deze richting is, zijn er ook blaasjes die terug bewegen van de Golgi naar de ER, die eiwitten dragen die verondersteld werden in de ER te blijven (bijv. PDI) en werden per ongeluk opgeschept in een blaasje.
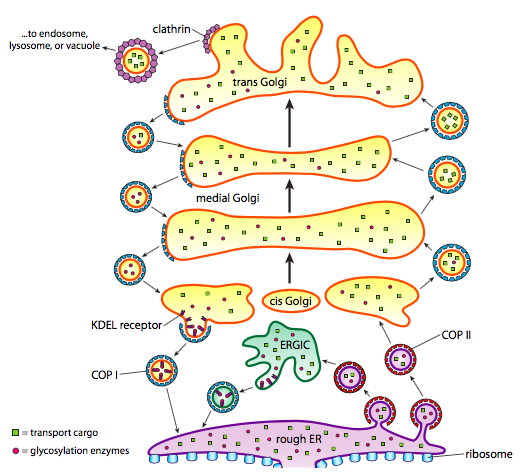
de vorming van blaasjes is afhankelijk van vachteiwitten die, onder de juiste omstandigheden, zelf-assembleren tot bolvormige kooien. Wanneer geassocieerd met transmembrane proteã nen, kunnen zij het in bijlage membraan langs in een sferische vorm ook trekken. De belangrijkste die types van laagproteã nen in blaasjesvorming worden gebruikt zijn COPII, COPI, en clathrin.
copii coat proteïnen vormen de blaasjes die van er naar Golgi gaan. COPI coat proteã nen worden gebruikt tussen delen van het Golgi-apparaat evenals om blaasjes te vormen die van Golgi terug naar ER gaan. Tenslotte wordt clathrin gebruikt om blaasjes te vormen die de Golgi verlaten voor het plasmamembraan evenals voor blaasjes die uit het plasmamembraan voor endocytose worden gevormd.
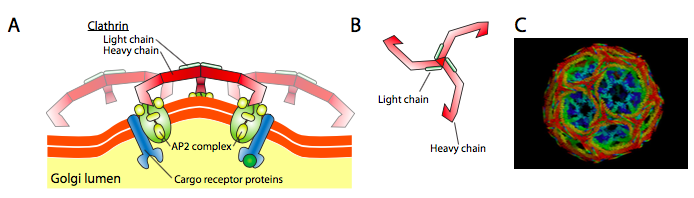
Clathrin (figuur \(\Pagindex{17}\)) is het best beschreven van de drie, en de vesiculaire vachten zijn gemaakt van arrangementen van clathrin triskelionen (uit het Grieks, wat driebenig betekent). Elke triskelion is samengesteld uit drie zware kettingen die aan het c-Eindpunt worden verbonden, en drie lichte kettingen, één die aan elke zware ketting wordt geassocieerd. De zware kettingen van verschillende triskelions interageren langs de lengte van hun zware ketting “benen” om een zeer stevige constructie te creëren. De lichte kettingen zijn onnodig voor blaasjesvorming, en worden verondersteld om toevallige interactie van clathrinmolecules in het cytoplasma te helpen verhinderen.
er is een significante overeenkomst tussen de blaasvormingsmechanismen met behulp van deze verschillende vachteiwitten, te beginnen met de rekrutering van ARF1 (ARF staat voor ADP ribosyleringsfactor, wat hier niets met zijn functie te maken heeft) aan het membraan. Dit vereist de Arno-gefaciliteerde uitwisseling van een GTP tegen BBP (ARNO is ARF nucleotidebindingsplaatopener). Zodra ARF1 GTP heeft gebonden, onthult de conformational verandering een n-eind myristoylgroep die in het membraan toevoegt. Zowel COPI als clathrin-met een laag bedekte blaasjes gebruiken ARF1 en ARNO, maar COPII gebruikt gelijkaardige proteã NEN genoemd Sar1p en Sec12p.
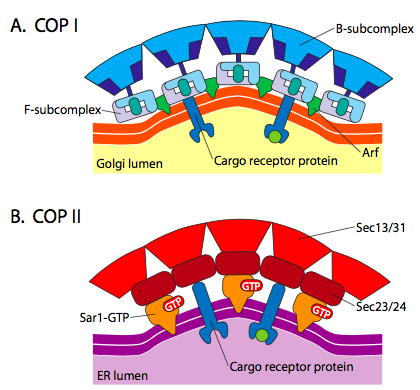
figuur \(\Paginindex{18}\). COP-met een laag bedekte blaasjes
ARF1 (of Sar1p) wordt gebruikt om adapterproteã nen aan te werven die aan het “staarteinde” van membraangebonden receptorproteã nen binden. Het bedrijfseinde van deze receptoren bindt aan car-go molecules die in het blaasje moeten worden verpakt. De adapterproteã nen fungeren als verbinding tussen het membraan (door de receptoren) en de vachtproteã nen. Voor clathrin zijn de adapterproteã nen AP1 voor trans-Golgi-afgeleide blaasjes en AP2 voor endocytische blaasjes. Voor copi blaasjes zijn de homologen bij benadering De β -, γ -, δ-En ζ – COPs, terwijl het COPII-systeem Sec23p en Sec24p gebruikt.
tenslotte koppelen de adapters aan de eigenlijke coateiwitten: clathrin, α-Of ε-COP, Sec13p en Sec31p. wat deze eiwitten allemaal gemeen hebben is dat spontaan (d.w.z. zonder enige eis voor energieverbruik), ze zelf-assembleren in kooi-achtige sferische structuren. Onder de elektronenmicroscoop, zijn de met clathrin-bedekte blaasjes scherper gedefinieerd en de hexagonale en vijfhoekige vormen die door de clathrin-subeenheden worden begrensd geven het blaasje een “voetbal” blik. Cop coatamer-gecoate blaasjes zijn veel wazig in uiterlijk onder EM.
alle drie de typen proteïnen van de vesikellaag hebben het vermogen om spontaan te associëren met een sferische constructie, maar alleen het met COPI en COPII beklede blaasje “knijpt” het membraan spontaan af om het blaasje uit het oorspronkelijke membraan te bevrijden. Blaasjes met clathrincoating hebben een extern mechanisme nodig om de blaasjes los te laten (figuur \(\Paginindex{19}\)).
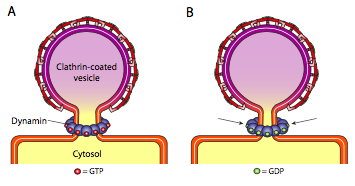
wanneer het blaasje bijna klaar is, is er nog steeds een kleine steel of hals van het membraan die het blaasje met het membraan verbindt. Rond deze stengel komen dynamische GTP-moleculen samen in een ring/spiraalconstructie. Dynamin molecules zijn bolvormige GTPases die op hydrolyse van GTP contracteren. Wanneer zij rond de blaassteel associëren, trekt elk dynaminproteã ne samen, met het gecombineerde effect van het vernauwen van de stengel genoeg dat het membraan samenknelt, afdichtend en bevrijdend het blaasje van het oorspronkelijk membraan.
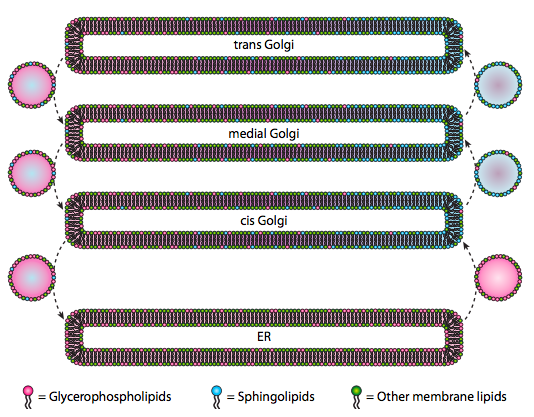
hoewel lipiden en membranen werden besproken in hoofdstuk 4, hebben we nagelaten om de locatie van hun syntheses in eukaryoten te bespreken. Zoals figuur \(\Pagindex{20}\) aangeeft, is de synthese van bepaalde lipiden gescheiden en Exclusief. Glycerofosfolipiden worden voornamelijk gevormd in het endoplasmatisch reticulum, hoewel ze ook worden gemaakt in mitochondriën en peroxisomen. In tegenstelling, sphingolipiden worden niet gemaakt in de ER (hoewel hun ceramide voorlopers zijn) in zoogdieren, de noodzakelijke enzymen worden gevonden in het lumen van de cis en mediale Golgi. Er zijn aanwijzingen voor anterograde en retrograde vesiculair verkeer tussen de verschillende Golgi-en ER-compartimenten, wat theoretisch zou wijzen op een herverdeling van lipidentypes. Nochtans, neigen de sphingolipids om in lipidevlotten samen te voegen en schijnen om meer geconcentreerd in anterograde-bewegende blaasjes te zijn.
de vachteiwitten komen kort na vesiculaire afgifte vrij. Voor clathrin omvat het proces Hsc70, een ATPase. Nochtans, voor met een laag bedekte blaasjes van COPI of COPII, schijnt de hydrolyse van GTP op ARF/Sar1p de affiniteit van de laageiwit voor de adapters te verzwakken en initieert uncoating. De GTPase activator is ARF GAP (of Sec23p) en is een integraal onderdeel van de COP I (of II) coat.
de blaasjes bevatten twee categorieën lading: oplosbare eiwitten en transmembraaneiwitten. Van de oplosbare proteã nen, worden sommige opgenomen in het blaasje op grond van wordt gebonden aan een receptor. Andere proteã nen toevallig om in de nabijheid te zijn en worden omhoog geschept aangezien de blaasjes vormen. Af en toe, wordt een proteã ne opgenomen die niet verondersteld was te zijn; bijvoorbeeld, kan PDI in een blaasje worden ingesloten die zich van ER vormen. Het heeft weinig functie in de Golgi, en is nodig in de eerste hulp, dus wat gebeurt er met het? Gelukkig hebben PDI en vele andere ER-eiwitten een C-terminale signaalsequentie, KDEL (lysine-asparaginezuur-glutaminezuur-Leucine), die schreeuwt: “Ik hoor thuis in de ER.”Deze sequentie wordt herkend door kdel-receptoren in de Golgi, en de binding van de kdel-eiwitten aan de receptoren triggert de vorming van blaasjes om ze terug te sturen naar de ER.
secretoire blaasjes hebben een bijzonder probleem met oplosbare lading. Als het blaasje eenvoudig op het omsluiten van proteã NEN binnen het tijdens het vormingsproces moest steunen, zou het moeilijk zijn om hoge concentraties van die proteã nen te krijgen. Veel afgescheiden proteã nen zijn door het organisme snel en in significante hoeveelheden nodig, zodat is er een mechanisme in trans Golgi voor het aggregeren van secretoire proteã nen. Het mechanisme gebruikt het samenvoegen van proteã nen zoals secretogranin II en chromogranin B die de doelproteã nen in grote geconcentreerde korrels samenbrengen. Deze graninen werken het beste in het trans Golgi milieu van lage pH en hoge Ca2+, dus wanneer het blaasje zijn inhoud buiten de cel vrijgeeft, breekt de hogere pH en lagere Ca2 + de aggregaten uit elkaar om de individuele proteã nen vrij te geven.
er is een consistente pH-verandering tijdens de rijping van de Golgi, zodat wanneer we van ER naar Golgi gaan, elk compartiment een progressief lagere (meer zure) lumenale pH heeft.
ten slotte is er de kwestie van het richten van de blaasjes. De blaasjes zijn veel minder nuttig als ze op een moleculaire goederentrein worden gegooid en willekeurig worden afgezet. Daarom is er een het dokken mechanisme dat een aanpassing van de V-SNARE proteã ne op de cytoplasmic oppervlakte van het blaasje en de T-SNARE op de cytoplasmic oppervlakte van het doelmembraan vereist. De fusie van het blaasje met het membraan verloopt alleen als er een overeenkomst is. Anders kan het blaasje niet smelten en zal het zich hechten aan een andere moleculaire motor om naar een andere, hopelijk correcte, bestemming te gaan. Dit proces wordt geholpen door vastbinden proteã nen die aanvankelijk contact met een inkomend blaasje maken en het dichtbij genoeg aan het doel trekken om voor SNARE eiwitinteractie te testen. Andere proteã nen op het blaasje en doelmembranen dan interageren en als de strikken overeenkomen, kan helpen aan “Lier” het blaasje in het doelmembraan, waarna de membranen smelten. Een belangrijke vuistregel aan het begrijpen van vesiculaire fusie en ook de richting van membraanproteã nen en lipiden, is dat de cytoplasmic-onderkende kant van een membraan altijd zal worden geconfronteerd met het cytoplasma. Daarom zal een proteã ne die uiteindelijk op de buitenoppervlakte van het celmembraan wordt gevonden in de lumenale oppervlakte van het membraan van ER om te beginnen zijn ingebracht.
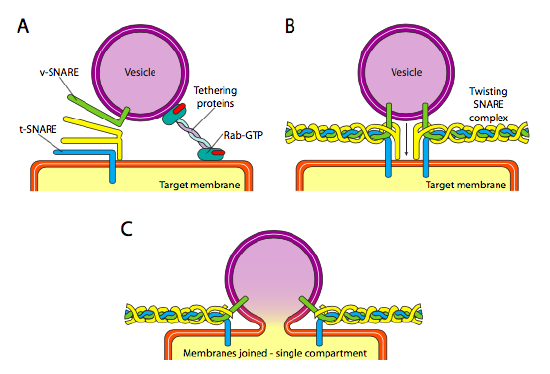
meer in het bijzonder, wanneer een blaasje het doelmembraan nadert, associeert het bindeiwit Rab-GTP, dat via een dubbele lipidenstaart van geranylgeranyl met het doelmembraan is verbonden, losjes met het blaasje en houdt het in de buurt van het doelmembraan om de strikken de kans te geven te werken. De v-SNAREs en t-SNAREs hebben nu de mogelijkheid om te communiceren en te testen voor een wedstrijd. Onlangs zijn de strikken hernoemd naar respectievelijk R-strikken en Q-strikken, gebaseerd op geconserveerde arginine-en glutamineresiduen. Naast deze twee primaire strikken is er ten minste één andere strik betrokken, die samen een bundel van vier α-helices vormen (Vier, niet drie, omdat tenminste in het best bestudeerde voorbeeld een van de strikken zo is gebogen dat twee van zijn alfa-spiraalvormige domeinen deelnemen aan de interactie. De vier helices wikkelen rond elkaar en men denkt dat aangezien zij dit doen, zij het blaasje en het doelmembraan samen trekken.
het tetanustoxine, tetanospasmin, dat vrijkomt door de Clostridium tetani-bacterie, veroorzaakt spasmen door inwerking op zenuwcellen en voorkomt de afgifte van neurotransmitters. Het mechanisme hiervoor is dat het synaptobrevin, een SNARE-eiwit, splijt, zodat de synaptische blaasjes niet kunnen fuseren met het celmembraan. Botulinum toxine, van Clostridium botulinum, werkt ook op strikken om vesikel fusie en de afgifte van neurotransmitters te voorkomen, hoewel het zich richt op verschillende neuronen en dus het tegenovergestelde effect heeft: tetanus wordt veroorzaakt door het voorkomen van de afgifte van remmende neurotransmitters, terwijl botulisme wordt veroorzaakt door het voorkomen van afgifte van prikkelende neurotransmitters.