Cell adhesion
Cell adhesion is het proces waarbij cellen interageren met specifieke moleculen op het celoppervlak en zich hechten aan aangrenzende cellen. Dit proces kan door directe of indirecte interactie tussen celoppervlakken voorkomen, waar de cellen aan de omringende extracellulaire matrijs hechten, die de molecules bevat die door de cellen in de ruimte tussen de cellen worden vrijgegeven. De celadhesie komt voor wanneer de molecuul van de celadhesie (CAM) met een transmembraanproteã ne in wisselwerking staat die op de celoppervlakte wordt gevestigd. De celadhesie verbindt cellen op verschillende manieren en kan aan signaaltransductie deelnemen om cellen toe te staan om veranderingen in het omringende milieu te ontdekken en te antwoorden. Andere cellulaire processen die door celadhesie worden geregeld omvatten celmigratie en weefselontwikkeling in multicellular organismen. De veranderingen in celadhesie kunnen belangrijke cellulaire processen verstoren en tot een verscheidenheid van ziekten, met inbegrip van kanker en artritis leiden. Celadhesie is ook essentieel voor ziekten veroorzaakt door besmettelijke organismen zoals bacteriën of virussen.
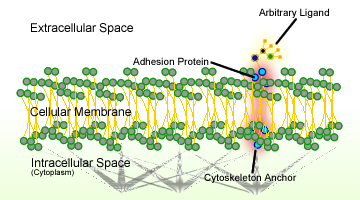 figuur 1. Schema van celadhesie
figuur 1. Schema van celadhesie
classificaties
nokken zijn verdeeld in vier hoofdfamilies: integrines, immunoglobuline (IG) superfamily, cadherine en selectines. Elk van deze adhesiemolecules heeft een verschillende functie en erkent een verschillend ligand. Cadherins en immunoglobulins zijn homotypic Nokken omdat zij direct aan hetzelfde type van nokken op een andere cel binden, terwijl integrins en selectins heterologe nokken zijn die aan verschillende soorten Nokken binden. Defecten in celadhesie worden vaak toegeschreven aan defecten in Nokkenuitdrukking. In meercellige organismen, veroorzaakt het binden tussen Nokken cellen om aan elkaar te hechten en een structuur genoemd een celverbinding te vormen.
afhankelijk van hun functies kunnen de celverbindingen worden geclassificeerd als:
Verankeringsverbindingen (adherens-verbindingen, desmosomen en hemidesmosomen), die cellen langs elkaar houden en het contact tussen cellen versterken.
afsluitende kruispunten (“tight junctions”), die door cel–celcontact de gaten tussen cellen dichten, waardoor een waterbestendige barrière voor diffusie ontstaat.
Kanaalvormende juncties (gap junctions), die protoplasma van aangrenzende cellen met elkaar verbindt waardoor moleculen tussen cellen kunnen worden getransporteerd.
signaal-heruitlegverbindingen, die synapsen kunnen zijn binnen het systeem.
als alternatief kunnen cel juncties worden ingedeeld in twee hoofdvarianten in overeenstemming met wat er met de cel interageert: cel–cel juncties, in het belangrijkste mediaat door cadherines, en cel–matrix juncties, in het belangrijkste mediaat door integrines.
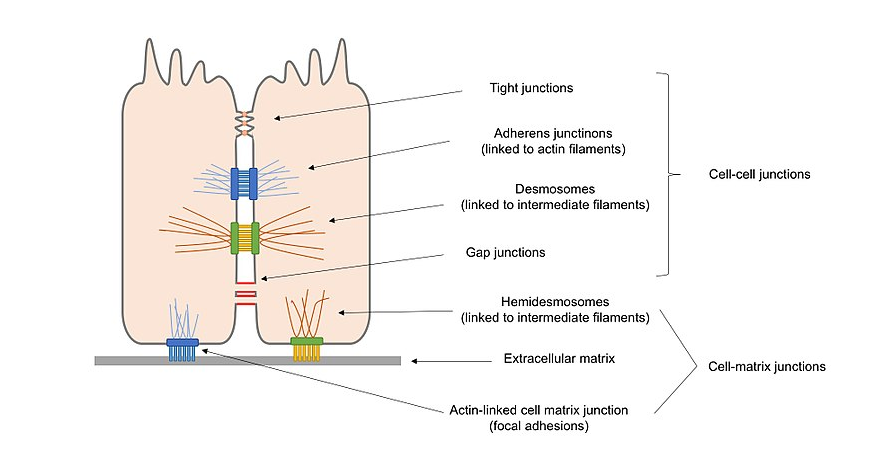 Figuur 2. Overzichtsdiagram van verschillende types van celverbindingen huidig in epitheliale cellen, met inbegrip van cel-celverbindingen en cel-matrixverbindingen.
Figuur 2. Overzichtsdiagram van verschillende types van celverbindingen huidig in epitheliale cellen, met inbegrip van cel-celverbindingen en cel-matrixverbindingen.
structurele kenmerken van Celadhesieproteïnen
celadhesieproteïnen zijn gewoonlijk glycoproteïnen die cel-cel en cel extracellulaire matrixherkenning aan het extracellulaire oppervlak mediteren. De meeste molecules van de celadhesie hebben gelijkaardige conformations in hun zelfklevende domeinen. Bijvoorbeeld: de zelfklevende domeinen van cadherin, Immunoglobulin zoals, fibronectin type III en EGF zijn hoofdzakelijk β-bladstructuren. Het gemeenschappelijke motief betrokken bij celhechting is de Griekse belangrijkste vatstructuur met een of twee anti-parallel β sandwiches.
IG-achtige domeinen zijn een belangrijke klasse van Griekse key barrel domeinen. Zij hebben opeenvolgings gelijkenissen met het variabele of constante domein van antilichamen die zeven tot negen anti-parallelle β bundels bevatten. De anti-parallelle p-platen vormen een 3-D β-vat. Ig – achtige domeinen worden gestabiliseerd door hydrophobic kern en disulfide banden. Ze zijn verdeeld in twee grote verzamelingen: IG C-achtige en Ig V-achtige domeinen.
functioneel gerelateerde structurele kenmerken van Celadhesieproteïnen
Celadhesieproteïnen hebben een functionele diversiteit. De interactie van de molecules van de celadhesie zou homophilic of heterophilic eiwit-eiwitinteractie of eiwit-koolhydraatinteractie kunnen zijn. De structurele veranderingen van de molecules van de celadhesie zijn vaak gerelateerd aan hun functionele eigenschappen.
Homofiele Eiwit-Eiwitinteracties. Cadherinen zijn bijvoorbeeld transmembrane Ca2 + – afhankelijke homofiele adhesiemoleculen. Cadherins zijn verantwoordelijk voor het onderhoud van de verbindingen tussen soortgelijke cellen in weefsels. Cel-cel adhesie wordt bemiddeld door het n-einddomein van cadherins. Het bevat vijf gelijkaardige extracellulaire domeinen EC1 aan EC5. De kristallografische studies van de Röntgenstraal in n-cadherin toonden aan dat EC1 domein een dimeer vormt, waarin de monomeren parallel met hun zelfklevende bandoppervlakte worden georiënteerd die van het plasmamembraan naar buiten wijzen. De monomeereenheden van EC1 domeinen interageren met elkaar op een antiparallel manier, gebruikend hun klevende bindende oppervlakken en die een β-vatstructuur vormen. Een veronderstelde interface van de interactie werd voorgesteld om zowel hydrophobic als polair/geladen karakter te hebben dat de interface van de interactie van immunoglobulin domeinen met elkaar in de superfamilie IG nabootst.
Heterofiele Eiwit-Eiwitinteracties.
de binding van de integrinen aan verschillende receptoren op het celoppervlak en extracellulaire matrixliganden is bijvoorbeeld een belangrijke klasse van heterofiele eiwit-eiwitinteractie in celadhesiesystemen. Na binding aan oplosbaar fibrinogeen, wordt integrine aIIbß3 omgezet in een hoge affiniteit bindingstoestand. De conformationele veranderingen van het integrine die door ligandband in dit geval worden veroorzaakt zijn kritiek voor zijn kleefactiviteit. De Binding van een T-celreceptor kan ook de bindingsaffiniteit van het integrine, leukocytenfunctie geassocieerd antigeen – 1 (LFA-1) moduleren, aan zijn receptoren zoals ICAM-L of ICAM-2 (intercellulair celadhesiemolecuul). De band van ICAM-l kan conformational veranderingen van LFA – 1 Verder veroorzaken. De hechtende bindingsplaats van het eiwit bevindt zich in de C-terminal van LFA-l op basis van röntgenkristallografische studie.Een tripeptide, arginine-glycine-asparaginezuur (RGD), is een gemeenschappelijk integrine ligand bindend motief. Bijvoorbeeld, heeft de integrin bindende ligand type III module van fibronectin een Griekse zeer belangrijke vatstructuur, waarvan het RGD-motief, bij de apex van de lijn die de bundels F en G B verbinden, adhesie bemiddelt. Het rechttrekken van de RGD-lus naar een meer lineaire fluctuerende conformatie door zich te ontvouwen vermindert de toegankelijkheid van de lus naar de oppervlaktegebonden integrines, en vermindert daarom de affiniteit en selectiviteit van binding.
Interacties Tussen Eiwit En Koolhydraten.
de selectinen zijn belangrijk voor de interactie tussen lymfocyten en neutrofielen met vasculair endotheel. Selectins zijn adhesiemolecules die aan koolhydraten binden. Er zijn nog geen directe structurele gegevens over de binding van selectinen aan koolhydraten. De selectins binden koolhydraten met lage affiniteit en hebben zeer snelle aan en uit tarieven.