Inleiding
weefsels, cellen en de kleinere structuren in cellen (organellen) zijn meestal water en zijn daarom transparant. Beeldvorming kleine doorzichtige zakken water resulteert in beelden die niet veel informatie bevatten, en in de microscopie, is het essentieel om een soort van contrast of vlek te hebben die gebieden van de steekproefkleur geeft en ze veel gemakkelijker te zien maakt. Bovendien, wat als je alleen een aantal van de kleinere structuren in een cel wilt afbeelden, zoals een kern of een celmembraan? Het kleuren van de hele cel zou het onmogelijk maken om de gebieden te lokaliseren waarin u geïnteresseerd bent.
fluorescentie Lost beide problemen van contrast en lokalisatie op. Fluorescentie is waar een object licht zal uitzenden na het absorberen van licht. Veel verschillende voorwerpen vertonen fluorescentie, zoals mineralen (het woord fluorescentie afkomstig van het mineraal fluoriet), diepzeevissen (het beroemdst de kwal aequorea victoria, waarvan de groene fluorescente proteã ne (GFP) werd ontdekt), installaties, chemische producten en nog veel meer.
de Fluorescente molecules (als fluorophores wordt bekend) worden gebruikt om steekproeven te etiketteren, en fluorophores zijn beschikbaar die licht in vrijwel om het even welke kleur uitzenden. In een fluorescente microscoop, wordt een steekproef geëtiketteerd met fluorophore, en dan wordt een helder licht (opwindingslicht) gebruikt om de steekproef te verlichten, die fluorescentie (emissielicht) afgeeft. Op deze manier, worden de steekproeven hoogst vergeleken met de zwarte achtergrond aangezien fluorophore een helder-gekleurd licht uitzendt. Door deze fluorophores aan het gebied van belang te lokaliseren kan een duidelijk beeld van om het even welk deel van een cel worden genomen, makend de fluorescentiemicroscopie een krachtig hulpmiddel voor het levenswetenschappen.
Brightfield vs Fluorescentiebeeldvorming
In de brightfield-microscopie wordt het monster verlicht met doorgegeven wit licht. Dit leidt tot een gelijkmatige verlichting van de steekproef onder de microscoop om hoogst gecontrasteerde, bevlekte of natuurlijk gepigmenteerde steekproeven waar te nemen. Brightfield is echter niet voldoende om onderscheid te maken tussen transparante/doorschijnende, Onbevlekte cellen of cellulaire structuren om processen van belang te bestuderen.
de fluorescentiemicroscopie baseert zich op het gebruik van fluorophores, molecules die licht van een specifieke zichtbare golflengte uitzenden wanneer blootgesteld aan licht van een verschillende golflengte. Wanneer deze fluorophores aan een gerichte die structuur van belang worden gebonden, kunnen de fotonen van fluorophore worden uitgezonden om deze structuur van belang te visualiseren. Het voordeel van de fluorescentiemicroscopie is dat de gerichte structuren worden verlicht terwijl de ongewenste gebieden van de steekproef weinig aan geen fluorescentie hebben, die voor het gemakkelijke richten en weergave toestaan.
waarom moleculen fluoresceren
de oorsprong van fluorescentie is elektronen die vrij rond de actieve fluorofoor bewegen en geabsorbeerde energie vrijgeven, zoals gezien in Fig.2.
vóór de excitatie bevinden elektronen zich in de laagst beschikbare energietoestand – de grondtoestand (S0). Wanneer een elektron wordt geraakt met een foton van een bepaald energiebereik, absorbeert het elektron de energie van het foton en springt naar een hogere energietoestand (S1, S2, of S3). Om terug te keren naar de grondtoestand (S0) geeft het elektron de extra energie af als de emissie van een foton. De energie van dit foton is minder dan de opwindingsenergie dus het heeft een langere golflengte. Dit is waarom het emissielicht een langere golflengte heeft dan het opwindingslicht en als verschillende kleur kan verschijnen.
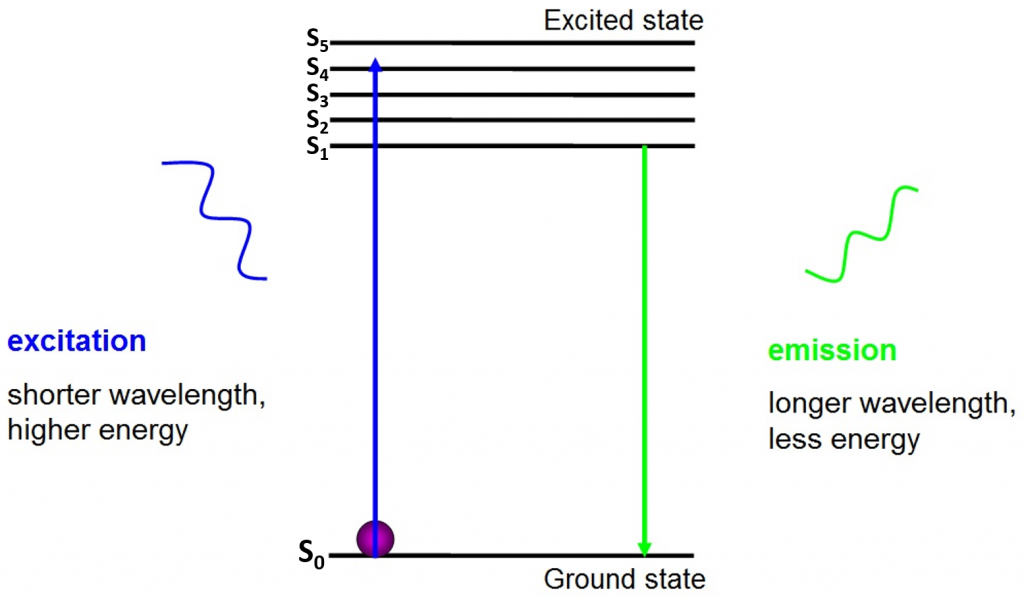
het uitgezonden foton is gewoonlijk in het zichtbare spectrum en kan onder een microscoop worden bekeken als er genoeg opgewekte fluorophores zijn. De golflengte van het vrijgegeven foton is specifiek voor elke fluorophore en deze voorspelbaarheid staat voor gemakkelijke fluorescentieweergave toe.
fluorescentie Intensiteitsfactoren
terwijl fluoroforen fluorescentie van een voorspelbare golflengte kunnen uitzenden, is het ook belangrijk om te weten welke factoren de fluorescentieintensiteit controleren. Zonder een intens genoeg emissie van licht, zal de fluorescentie niet detecteerbaar zijn met een microscoop.
Kwantumopbrengst
de kwantumopbrengst (ϕ) van een fluorofoor is de verhouding tussen het aantal vrijgegeven fotonen en het aantal geabsorbeerde fotonen. De kwantumopbrengst wordt vaak uitgedrukt als een waarde van 0-1, waarvan 1 100% efficiëntie van fotonomzetting is. Het is ook belangrijk om op te merken dat elke fluorophore een unieke pH, Ionische sterkte, en temperatuur voor optimale fluorescentieefficiëntie heeft.
Extinctiecoëfficiënt
elke fluorophoor heeft een verschillende capaciteit om fotonen te absorberen, zelfs als zij binnen een aangewezen golflengtewaaier zijn om het op te wekken. Als fluorophore aan een foton wordt blootgesteld die zijn opwindingsgolflengte passend aanpassen, is de waarschijnlijkheid dat een foton zal worden geabsorbeerd een meetbaar kenmerk en als de vernietigingscoëfficiënt (ε) wordt bekend.
de kwantumopbrengst en de extinctiecoëfficiënt van een fluorophore worden vaak getoond samen om te beschrijven hoe helder fluorophore wordt getoond om in experimentele montages te zijn.
Fluorescentielevensduur
wanneer een fluorofoor elektron een foton absorbeert, geeft het niet onmiddellijk een foton met een langere golflengte vrij. Het vrijgeven van enige energie tussen opgewekte energietoestanden is bekend om verschillende lengtes van de tijd te nemen. De hoeveelheid tijd die een elektron in de opgewekte staat doorbrengt alvorens een foton vrij te geven en aan de grondstaat terug te keren is een meting van zijn fluorescentieleven. Het leven van elke fluorophore is uniek en kan experimenteel worden gemeten. Wanneer het gebruiken van fluorescente kleurstoffen experimenteel, is het nuttig aan hun leven, vooral voor toepassingen die hoge snelheid, zoals de neuronen van de calciumweergave vereisen.
excitatie Golflengteintensiteit
de meeste fluorescentiemicroscopieopstellingen bevatten een lichtbron die kan worden afgestemd op het gewenste golflengtebereik. Vele fluorescente lichtbronnen kunnen ook voor opwindingsintensiteit worden aangepast om het aantal fotonen te verhogen die zich door de lichte weg bewegen. In een fluorescently-geëtiketteerde steekproef die aan zijn opwindingsgolflengte wordt blootgesteld, zal elke fluorophore niet tegelijkertijd worden geactiveerd. Door de opwindingsintensiteit te verhogen en het aantal fotonen te verhogen die de steekproef bereiken, is er een hogere waarschijnlijkheid dat meer fluorophores zullen worden opgewekt.
Fotostabiliteit
Fotostabiliteit is het vermogen van een molecuul of organisme om schade te weerstaan. In de fluorescentiemicroscopie, zullen fluorophores uiteindelijk ophouden absorberende tegemoetkomende fotonen en in een permanente donkere staat gaan. Aangezien een organisme meer fluorophores in de donkere staat verzamelt, vermindert de verschijning van het geëtiketteerde doel, en de steekproef wordt gezegd om photobleaching te zijn. In de fluorescentiemicroscopie, worden de stappen vaak genomen om de hoeveelheid photobleaching te verminderen die tijdens het experimenteren wordt ervaren. Sommige maatregelen omvatten een vermindering van de intensiteit van licht die met de steekproef in wisselwerking staan en het gebruik van gespecialiseerde fluorescente kleurstoffen die niet zolang actief blijven als andere kleurstoffen.
fluorescentiemicroscopie
voor onderzoekers is het belangrijkste voordeel van fluorescentie de mogelijkheid om fluorescentiemicroscopie te gebruiken, waarbij monsters worden geëtiketteerd/gekleurd met een fluorescerende stof zoals een kleurstof, antilichaam of eiwit, waardoor beelden contrast kunnen vertonen. Door zich te richten op deze fluorescente etiketten, kunnen onderzoekers selecteren wat ze willen zien. Dit wordt aangetoond in Fig.3, waar een neuron duidelijk onder astrocyten kan worden gezien, aangezien zij met verschillende kleuren van fluorescente teller worden geëtiketteerd.
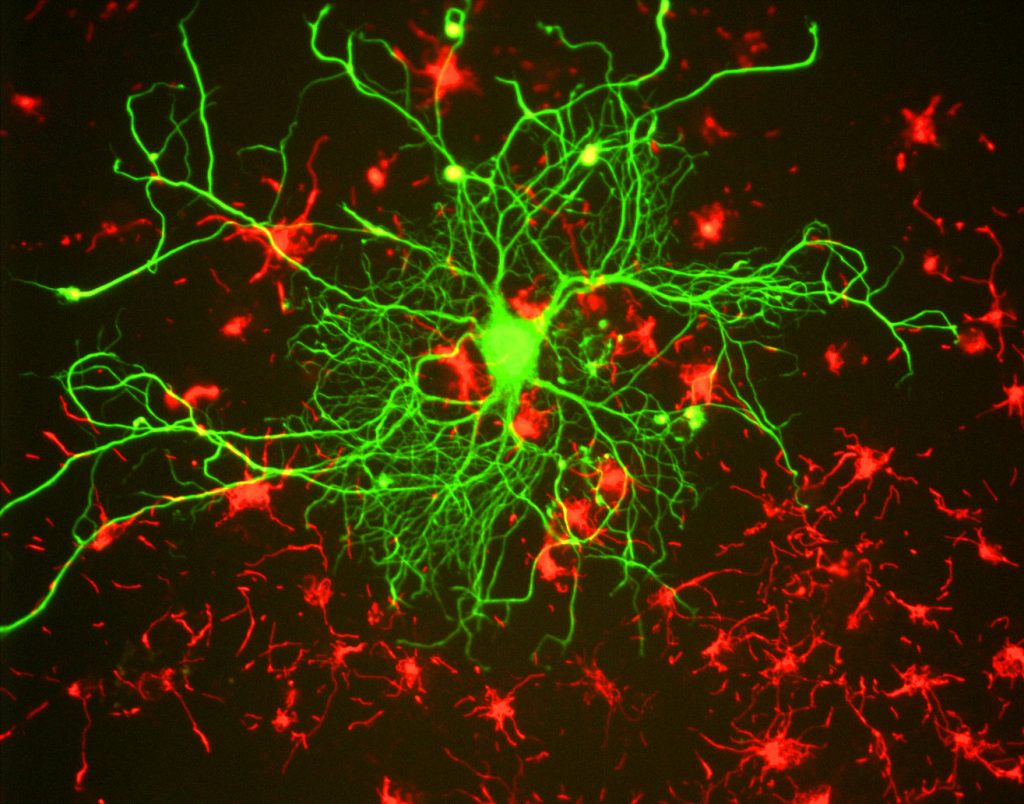
In het algemeen, voor de fluorescentiemicroscopie, wordt een steekproef geëtiketteerd met fluorescente tellers (typisch specifiek voor bepaalde delen van de steekproef). De steekproef wordt dan verlicht met de specifieke opwindingsgolflengte voor fluorophore, en de resulterende emissiefluorescentie wordt ontvangen door de detector, gewoonlijk een gevoelige wetenschappelijke camera.
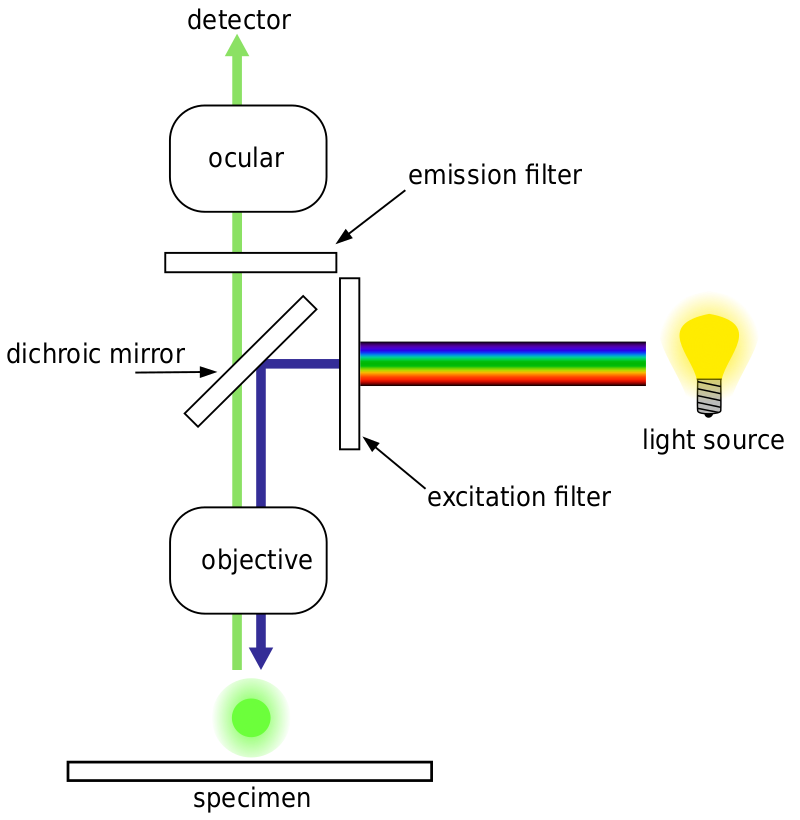
de meeste fluorescentiemicroscopen zijn epifluorescentiemicroscopen, waarbij excitatie en emissie via dezelfde lichtweg plaatsvinden. Zowel de opwindingsverlichting als de uitgezonden fluorescentie gaan door de microscoopdoelstelling en worden gewoonlijk gefilterd om enkel de fluorescentie te ontdekken. Deze instelling wordt weergegeven in Fig.4.
Autofluorescentie
sommige structuren, biologische organismen en algemene microscopiemonsters kunnen van nature fluorescentie vertonen, bekend als autofluorescentie. Dit is verschillend van fluorescentie van geëtiketteerde steekproeven, maar het deelt vaak gelijkaardige golflengten, betekenend dat de steekproeven van de autofluorescentiemicroscopie kunstmatig toegevoegde fluorescentie kunnen verduisteren en in Opsporing mengen, die signaal verminderen. Het is belangrijk om te weten als uw steekproeven autofluorescentie tentoonstellen, aangezien dit om het even welke fluorescentieweergave zal beà nvloeden gedaan tenzij specifieke golflengten worden gebruikt om het te vermijden.
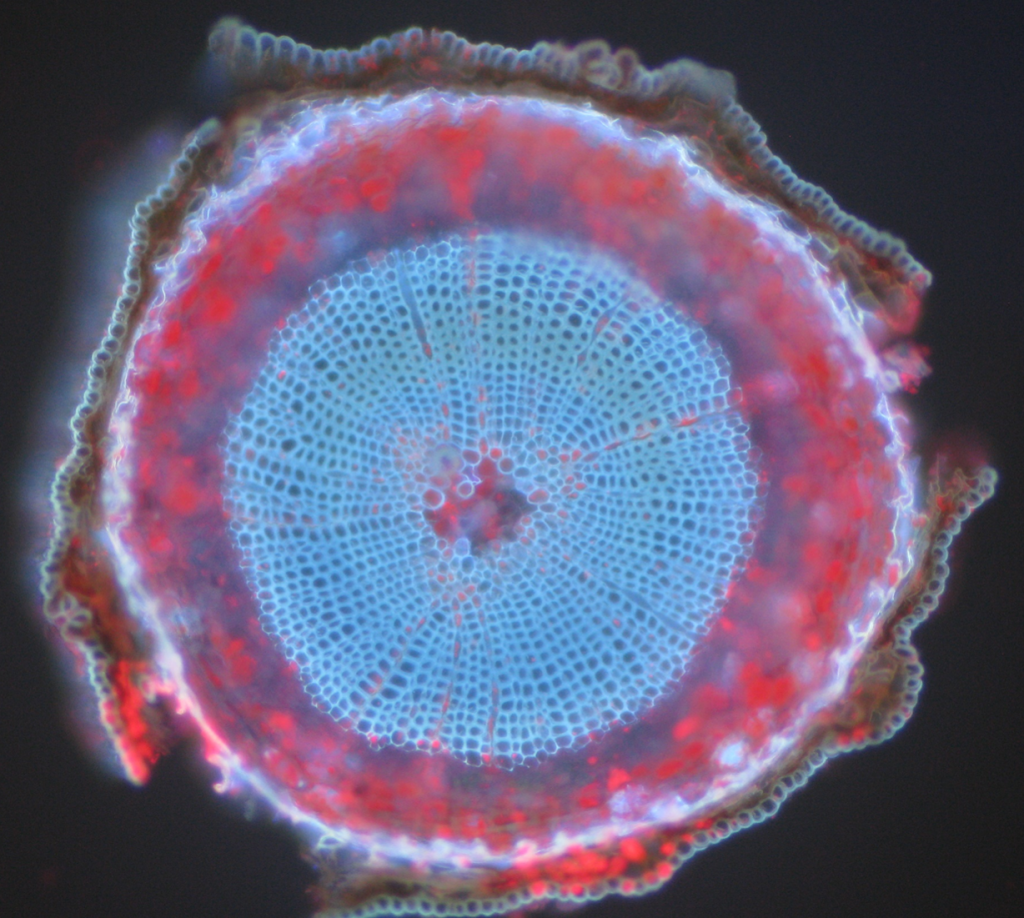
veelvoorkomende voorbeelden van autofluorescerende objecten zijn mitochondriën, lysosomen, collageen en sommige aminozuren zoals tryptofaan, tyrosine en fenylalanine. Autofluorescentie komt veel voor in planten vanwege het gebruik van chlorofyl en andere fluorescerende moleculen zoals ligninen en carotenen. Fig.5 toont de verschillende kleuren van autofluorescentie van een Ongelabeld Grenenmonster.
samenvatting
sinds de introductie van de eerste fluorescerende kleurstof is de fluorescentiemicroscopie al gebruikt om cellen en cellulaire structuren met een hogere specificiteit te visualiseren dan traditionele brightfield-microscopietechnieken. Onderzoekers kunnen de structuur, optische eigenschappen en probe van belang beïnvloeden experimenten om relevante gegevens te verkrijgen. Dergelijke flexibiliteit heeft de fluorescentiemicroscopie toegestaan om in vele experimenten van de het levenswetenschap te worden opgenomen.
afhankelijk van het type monster en fluorofoor, moet een wetenschappelijke camera zorgvuldig worden geselecteerd om de beste beeldvormingsresultaten te bereiken.
- Lichtmicroscopie. (2009) Natuur Mijlpalen. MacMillan Publishers Limited, 6-22.
- Lavis, L. D., & Raines, R. T. (2008). Heldere ideeën voor Chemische Biologie. ACS Chemical Biology, 3 (3): 142-155.
- Liu, Y., Lilly, D. (2017) Crystal Structures if Cyanine Fluorophores Stacks on the End of Double-Stranded RNA. Biophysical Journal, 113, (11): 2236-2343.
- Berezin, M. Y., Achilefu, S. (2010). Metingen van de fluorescentielevensduur en biologische beeldvorming. Chemical Reviews, 110 (5): 2641-2684. Stockert, J., Blazquez-Castro, A. (2017) Fluorescence Microscopy in Life Sciences. Sharjah, Verenigde Arabische Emiraten. Bentham Science Publishers.
- Berezin, M. Y., & Achilefu, S. (2010). Metingen van de fluorescentielevensduur en biologische beeldvorming. Chemical Reviews, 110 (5): 2641-2684. Denk, W., Strickler, J., Webb, W. (1990). Twee-Foton Laser Scanning Fluorescentie Microscopie. Wetenschap. 248, (1951): 73-76.
- So, P. (2002). Twee-foton fluorescentie lichtmicroscopie. Macmillan Publishing Group.
- Schermelleh, L., Heinztmann, R., and Leonardt, H. (2010). Een gids voor de microscopie van de Super-resolutie fluorescentie. The Journal of Cell Biology 190 (2): 165-175.
- Betzig, E., Patterson, G. H., Sougrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., Davidson, M. W., LippincottSchwartz, J., Hess, H. F. (2006) Imaging intracellular fluorescent proteins at nanometer resolution. Wetenschap. 313(5793): 1642-5
- Rust, M. J., Bates, M. & Zhuang, X. (2006) sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methoden. 2, (10):793-5.Rego, E., Shao, L., Macklin, J. Winoto, L., Johansson, G., Kamps-Hughes, N., Davidson, M., and Gustasson, M. (2010) PNAS. 109 (3): e135-a143. Jungmann, R., Avendaño, M. S., Woehrstein, J. B., Dai, M., Shih, W. M. & Yin, P. (2014) Multiplexed 3D cellular super-resolution imaging with DNA-PAINT and Exchange-PAINT. Nat Methoden. 11(3): 313-318
- Jiang, X., Wang, L., Carroll, S., Chen, J., Wang, M., en Wang, J. (2018) Challenges and Opportunities for Small Molecule Fluorescent Probes in Redox Biology Applications. Antioxidants & Redox Signaling. Mary Ann Liebert, Inc.