Introduction
de enzymatische werking van type 5 fosfodiësterase (PDE5) is het primaire mechanisme voor inactivatie van cGMP, de downstream mediator van het vasodilaterende middel stikstofmonoxide (NO) (Lugnier, 2006).
tijdens een erectiestoornis kan de verminderde productie van NO uit de endotheliale caverneuze vaten farmacologisch worden overwonnen door het gebruik van PDE5-remmers (PDE5i), teneinde de cGMP-halfwaardetijd te verlengen en de resterende vasodilaterende functie te versterken (Hawksworth and Burnett, 2015). Verscheidene molecules met remmende activiteit op PDE5 zijn toen geprojecteerd en vrijgegeven op de markt, die verschillend begin en duur van effect tonen. Momenteel zijn PDE5i de eerste keuze geneesmiddelen die worden gebruikt voor de behandeling van ED (Mehrotra et al., 2007).
ondanks een erkende werkzaamheid bij bijna 80% van de niet-geselecteerde ED-patiënten (Eardley et al., 2010; Hatzimouratidis et al., 2010; Porst et al., 2013), is een opmerkelijke drop-out van de behandeling met PDE5i onlangs gemeld. In kwantitatieve termen is een gemiddeld stopzettingspercentage van 4% per maand gemeld, met een algehele stopzetting van de behandeling in 50% gevallen op jaarbasis (Carvalheira et al., 2012; Corona et al., 2016). Onder de belangrijkste redenen die door patiënten worden gegeven om het staken van de therapie te rechtvaardigen, worden het gebrek aan werkzaamheid en de bijwerkingen aangeduid als de meest voorkomende (Corona et al., 2016). Er kunnen twee soorten bijwerkingen worden onderscheiden: die strikt gerelateerd aan PDE5-remming, zoals hoofdpijn, blozen en dyspepsie, en die geassocieerd met resterende remmende activiteit van geneesmiddelen op andere PDE, zoals vasodilatatie en tachycardie (PDE1), visuele stoornissen (PDE6) en rugpijn (PDE11) (Bischoff, 2004; Gupta et al., 2005). Aangezien het optreden van bijwerkingen toeneemt met zowel serumspiegels als de tijd blootstelling aan het geneesmiddel (Gupta et al., 2005; Taylor et al., 2009), kan het veiligheid/werkzaamheidsprofiel van een geneesmiddel als alternatief worden verbeterd door middel van een farmacokinetische benadering door het ontwerp van een nieuwe geneesmiddelformulering (Mehrotra et al., 2007). Deze aanpak is met succes toegepast op PDE5i in het geval van Vardenafil. Inderdaad, dit molecuul lijdt aan een relatief lage biologische beschikbaarheid (∼15%, Center for Drug Evaluation and Research, 2003). In vergelijking met de Filmomhulde tablet (FCT), de oorspronkelijke formulering voor klassieke toediening per os, verhoogde de formulering van Oro-dispergeerbare tabletten (ODT) voor Vardenafil significant de biologische beschikbaarheid van geneesmiddelen door de sublinguale absorptie te bevorderen, een route waarvan wordt erkend dat deze minder wordt beïnvloed door first-pass metabolisme (Heinig et al., 2011).Sildenafil (Sild) was de eerste selectieve PDE5-remmer die werd goedgekeurd voor de behandeling van ED (Boolell et al., 1996). Het is een relatief lipofiel molecuul en na orale toediening wordt de piekplasmaconcentratie bereikt in een tijd variërend van 0,5 tot 2 uur. Sild vertoont een relatief lage orale biologische beschikbaarheid (38-41%), voornamelijk als gevolg van uitgebreid darm-en first-pass-metabolisme (Gupta et al., 2005). Ondanks de lange aanwezigheid op de markt, is de ontwikkeling van nieuwe formuleringen van geneesmiddel slecht voortgezet, tot de recente release op de Italiaanse markt van een nieuwe formulering: de Oro-dispergeerbare film (ODF). Inderdaad, ODF werd goedgekeurd als een bio-equivalente vorm van FCT (Leoni et al., 2013). Nochtans, kunnen mondeling desintegrerende formuleringen geschikte systemen vertegenwoordigen om trans-mucosal, en in het bijzonder sub-lingual, absorptie te bevoordelen (Kathpalia and Gupte, 2013).
in deze studie hebben we de farmacokinetiek van Sild geëvalueerd die geassocieerd is met sublinguale toediening van ODF of ODT, in vergelijking met de FCT als oorspronkelijke samenstelling per os. Hiertoe onderzochten we het release/permeatie profiel van de verschillende Sild formuleringen door in vitro systemen speciaal ontwikkeld om de Trans-mucosale absorptie van geneesmiddelen te evalueren. Verder hebben we de serumprofielen van de farmacokinetiek van Sild gekwantificeerd na toediening van per os FCT, en sublinguale ODT en ODF bij patiënten met ED.
materialen en methoden
chemische en Medicijnformuleringen
Hanks balance salts solution pH 7.4 (HBSS), hepes solution, benzanilide en Sild citraat werden allemaal gekocht bij Sigma–Aldrich (Milaan, Italië). Om verwarrende resultaten als gevolg van het gebruik van op de markt verkrijgbare alternatieve bio-equivalenten te voorkomen, werden de volgende producten gebruikt:: Viagra® FCT (Pfizer, Milaan, Italië), Viagra ORO® ODT (Pfizer) en Rabestrom® ODF (IBSA, Lodi, Italië). Geneesmiddelen werden voorgeschreven aan patiënten tijdens poliklinische evaluatie voor hun privégebruik. Voor in-vitro-tests en in-vivo-evaluatie van de farmacokinetiek (zie hieronder) werden geneesmiddelen specifiek aangeschaft door personeel dat bij de studie betrokken was bij lokale apotheekfaciliteiten en vervolgens onder optimale omstandigheden behandeld/bewaard.
Desaggregatietest
de in vitro desaggregatietests werden uitgevoerd volgens de Europese Farmacopee (2016) met behulp van de Desintegratietest voor Tablets (Sotax DT 2, aanvullend figuur S1A), met water als immersievloeistof bij 37 ± 0,5°C. Het tijdstip van de desaggregatie werd gecontroleerd bij volledige desintegratie van de doseringsvorm. Volledige desintegratie wordt gedefinieerd als de toestand waarin het restant van de eenheid dat op het scherm van de testapparatuur achterblijft of aan het onderste oppervlak van de schijven blijft hangen, een zachte massa is zonder een voelbaar stevige kern. De Tests werden in drievoud uitgevoerd en de resultaten werden gerapporteerd als gemiddelde ± standaardafwijking.
Oplossingstest
in vitro oplossingstests voor geneesmiddelen werden uitgevoerd volgens de Europese Farmacopee . De oplossingstests werden uitgevoerd met behulp van een peddelapparaat, peddelsnelheid 50 rpm en HBSS pH 7,4 werd gebruikt als oplossingsmedium (900 ml bij 37 ± 0,5°C).
tijdens de afgiftetests, 2 ml oplossingsmedium, bij 0, 2, 4, 6, 10, 20, 30, en 40 min, werd verwijderd en gefilterd door 0,45 µm cellulose esters filter en dus verdund. Vervolgens werd Sild-kwantificering uitgevoerd met behulp van hogedrukvloeistofchromatografie (HPLC)-UV. Het verwijderde volume werd telkens vervangen door vers medium. De Tests werden in drievoud uitgevoerd en de resultaten werden gerapporteerd als gemiddelde ± standaardafwijking. Gegevens werden genormaliseerd over het geneesmiddelgehalte van de formulering.
Trans-mucosale Permeatietest
Trans-mucosale permeatieprofiel van Sild werd in vitro geëvalueerd met behulp van een specifiek hulpmiddel volgens Delvadia et al. (2012) naar behoren gewijzigd. Kort, het apparaat bestond uit een verticaal diffusiesysteem gekenmerkt door donor–ontvanger kamers gescheiden door een wegwerp cellulose–acetaat membraan (porie 0,45 µm). De donorcel bevatte 1,5 ml HBSS, terwijl de ontvangstkamer deel uitmaakte van een gesloten recirculatiecircuit van 30 ml met inbegrip van de volumes slang en reservoir. De bemonstering werd uitgevoerd vanuit het reservoir van de opvangkamer met tussenpozen van 0, 5, 10, 20, 30, en 40 min en vervangen door een equivalent volume verse GB ‘ s. De monsters werden geanalyseerd door HPLC-UV voor drug inhoud (Fejős et al., 2014). De gegevens werden genormaliseerd over de hoogste doordrongen Sild-concentratie die werd waargenomen voor zuiver Sild-citraat. De Tests werden in drievoud uitgevoerd en de resultaten werden gerapporteerd als gemiddelde ± standaardafwijking.
farmacokinetisch onderzoek bij vrijwillige psychogene ED-patiënten
het onderzoek werd uitgevoerd in de eenheid Andrologie en Reproductieve Geneeskunde (Universitair Ziekenhuis van Padova, Italië), tussen mei en September 2017, volgens de Verklaring van Helsinki onder goedkeuring van de Ethische Commissie van het Universitair Ziekenhuis van Padova (protocol nr. 3982/AO/16 en opeenvolgende wijzigingen). Om verstorende resultaten te vermijden, werden proefpersonen met psychogene ED geïncludeerd omdat het lagere voorkomen van organische afwijkingen geassocieerd is met ED (Ludwig and Phillips, 2014).
de steekproefgrootte werd berekend om een effectgrootte te bereiken van ten minste 0,5 Met een statistisch vermogen van 0,8 en een significantieniveau van 0,05 voor een vergelijking met drie groepen (zie vermogenscalculator – eenrichtingsonafhankelijke ANOVA).
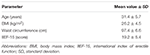
twintig patiënten (gemiddelde leeftijd 31,4 ± 5,7 jaar) werden achtereenvolgens geïncludeerd na vrijgave van de ondertekende geïnformeerde toestemming. De patiënten woonden poliklinische evaluatie bij die het consistente onvermogen rapporteerde om een erectie te verkrijgen en te behouden voor bevredigende geslachtsgemeenschap gedurende de voorafgaande 6 maanden of langer. Daaropvolgend werd bij alle patiënten een klinische evaluatie uitgevoerd om de afwezigheid vast te stellen van aan ED gerelateerde ziekten, zoals diabetes mellitus, hypertensie, neurologische aandoening en het gebruik van antidepressiva. Diagnose van psychogene ED werd bevestigd door het vervullen van een indexscore < 26 bij de toediening van de International Index of Erectile Function-15 (IIEF-15) vragenlijst (Lotti et al., 2016) en het onderhoud van nachtelijke spontane erecties, beoordeeld door nachtelijke penile Tumescentie en rigiditeit Monitoring via het RigiScan Plus Rigidity Assessment System (Dacomed, Verenigde Staten) gedurende twee opeenvolgende nachten zoals eerder beschreven (Munoz et al., 1993; Caretta et al., 2005). De uitsluitingscriteria waren de diagnose van maligniteiten, abnormale hormoonplasmaspiegels (respectievelijk luteïniserend hormoon >8 UI/l, totaal testosteron <10,4 nmol/l, thyrotropine >4,5 mUI/l, prolactine >20 ng/ml) en een verhoogde dikte van intima-media bij supra-aorta stammen (>0.9 mm) en/of caverneuze slagaders (>0,3 mm), beoordeeld met Color Doppler-Ultrasound zoals eerder beschreven (Caretta et al., 2005, 2009).
patiënten stemden ermee in zich te houden aan een open-label Drieweg cross-over onderzoek met enkelvoudige dosis. Het doseringsschema van het geneesmiddel is weergegeven in Figuur 1. De dosering van Sild werd gekozen als 50 mg, in overeenstemming met eerdere rapporten over de behandeling van psychogene ED (Banner and Anderson, 2007). Patiënten werd gevraagd om gedurende 1 week voorafgaand aan en tijdens de studie geen drugs of alcohol te gebruiken. Bovendien werd de patiënten tijdens de dag van toediening van het geneesmiddel gevraagd om ten minste 2 uur voor de test een vetvrij ontbijt (geen melk of ander vetvoer) te hebben. FCT, beschouwd als referentieformulering, werd klassiek per os toegediend door de orale tablet in te slikken met een glas water. Voor ODT en ODF kregen patiënten de instructie de formulering 15 minuten onder de tong te houden zonder water aan te nemen, gevolgd door doorslikken. Veneuze bloedmonsters werden verzameld in standaardbuisjes (Vacutainer, Bd Biosciences, Milaan, Italië) bij 0, 5, 10, 15, 30, 60, 90, 120, en 240 min na toediening van het geneesmiddel. Compensatie door continue infusie van steriele zoutoplossing werd uitgevoerd. Na de dosering werden de proefpersonen gehuisvest tot het voltooien van de bloedbemonstering. Een extra bloedonttrekking werd uitgevoerd op 24 uur na toediening om controle redenen om de volledige geneesmiddelklaring vast te stellen. Als wash-out perioden werden 7 dagen toegestaan tussen één dosering en de volgende. Na de bloedinzameling werd het plasma onmiddellijk geïsoleerd en bewaard bij -80°C tot gebruik.
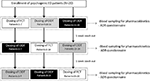
FIGUUR 1. Doseringsschema en beoordelingen voor de evaluatie van farmacokinetische parameters bij 20 patiënten met psychogene erectiestoornissen, onderverdeeld in drie groepen (respectievelijk patiënten 1-7; patiënten 8-14; en patiënten 15-20). Elke groep patiënten kreeg als alternatief per os Filmomhulde tablet (FCT), sublinguale Oro-dispergeerbare tablet (ODT) of sublinguale Oro-dispergeerbare film (ODF) met ten minste 1 week wash-out van elke dosering. Alle formuleringen bevatten 50 mg sildenafil (Sild).
tijdens de huisvesting werd patiënten ook verzocht bijwerkingen (ADR) te registreren in een specifiek ontworpen vorm, aangepast aan de ADR-rapportagevorm van de Agenzia Italiana del Farmaco (AIFA1). Een vertaalde versie van de vragenlijst is beschikbaar als aanvullend materiaal (zie formulier S1). De patiënten werd gevraagd het type bijwerking (en), de totale intensiteit (in een subjectieve beoordelingsschaal van 1, zeer zwak, tot 5, zeer intens), het tijdstip van aanvang en de totale duur te specificeren.
kwantificering van Sildenafil in humaan Serum
voor de kwantificering van serumspiegels van Sild werd 400 µl serummonster toegevoegd van 500 µl methanol aangevuld met de interne standaard (is) benzanilide (5 µg/ml). Vervolgens werd 5 ml ethylacetaat toegevoegd aan het mengsel, de monsters werden vortexed om vloeistof–vloeistof extractie uit te voeren, de twee fasen werden gescheiden door centrifugeren. Het organische gedeelte werd vervolgens verdampt onder vacuümcentrifuge bij 40°C. Het verkregen residu werd opnieuw opgelost met 200 µl methanol en uiteindelijk gebruikt voor analyse van hogedrukvloeistofchromatografie-tandemmassaspectrometrie (HPLC-MS/MS).
hogedrukvloeistofchromatografie-MS / MS analyse gebruikte een systeem Agilent – Varian 1260 en de triple-quadruple detector Agilent-Varian 320 MS chromatografische scheiding werd uitgevoerd op een kolom Fenomenex C-18 Evo 3 × 100 en een mobiele fase gevormd van acetonitril met 0,1% mierenzuur in water met een gradiënt gedetailleerd in aanvullende figuur S2A. Er werd een positieve detectiemodus toegepast voor de overgang 198 > 105 Da van de IS, verkregen bij een capillaire spanning van 40 V en een botsingsenergie van 16 V, terwijl 475 > 100 Da voor Sild met capillaire spanning van 40 V en een botsingsenergie van 22,5 V, respectievelijk. Representatieve chromatogrammen van de IS en Sild in reële monsters worden gerapporteerd in aanvullend figuur S2B.
statistische analyse
farmacokinetische parameters (PK), zoals maximale serumconcentratie (Cmax), tijd tot maximale serumconcentratie (tmax) en oppervlakte onder de curve (AUC) op verschillende tijdstippen, werden berekend met specifieke routines van toepassingen met GraphPad-software (La Jolla, CA, Verenigde Staten). Statistische analyse van gegevens werd uitgevoerd met SPSS 21.0 Voor Windows (SPSS, Chicago, IL, Verenigde Staten). De Kolmogorov-Smirnov test werd gebruikt om de normaliteit van de distributie te controleren. Variabelen die geen normale distributie tonen werden log getransformeerd. Baseline kenmerken van patiënten, PKs, en gegevens van in vitro experimenten werden vergeleken met unpaired Student ‘ s t-tests met Bonferroni–Holm correctie voor meerdere vergelijkingen. Herhaalde metingen ANOVA werd uitgevoerd om verschillen in geneesmiddelafgifte en Sild serumconcentratie te testen. De test van Levene werd gebruikt om de homogeniteit van variantie tussen groepen te testen. Als de homogeniteit van variantie werd geschonden, werd de Welch-test uitgevoerd en werd de respectieve P-waarde gerapporteerd. Het percentage ADR werd vergeleken met de exacte test van χ2. P-waarden < 0.5 werden als statistisch significant beschouwd.
resultaten
in Vitro analyse van afgifte / permeatie van Sildenafil uit de verschillende Geneesmiddelformuleringen
de dynamiek van afgifte en permeatie van Sild uit de drie geneesmiddelformuleringen werd voorheen in vitro onderzocht (Figuur 2). De tijd tot volledige uitsplitsing voor FCT, ODT en ODF werd geëvalueerd door middel van een standaardtest beschreven in de Europese Farmacopee (2016; figuur 2A). ODF toonde de hoogste tijd aan desaggregatie in vergelijking met zowel FCT en ODT (respectievelijk, P = 0,017 en P = 0,008).
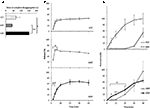
FIGUUR 2. In vitro evaluatie van bio-technologische eigenschappen van FCT ‘ s, ODTs, andODFs die 50 mg Sild bevatten. De resultaten zijn representatief voor drie onafhankelijke experimenten en worden gerapporteerd als gemiddelde waarden ± standaardafwijking. A) resultaten van de aggregatietest, waarbij de tijd (in seconden) tot de volledige aggregatie van de formulering wordt gerapporteerd. Betekenis: * P < 0,05 en **P < 0,01 tussen de aangegeven formuleringen. (B) resultaten van de oplossingstest, waarbij de hoeveelheid Sild die door elke formulering wordt afgegeven als percentage van de dosering van het geneesmiddel wordt vermeld. Significantie: aP < 0,01 vs. FCT; bP < 0,001 vs.ODT. C) resultaten van de permeatietest (beschreven in de rubriek “materialen en methoden”), waarbij de hoeveelheid Sild wordt gerapporteerd die door een membraan van celluloseacetaat wordt doordrongen, als percentage van de hoogste waarde die wordt bereikt door 50 mg zuiver Sildpoeder (discontinue Lijn in het bovenste paneel). Significantie: * P < 0,05 vs. ODT; **P < 0,01 vs. ODT; aP < 0,01 vs. FCT.
om de invloed van dit bewijs op de afgifte van het geneesmiddel uit de formulering te evalueren, werd een standaard ontbindingstest uitgevoerd (Europese Farmacopee, 2016; figuur 2B). Vergeleken met de referentieformulering FCT, toonde ODT een snellere afgifte van het geneesmiddel waarvan de maximale omvang zelfs na slechts 2 minuten vanaf het begin van de test werd bereikt (P = 0,006 vs.FCT). Aan de andere kant was het percentage van het geneesmiddel dat vrijkwam uit ODF binnen de eerste 4 minuten van de assay lager in vergelijking met zowel FCT als ODT (respectievelijk P = 0,004 en P < 0,001). In het bijzonder, toonde ODF een meer progressieve versie van de drug in vergelijking met FCT, het bereiken van de maximale omvang na 20 min vanaf het begin van de test.
op basis hiervan werd de Trans-mucosale permeatie van Sild van elke formulering beoordeeld met een speciaal ontwikkeld hulpmiddel (figuur 2C). Voor referentiedoeleinden werd zuiver Sildcitraat, gebruikt in een gewicht gelijk aan 50 mg Sild, beoordeeld op trans-mucosale permeatie en vertoonde vrije en snelle diffusie tussen de twee kamers. Een bijna tegengesteld profiel werd waargenomen voor FCT, met een verwaarloosbare permeatie tot 30 minuten vanaf het begin van de test. De permeatieprofielen van ODT en ODF toonden een intermediair gedrag in vergelijking met de twee vorige voorwaarden. Binnen de eerste 20 min van de assay, toonde ODF een significant hogere mate van permeatie in vergelijking met ODT (respectievelijk, P = 0,033 bij 5 min, P = 0,003 bij 10 min, en P = 0,041 bij 20 min). Anders dan FCT en ODT die volledig in de donorkamer zijn gedesaggregeerd, bleef een resterende massa van ODF in zachte gelei op het membraan van celluloseacetaat, zelfs aan het einde van de test (aanvullend figuur S2C).
differentiële farmacokinetiek van Sildenafil
twintig mannelijke proefpersonen met psychogene DE aanvaard om als alternatief FCT, ODT of ODF te ontvangen, gescheiden door een week wash-out. Zoals beschreven in de sectie “materialen en methoden”, werd FCT klassiek ingeslikt om de klassieke per os-toediening toe te staan, terwijl ODT en ODF gedurende 15 minuten onder de tong werden gehouden om de sublinguale route te bevorderen. Klinische kenmerken van patiënten worden gerapporteerd in Tabel 1. Serumspiegels van Sild die overeenkomen met de drie doseringscondities worden gerapporteerd in Figuur 3. Een aanzienlijke variabiliteit kenmerkte het serumprofiel van de drie formuleringen. Vergeleken met FCT liet ODT een duidelijke vroege toename van Sild serumspiegels zien; deze trend was echter niet statistisch significant. Aan de andere kant werd voor de ODT-formulering een snellere afname van Sild-spiegels waargenomen bij 120 en 240 minuten na toediening (respectievelijk P = 0,044 en P = 0,024 vs.FCT).
TABEL 1. Klinische kenmerken van de deelnemers aan het onderzoek (N = 20).
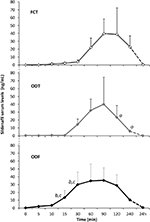
FIGUUR 3. In vivo evaluatie van serumspiegels van Sild, bij 20 patiënten met psychogene ED, die ofwel de FCT per os, of de sublinguale ODT, of de sublinguale ODF toegediend kregen, zoals beschreven in de rubriek ” materialen en methoden.”Gegevens worden gerapporteerd als gemiddelde waarden ± standaardafwijking significantie: AP < 0,05 vs. FCT; bP < 0,01 vs. FCT; cP < 0,05 vs.ODT.
het serumprofiel van de ODF-formulering vertoonde een snellere toename van Sild-spiegels vergeleken met respectievelijk FCT (P = 0,001 en P = 0,003) en ODT (P = 0,048 en P = 0,041) bij 15 en 30 minuten na toediening. In overeenstemming met de langzame desaggregatietijd in vitro (figuur 2B) was de gemiddelde concentratie–tijdcurve van de ODF in vivo soepeler dan die van FCT en ODT (Figuur 3).
farmacokinetische parameters van de drie formuleringen, verkregen uit de analyse van Sild serumspiegels, zijn samengevat in Tabel 2. Hoewel er geen significant verschil werd waargenomen tussen de drie formuleringen in termen van Cmax, tmax en AUC0-240 min, toonde ODF de laagste waarde van Cmax (38,2 ± 23,7 ng/ml) en de kortste Tmax (70,0 ± 24,5 min). In het bijzonder vertoonde ODF een significant hogere waarde van de AUC0-60 min in vergelijking met zowel FCT als ODT (respectievelijk p = 0,005 en P = 0.043), resulterend in een verhoogde relatieve biologische beschikbaarheid van Sild binnen het eerste uur na toediening van ODF via de sublinguale route.

TABEL 2. Farmacokinetische parameters van sildenafil formuleringen.
bijwerkingen
resultaten verkregen uit de zelf toegediende vragenlijst over het type en de kenmerken van ADR die de deelnemers aan het onderzoek ervaren, zijn samengevat in Tabel 3. Een van de bekende ADR gerapporteerd voor Sild (Taylor et al., 2009), de meest voorkomende waren hoofdpijn, blozen, en neusverstopping. Eén patiënt meldde lage spierpijn (graad 1 op de subjectieve beoordelingsschaal) na toediening van FCT. Geen van de patiënten meldde een verandering van het gezichtsvermogen, tachycardie, zwakte of gehoor.

TABEL 3. Bijwerkingen geregistreerd door de deelnemers aan het onderzoek (N = 20).
vergeleken met FCT als referentieformulering vertoonde ODT een onveranderlijke prevalentie van ADR. De persoonlijke perceptie van flushing intensiteit was echter significant lager (P = 0,031). Aan de andere kant vertoonde ODF een verminderde prevalentie van hoofdpijn in vergelijking met FCT (P = 0,043). Verder werden de duur en intensiteit van flushing en verstopte neus waargenomen op lagere niveaus dan zowel FCT (respectievelijk p = 0,011 en P = 0,015) als ODT (respectievelijk p = 0,026 en P = 0,037).
discussie
In deze studie leveren we bewijs dat de sublinguale route van Sild-toediening geassocieerd is met een verhoogde vroege biologische beschikbaarheid van het geneesmiddel en een verbeterd verdraagbaarheidsprofiel. Dit bewijs wordt ondersteund door zowel in vitro onderzoeken, waaruit blijkt dat de Sild formulering wordt gekenmerkt door een langere tijd om te desaggregeren, maar aanzienlijk begunstigd trans-mucosale absorptie, en in vivo bewijzen.
fosfodiësteraseremmers zijn de eerste keuze therapeutische optie voor de behandeling van ED; bijwerkingen die door patiënten worden ervaren worden echter erkend als de meest voorkomende reden voor het staken van de behandeling (Corona et al., 2016). Wijziging van de farmacokinetiek door het ontwerp van nieuwe geneesmiddelformulering kan een aantrekkelijke strategie zijn om het veiligheid/werkzaamheidsprofiel van het geneesmiddel zelf te verbeteren (Mehrotra et al., 2007). In dit verband heeft het verstrijken van het octrooi op Sild-citraat in verscheidene Europese landen in 2013 de mogelijkheid geboden om een aantal nieuwe formuleringen van Sild vrij te geven. Opgemerkt moet worden dat de meeste van de Sild formuleringen beschikbaar op de markt vandaag zijn eigenlijk goedgekeurd als bio-equivalente vormen van de oorspronkelijke FCT (Leoni et al., 2013). Interessant is dat oraal desintegrerende formuleringen, gekenmerkt door snelle desaggregatie in de mond van de patiënt zonder de noodzaak om te slikken met water, zijn ontwikkeld (Goel et al., 2008). Deze nieuwe formuleringen vinden betere naleving in die populaties van patiënten met moeilijkheid in het slikken van conventionele stevige dosering, zoals kinderen, geriatrische patiënten, en dysfagische patiënten. Bovendien, door het verstrekken van hogere mondelinge drugbeschikbaarheid, kunnen mondeling desintegrerende formuleringen gewaardeerde systemen vertegenwoordigen om trans-mucosal, en in het bijzonder sub-lingual, absorptie te bevoordelen (Kathpalia and Gupte, 2013). Met name in Italië zijn twee oraal desintegrerende formuleringen van Sild officieel beschikbaar op Apotheek faciliteiten: de ODTs en de ODFs.
in deze studie hebben we getracht de mogelijke farmacokinetische variaties en het bijbehorende ADR-patroon te evalueren die voortvloeien uit het bevorderen van de Trans-mucosale absorptie van Sild door de sub-linguale toediening van de twee beschikbare oraal desintegrerende formuleringen van het geneesmiddel. De resultaten werden vergeleken met de oorspronkelijke formulering van Sild, namelijk de FCT ‘ s. Interessant is dat we een strikte correlatie hebben gevonden, zowel in vitro als in vitro, tussen de bio-technologische eigenschappen en de PKs van de verschillende formuleringen. In het bijzonder, ondanks een gelijke drugdosering (50 mg) en lichtjes verminderd tarief van drugversie in de oplossingstest, werd ODF gekenmerkt door een grotere tijd aan desaggregatie en hoger tarief van permeatie in het trans-mucosal model enerzijds, en door een verhoogde drug biobeschikbaarheid binnen het eerste uur van het doseren, anderzijds. We zouden dan kunnen veronderstellen dat sub-lingual Sild absorptie wordt begunstigd door een langdurig geneesmiddel-mucosa contact. Dit verschijnsel wordt in het algemeen nagestreefd voor orale trans-mucosale geneesmiddelen, waarbij het gebruik van mucoadhesieve polymeren wordt aanbevolen om een langdurige periode van contact tussen de formulering en de orale mucosa te verzekeren (Lam et al., 2014), in het bijzonder van die drugs, zoals Sild, beïnvloed door lage oplosbaarheid in water (Zayed et al., 2012; Sun et al., 2014). Deze voorlopige resultaten wijzen ook op een mogelijke verbetering van de klinische werkzaamheid voor deze klasse van geneesmiddelen in vergelijking met originele formuleringen. Verdere studies zijn nodig om deze aspecten te verduidelijken.
het meest opvallende bewijs van deze studie is een significante vermindering van de bijwerkingen van sub-linguale toediening van ODF in vergelijking met ODT en FCT toegediend in dezelfde dosering, wat op zijn beurt kan leiden tot een verhoogde therapietrouw bij patiënten. Dit bewijs kan worden geïnterpreteerd in het licht van het principe dat de incidentie van een bijwerking van het geneesmiddel toeneemt door verhoging van de serumspiegels en de blootstellingstijd aan het geneesmiddel zelf (Gupta et al., 2005; Taylor et al., 2009). Ondanks een onveranderlijke globale biobeschikbaarheid in vergelijking met de andere geanalyseerde formuleringen, liet de sub-linguale toediening van ODF een lagere waarde van Cmax en een kortere tmax zien, resulterend in een significant hoger aandeel van Sild biobeschikbaar binnen het eerste uur na toediening. Zo zouden we kunnen speculeren dat de sub-linguale toediening van ODF een efficiënte absorptie van het geneesmiddel combineert met het bereiken van gemiddelde lagere serumspiegels van Sild en een daaruit voortvloeiend lager risico op bijwerkingen. Wij erkennen echter de geringe steekproefomvang als het belangrijkste nadeel van de studie. Verder onderzoek naar grotere cohorten en met verschillende doseringen is vereist om dit probleem te bevestigen.
concluderend, in deze studie rapporteren we dat sublinguale toediening van Sild ODF het verdraagbaarheidsprofiel van het geneesmiddel verbetert door de waarschijnlijke betrokkenheid van een gemodificeerde farmacokinetische in vergelijking met generatorfct ‘ s. Hoewel ODF oorspronkelijk niet voor deze doeleinden werd ontworpen, vormt dit een aantrekkelijke strategie om de therapietrouw van de patiënt te verbeteren. We ontwikkelen verdere vergelijkende studies om de klinische werkzaamheid bij psychogene en organische ED patiënten te beoordelen.
bijdragen van auteurs
ldt en CF coördineerden de studie en stelden het manuscript op. MDRP evalueerde en nam de patiënten in het onderzoek op. EF heeft in-vitro-analyse uitgevoerd. SDA heeft de serumanalyse uitgevoerd. RP voerde de farmacokinetische vergelijking uit. RP, NR, en AG hebben het manuscript kritisch herzien en afgerond.
belangenverstrengeling verklaring
de auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
Dankbetuigingen
wij danken Dr.Alberto Barosso, Dr. Giuseppe Maggioni en Dr. Dimitri Portale voor patiëntenbegeleiding, Dr. Flavia Rosano en Dr. Alice Passadore voor patiëntenmanagement, en alle medewerkers van de eenheid Andrologie en Reproductieve Geneeskunde.
aanvullend materiaal
het aanvullende materiaal voor dit artikel is online te vinden op: https://www.frontiersin.org/articles/10.3389/fphar.2018.00059/full#supplementary-material
figuur S1 / representatieve beelden van de Desintegratietester voor Tablets (A) en het Oplossingsapparaat (B) die respectievelijk voor de desaggregatietest en de oplossingstest worden gebruikt.
figuur S2 / A) Details van de mobiele fasegradiënt die wordt gebruikt voor de analyse van hogedrukvloeistofchromatografie-tandemmassaspectrometrie (HPLC-MS/MS) van serumspiegels van sildenafil (Sild). Representatieve chromatogrammen en massaspectra ‘ s van beide Sild bij de interne standaardbenzanilide in reële monsters worden gerapporteerd (B). C) een representatief beeld van de resterende Oro-dispergeerbare film (gemarkeerd door een discontinue lijn), die blijft bestaan na de permeatietest in het apparaat dat wordt gebruikt voor de in vitro schatting van de Trans-mucosale absorptie door een celluloseacetaatmembraan.
DATA SHEET S1 / Adverse drug reaction questionnaire.
voetnoot
- ^http://www.aifa.gov.it/en/content/reporting-adverse-reaction
Banner, L. L., and Anderson, R. U. (2007). Geïntegreerde sildenafil en cognitieve gedrag sex therapie voor psychogene erectiestoornissen: een pilot studie. J. Sex. Med. 4, 1117–1125. doi: 10.1111 / j. 1743-6109. 2007. 00535.X
PubMed Abstract / CrossRef Full Text / Google Scholar
Bischoff, E. (2004). Potentie, selectiviteit en gevolgen van niet-selectiviteit van PDE-remming. Int. J. Impot. Res.Suppl. 1, S11–S14. doi: 10.1038 / sj.ijir.3901208
PubMed Abstract / CrossRef Full Text / Google Scholar
Boolell, M., Allen, M. J., Ballard, S. A., Gepi-Attee, S., Muirhead, G. J., Naylor, A. M., et al. (1996). Sildenafil: een mondeling actief type 5 cyclische GMP-specifieke phosphodiesterase inhibitor voor de behandeling van erectiele dysfunctie van de penis. Int. J. Impot. Res. 8, 47-52.
PubMed Abstract / Google Scholar
Caretta, N., Palego, P., Ferlin, A., Garolla, A., Bettella, A., Selice, R., et al. (2005). Hervatting van spontane erecties bij geselecteerde patiënten met erectiestoornissen en verschillende graden van verandering van de halsslagader: rol van tadalafil. Euro. Urol. 48, 326–331. doi: 10.1016 / j. eururo.2005.01.013
PubMed Abstract / CrossRef Full Text / Google Scholar
Caretta, N., Palego, P., Schipilliti, M., Ferlin, A., Di Mambro, A., en Foresta, C. (2009). Caverneus artery intima – media dikte: een nieuwe parameter in de diagnose van vasculaire erectiestoornissen. J. Sex. Med. 6, 1117–1126. doi: 10.1111 / j. 1743-6109. 2008. 01112.X
PubMed Abstract / CrossRef Full Text / Google Scholar
Carvalheira, A. A., Pereira, N. M., Maroco, J., and Forjaz, V. (2012). Uitval bij de behandeling van erectiestoornissen met PDE5: een studie naar voorspellers en een kwalitatieve analyse van de redenen voor stopzetting. J. Sex. Med. 9, 2361–2369. doi: 10.1111 / j. 1743-6109. 2012. 02787.X
PubMed Abstract / CrossRef Full Text / Google Scholar
Centrum voor Drug evaluatie en onderzoek (2003). NDA 021400 Levitra (Vardenafil Hydrochloride) tabletten: Beoordeling Van Klinische Farmacologie / Biofarmaceutica. Rockville, Md: Department of Health and Human Services. Silver Spring, MD: Food and Drug Administration.
Google Scholar
Corona, G., Rastrelli, G., Burri, A., Serra, E., Gianfrilli, D., Mannucci, E., et al. (2016). Eerste generatie fosfodiësterase type 5 inhibitors dropout: een uitgebreide beoordeling en meta-analyse. Andrologie 4, 1002-1009. doi: 10.1111 / andr.12255
PubMed Abstract / CrossRef Full Text / Google Scholar
Delvadia, P. R., Barr, W. H., and Karnes, H. T. (2012). A biorelevant in vitro release/permeation system for oral transmucosal dosage forms. Int. J. Pharm. 430, 104–113. doi: 10.1016/j.ijpharm.2012.03.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Eardley, I., Donatucci, C., Corbin, J., El-Meliegy, A., Hatzimouratidis, K., McVary, K., et al. (2010). Pharmacotherapy for erectile dysfunction. J. Sex. Med. 7, 524–540. doi: 10.1111/j.1743-6109.2009.01627.x
PubMed Abstract | CrossRef Full Text | Google Scholar
European Pharmacopoeia (2016). Europees Directoraat voor de kwaliteit van geneesmiddelen &gezondheidszorg (EDQM), 9e Edn. Straatsburg: Raad van Europa.
Google Scholar
Fejős, I., Neumajer, G., Béni, S., and Jankovics, P. (2014). Kwalitatieve en kwantitatieve analyse van PDE-5-remmers in namaakgeneesmiddelen en voedingssupplementen door HPLC-UV met sildenafil als enige referentie. J. Pharm. Biomed. Anaal. 98, 327–333. doi: 10.1016 / j. jpba.2014.06.010
PubMed Abstract / CrossRef Full Text / Google Scholar
Goel, H., Rai, P., Rana, V., en Tiwary, A. K. (2008). Mondeling desintegrerende systemen: innovaties in formulering en technologie. Recente Pat. Drug Deliv. Formul. 2, 258–274. doi: 10.2174/187221108786241660
CrossRef Full Text / Google Scholar
Gupta, M., Kovar, A., en Meibohm, B. (2005). De klinische farmacokinetiek van fosfodiësterase-5-remmers voor erectiestoornissen. J. Clin. Farmacol. 45, 987–1003. doi: 10.1177/0091270005276847
PubMed Abstract / CrossRef Full Text / Google Scholar
Hatzimouratidis, K., Amar, E., Eardley, I., Giuliano, F., Hatzichristou, D., Montorsi, F., et al. (2010). Europese Vereniging voor Urologie. Richtlijnen voor mannelijke seksuele dysfunctie: erectiestoornissen en vroegtijdige zaadlozing. Euro. Urol. 57, 804–814. doi: 10.1016 / j. eururo.2010.02.020
PubMed Abstract / CrossRef Full Text / Google Scholar
Hawksworth, D. J., and Burnett, A. L. (2015). Farmacotherapeutische behandeling van erectiestoornissen. Clin. Farmacol. Ther. 98, 602–610. doi: 10.1002/cpt.261
PubMed Abstract / CrossRef Full Text / Google Scholar
Heinig, R., Weimann, B., Dietrich, H., and Böttcher, M. F. (2011). Farmacokinetiek van een nieuwe orodispergeerbare tabletformulering van vardenafil: resultaten van drie klinische studies. Clin. Drug Investig. 31, 27–41. doi: 10.2165/11584950-000000000-00000
PubMed Abstract / CrossRef Full Text / Google Scholar
Kathpalia, H., and Gupte, A. (2013). Een inleiding tot sneloplossende orale dunne film drug delivery systems: een overzicht. Curr. Drug Deliv. 10, 667–684. doi: 10.2174/156720181006131125150249
PubMed Abstract / CrossRef Full Text / Google Scholar
Lam, J. K., Xu, Y., Worsley, A., and Wong, I. C. (2014). Orale transmucosale drug levering voor pediatrisch gebruik. ADV. Drug Deliv. Rev. 73, 50-62. doi: 10.1016/j.addr.2013.08.011
PubMed Abstract / CrossRef Full Text / Google Scholar
Leoni, L. A., Leite, G. S., Wichi, R. B., and Rodrigues, B. (2013). Sildenafil: twee decennia van voordelen of risico ‘ s? Ouder Wordende Man 16, 85-91. doi: 10.3109 / 13685538.2013.801952
PubMed Abstract / CrossRef Full Text / Google Scholar
Lotti, F., Corona, G., Castellini, G., Maseroli, E., Fino, M. G., Cozzolino, M., et al. (2016). Sperma kwaliteit stoornis wordt geassocieerd met seksuele disfunctie volgens de ernst. Brom. Reprod. 31, 2668–2680. doi: 10.1093 / humrep / Dew246
PubMed Abstract | CrossRef Full Text | Google Scholar
Ludwig, W., and Phillips, M. (2014). Organische oorzaken van erectiestoornissen bij mannen onder de 40. Urol. Int. 92, 1–6. doi: 10.1159/000354931
PubMed Abstract / CrossRef Full Text / Google Scholar
Lugnier, C. (2006). Cyclische nucleotide fosfodiësterase (PDE) superfamilie: een nieuw doel voor de ontwikkeling van specifieke therapeutische agenten. Farmacol. Ther. 109, 366–398. doi: 10.1016 / j. pharmthera.2005.07.003
PubMed Abstract / CrossRef Full Text / Google Scholar
Mehrotra, N., Gupta, M., Kovar, A., en Meibohm, B. (2007). De rol van farmacokinetiek en farmacodynamiek in fosfodiësterase-5-remmer therapie. Int. J. Impot. Res. 19, 253-264. doi: 10.1038 / sj.ijir.3901522
PubMed Abstract / CrossRef Full Text / Google Scholar
Munoz, M., Bancroft, J., and Marshall, I. (1993). De prestaties van de Rigiscan bij het meten van penistumescentie en stijfheid. Int. J. Impot. Res. 5, 69-76.
Google Scholar
Porst, H., Burnett, A., Brock, G., Ghanem, H., Giuliano, F., Glina, S., et al. (2013). De ISSM Standards Committee for Sexual Medicine. Sop conservatieve (medische en mechanische) behandeling van erectiestoornissen. J. Sex. Med. 10, 130–171. doi: 10.1111 / jsm.12023
PubMed Abstract / CrossRef Full Text / Google Scholar
Sun, D., Wei, X., Xue, X., Fang, Z., Ren, M., Lou, H., et al. (2014). Verbeterde orale absorptie en therapeutisch effect van acetylpuerarine op basis van D-α-tocoferyl polyethyleenglycol 1000 succinaat nanoemulsies. Int. J. Nanomedicine 9, 3413-3423. doi: 10.2147 / IJN.S63777
PubMed Abstract / CrossRef Full Text / Google Scholar
Taylor, J., Baldo, O. B., Storey, A., Cartledge, J., and Eardley, I. (2009). Verschillen in duur van bijwerkingen en gerelateerde hinderniveaus tussen fosfodiësterase type 5-remmers. BJU Int. 103, 1392–1395. doi: 10.1111 / j. 1464-410X. 2008. 08328.X
PubMed Abstract / CrossRef Full Text / Google Scholar
Zayed, R., Kamel, A. O., Shukr, M., and El-Shamy, A. H. (2012). Een in vitro en in vivo vergelijkende studie van direct gecomprimeerde vaste dispersies en gevriesdroogde sildenafil Citraat tabletten voor sublinguaal gebruik voor de behandeling van pulmonale arteriële hypertensie. Acta Pharm. 62, 411–432. doi: 10.2478/v10007-012-0027-9
PubMed Abstract | CrossRef Full Text | Google Scholar